Аллотропия углерода и кремния
Аллотропные формы углерода
Углероду свойственно явление аллотропии. Например, у углерода 4 аллотропные формы: графит, алмаз, карбин, фуллерен. По составу это все тот же углерод, но ввиду особенностей строения молекулы каждого из них, имеются различия в физических и химических свойствах.
Открытие фуллерена произошло относительно недавно, в 1985 г, их особенность в строении молекулы, похожей на футбольный мяч. Наиболее распространены молекулы фуллерена С60, состоящего из 60 атомов углерода,и фуллерена С70, состоящего из 70 атомов углерода.
Благодаря своему строению, обладает уникальными свойствами, который открывает широкий спектр применений. Начиная применениями в физике, заканчивая медициной. Молекула является мощнейшим антиоксидантом, используемая даже в борьбе с ВИЧ.
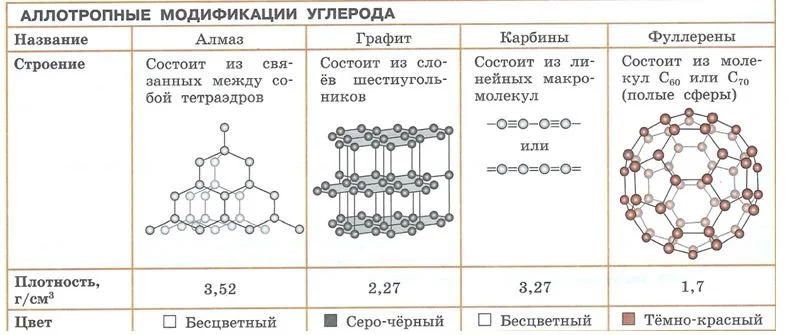 Аллотропные модификации углерода Источник
Аллотропные модификации углерода Источник
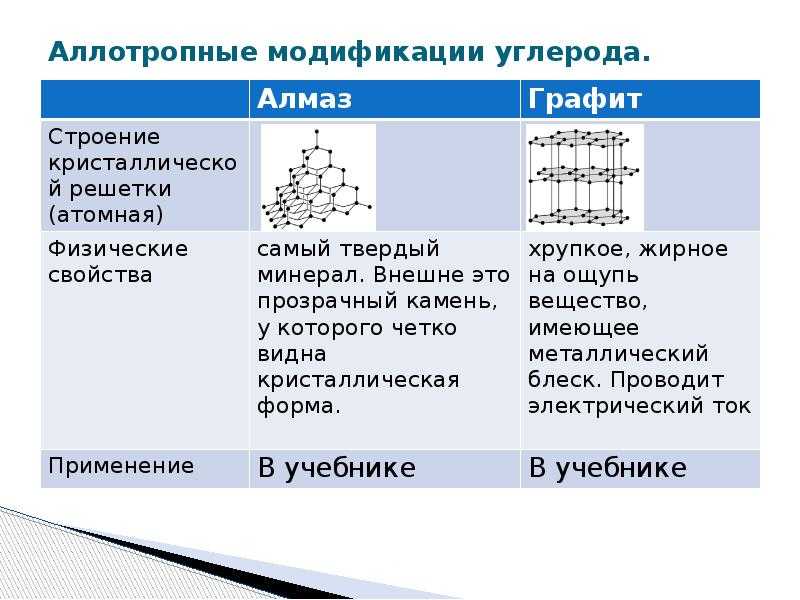
Графит и алмаз нам хорошо знакомы. Первый используется как грифель для простого карандаша, второй является драгоценным камнем, но ввиду своей прочности используется и в строительстве, и в медицине и т.д. Отличны они по своим физическим свойствам, в силу различий строений графических решеток.
Графит вещество темно-серого цвета, не поддается плавлению, обладает металлическим блеском и достаточно мягкий. Его кристаллическая решетка атомная. Это означает, что в узлах таких решеток атомы, связаны ковалентной полярной или неполярной связью. Такая кристаллическая решетка влияет и на свойства вещества, придавая тугоплавкость, нерастворимость в воде.
 Изображение графита при нахождении в природе и графит в грифеле карандаша.
Изображение графита при нахождении в природе и графит в грифеле карандаша.
Алмаз – самое твердое вещество на земле. Цвета не имеет.Плавлению не поддается. Высока твердость и тугоплавкость алмаза объясняется строением кристаллической решетки.Связи между атомами углерода – ковалентные неполярные, они равны по длине и энергии. Поэтому сложно разорвать их. Иначе называют «кубической аллотропной формой углерода».
 Алмазы до и после огранки
Алмазы до и после огранки
Карбин — это еще одна аллотропная модификация углерода, по последним данным это вещество считается тверже алмаза.Было впервые получено и открыто в 1960-х годах. Примечательно, что сначала его получили в лаборатории, а после обнаружили в природе, в виде вкраплений в чаоите (минерал белого цвета, называемый иначе «белый углерод»), графите и в метеоритах.Обладает широкими набором свойств. В обычном состоянии порошкообразное вещество. Также тугоплавкое.
 Чаоит
Чаоит
Аллотропия кремния
Аллотропия кремния выражена двумя видами кремния: аморфным и кристаллическим. Это два вещества,одинаковых по составу, но различные построению молекул. Эти отличия наделяют их разными физическими и химическими свойствами, а также различиями во внешнем виде.
Цвет кристаллического кремния темный, почти черный. Присутствует металлический блеск. Твердый на ощупь, при этом хрупкий. Обладает свойствами полупроводником. Полупроводники – вещества, способные проводить электричество. Но по своей способности проводить последнее они находятся между проводниками, хорошо проводящими электрический ток, и диэлектриками, веществами, плохо проводящими электрический ток.
Кипит и плавится при больших температурах, реакционно не активен. Структуру имеет подобную алмазу.
Аморфный кремний буро-красный по цвету, порошкообразен. Хорошо впитывает воду, но структура такая же как у кристаллического.
 Аллотропия кремния
Аллотропия кремния
Некоторые химические элементы и их модификации
Неметаллы
- Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.
- Сера — вторая по подверженности аллотропии среди неметаллов. Основные ее виды: ромбическая, моноклинная и пластическая. При нормальных условиях окружающей среды моноклинная и пластическая модификации серы переходят в ромбическую.
- Фосфор — имеет 11 аллотропных форм, различающихся числом атомов в молекуле, химическими связями и свойствами, из которых белый фосфор, красный фосфор и черный фосфор имеют устойчивые формы и встречаются в природе, остальные формы распадающиеся и в природе не встречаются.
- Селен — в свободном состоянии бывает в трех видах: красный цикло-Se8, гексагональный или серый селен Se и чёрный селен.
- Водород — бывает в виде o-H2 (орто-водород) и p-H2 (пара-водорода). Молекулы o-H2 и p-H2 отличаются построением ядерных спинов. У o-H2 они параллельные, у p-H2 антипараллельные.
- Кислород — модифицируется в два вещества: Кислород (O2) и Озон (O3).
Полуметаллы
- Бор — встречается в более, чем в 10 состояниях в аморфной и кристаллической формах. Физические свойства этих форм различны.
- Кремний — бывает в аморфной и кристаллической формах. У кристаллической модификации решётка атомная, алмазоподобная.
- Сурьма — имеет четыре металлические и три аморфные аллотропные модификации. Металлические формы существуют при разном давлении. Аморфные формы сурьмы: взрывчатая, чёрная и жёлтая.
- Мышьяк — встречается в трех аллотропных состояниях: в виде неметалла или жёлтый мышьяк, в виде полуметаллического полимера или серый мышьяк, в виде неметаллической молекулярной структуры или чёрный мышьяк.
Металлы
-
Железо — бывает в виде четырех кристаллических модификаций:
- α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;
- β-Fe. Имеет решётку объемноцентрированную кубическую. Существует при температурах от 769 °C до 917 °C. Обладает магнитными свойствами парамагнетики;
- γ-Fe или аустенит. Имеет решётку гранецентрированную кубическую. Существует при температурах от 917 °C до 1394 °C;
- δ-Fe. Имеет решётку объемноцентрированную кубическую. Имеет устойчивость при температуре выше 1394 °C.
- Олово — имеет две аллотропные формы: серое олово (α-Sn) с алмазоподобной кристаллической решёткой в виде мелкокристаллического порошка и белое олово (β-Sn) в виде пластичного серебристого металла, а также одну аллотропическую модификацию гамма-олово (γ-Sn) с ромбической структурой. Оно высокотемпературное.
Аморфный углерод

Аморфный углерод можно представить как своего рода пористую губку с множеством произвольно расположенных гексагональных и тетраэдрических сеток. В этой минеральной матрице они могут улавливать другие элементы, которые могут уплотнять или расширять указанную губку; и таким же образом его структурные ядра могут быть больше или меньше.
Таким образом, в зависимости от процентного содержания углерода получают различные типы аморфных углеродов; такие как сажа, древесный уголь, антрацит, технический углерод, торф, кокс и активированный уголь.
На первый взгляд, все они выглядят отдаленно похожими (верхнее изображение), с градациями черного, тусклого или металлического и сероватого оттенков.
Не все аморфные атомы углерода имеют одинаковое происхождение. Растительный углерод, как следует из названия, является продуктом сгорания растительных масс и древесины. А технический углерод и кокс являются продуктами разных стадий и условий нефтяных процессов.
Хотя они не кажутся очень привлекательными и можно полагать, что они служат только в качестве топлива, пористость их твердых частиц привлекает внимание в технологических процессах очистки, таких как абсорбенты и хранение веществ, а также в качестве каталитических носителей
Фуллерены
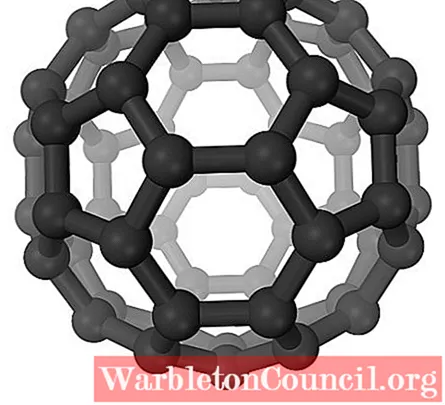
В фуллеренах шестиугольники все еще сохраняются, но, кроме того, появляются пятиугольники, все с sp-атомами углерода.2. Листы или слои уже оставлены: теперь они сложены так, что образуют мяч, похожий на футбольный мяч; и, в зависимости от количества атомов углерода, до мяча для регби.
Фуллерены — это молекулы, различающиеся по размеру. Самый известный из них — C60 (верхнее изображение). Эти углеродные аллотропы следует рассматривать как воздушные шары, которые могут сжиматься вместе, образуя кристаллы, в которых ионы и другие молекулы могут быть захвачены в их пустотах.
Эти шарики являются специальными носителями или опорами для молекул. Как? Через ковалентные связи с его поверхностью, особенно с соседними атомами углерода шестиугольника. Затем говорят, что фуллерен функционализирован (экзоэдральный аддукт).
Его стены можно стратегически сломать, чтобы внутри могли храниться молекулы; напоминающий сферическую капсулу. Точно так же эти шары могут иметь трещины и одновременно функционировать; все будет зависеть от приложения, для которого они предназначены.
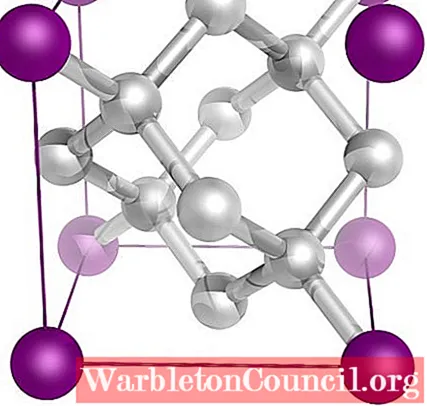
И, наконец, самый известный из всех аллотропов углерода: алмаз (хотя не все являются углеродом).
Структурно состоит из атомов углерода sp.3, образуя четыре связи C-C и трехмерную сеть тетраэдров (верхнее изображение), кристаллическая ячейка которой кубическая. Это самый твердый из минералов, и его температура плавления близка к 4000ºC.
Их тетраэдры способны эффективно передавать тепло по кристаллической решетке; но не так с электричеством, потому что его электроны очень хорошо расположены в его четырех ковалентных связях, и он не может никуда уйти. Следовательно, это хороший проводник тепла, но это электрический изолятор.
В зависимости от того, как он огранен, он может рассеивать свет под разными яркими и привлекательными углами, поэтому они так популярны как драгоценные камни и украшения.
Сеть очень устойчива, потому что для перемещения тетраэдров потребуется большое давление. Это свойство делает его материалом с высокой механической прочностью и твердостью, способным делать точные и чистые разрезы, как у скальпеля с алмазным наконечником.
Его цвета зависят от кристаллографических дефектов и примесей.
Токсическое действие углерода
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5—0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)⋅109 Бк/сутки 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и лёгких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14С (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0⋅104 Бк/л, предельно допустимое поступление через органы дыхания 3,2⋅108 Бк/год.
- https://www.poznavayka.org/himiya/uglerod
- https://wiki2.org/ru/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
- http://lifebio.wiki/%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
- https://www.alto-lab.ru/elements/uglerod
Аллотропия, это
Понятия «Аллотропия» имеет древнегреческие корни: αλλος — другой, τροπος — свойство.
Термин вошел в обиход с 1841 благодаря шведскому ученому, И. Я. Берцелиусу, в целях обозначения различных форм проявления одного и того же химического элемента.
Аллотропия химических элементов может проявляться в виде:
- аллотропии состава, когда различно число атомов в молекуле,
- аллотропии формы, когда различны строения кристаллических решеток.
В современной химии термин «Аллотропия» используется для простых веществ, вне зависимости от их агрегатного состояния.
Для веществ с твёрдым агрегатным состоянием, независимо от того, это вещество простое или сложное, используется термин «Полиморфизм» (от греческого слова Διαφοροποιημένο — многообразный).
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует с неметаллами при нагревании
| Реагент | Уравнение | Описание |
|---|---|---|
| O2 | 2C + O2 →to 2CO↑2CO + O2 →to 2CO2↑ | Продуктами горения углерода являются CO и CO2(монооксид углерода и диоксид углерода соответственно).
Известен также неустойчивый недооксид углерода C3O2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты.
На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит). |
| S Se | C + S →to CS2 C + Se →to CSe2 | При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2.
Получен селенид углерода CSe2. |
| H2 F2 | C + 2H2 → to,P, cat CH4↑ C + 2F2 →>900oC CF4 | Из углерода можно получить метан в присутствии оксидов железа, однако гораздо практичнее получать метан из синтез газа.
Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C. |
| Si | C + Si →to SiC | При сплавлении получается карбид кремния. |
| N2 | 2C + N2 →to (CN)2 | При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан.
При высоких температурах взаимодействием углерода со смесью H2 и N2 получают синильную кислоту:
Также такой же реакцией получают циан
|
| P | Не реагирует |
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения.
| Уравнение | Описание |
|---|---|
| C + H2O →to CO↑ + H2↑ | Важна в промышленности реакция углерода с водяным паром для получения синтез газа |
| 3C + S + 2KNO3 →to K2S + 3CO2↑ + N2↑ | Горение чёрного пороха. |
| 5C + 4KNO3 → 2K2CO3 + 3CO2↑ + 2N2↑ C + 2KNO3 → 2KNO2 + CO2↑ | С калиевой селитрой углерод проявляет восстановительные свойства. |
| 3C + BaSO4 → BaS + 2CO↑ + CO2↑ | Восстанавливает сульфат бария |
| C + MxOy →to M + CO↑ C + CaO → 2500oC CaC2 + CO↑ | При сплавлении углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. |
С большинством металлов углерод образует карбиды, например:
- 4Al + 3C →t Al4C3
- Ca + 2C →t CaC2
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Ковалентные связи углерода
Прежде чем обратиться к некоторым из известных аллотропов углерода, необходимо рассмотреть, как атомы углерода связаны.
Согласно теории валентных связей, углерод имеет четыре электрона в валентной оболочке, с которыми они образуют ковалентные связи. Благодаря электронному продвижению и гибридизации четыре электрона могут быть размещены на четырех отдельных орбиталях, чистых или гибридных.
Таким образом, углерод может образовывать максимум четыре связи.
ОКРУГ КОЛУМБИЯ. Поскольку имеется четыре связи C-C, атомы достигают октета валентности и становятся очень стабильными. Однако это не означает, что этих звеньев не может быть только три, например, в шестиугольниках.
Химические свойства углерода
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Нахождение в природе
Было оценено, что Земля в целом состоит из 730 ppm углерода, с содержанием 2000 ppm в ядре и 120 ppm в мантии и коре. Так как масса Земли 5,972⋅1024 kg, то это предполагает наличие 4360 миллионов гигатонн углерода.
Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода CO2, в воздухе 0,046 % CO2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~17,5 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
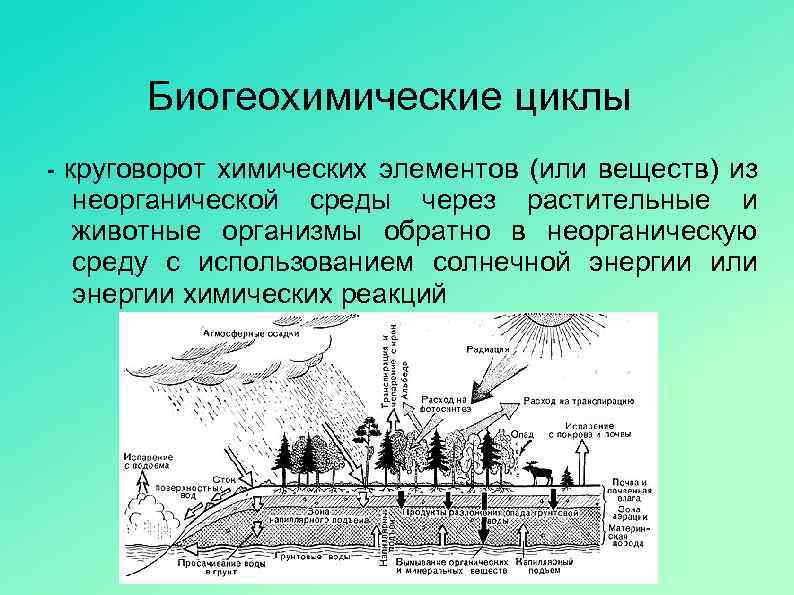
Кругооборот углерода в природе включает биологический цикл, выделение CO2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоёв океанических вод, а также при дыхании, брожении, гниении. Биологический цикл состоит в том, что углерод в виде CO2 поглощается из тропосферы растениями в процессе фотосинтеза. Затем из биосферы он вновь возвращается в геосферу, частично через организмы животных и человека, и в виде CO2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Аллотропия химических элементов (2 часть):
| 31 | Галлий | Ga | Несколько аллотропных модификаций галлия, из которых устойчивым в условиях окружающей среды является α-галлий |
| 32 | Германий | Ge | 2 аллотропные модификации германия:
— α-германий с кубической алмазной кристаллической решёткой, — β-германий с тетрагональной кристаллической решёткой |
| 33 | Мышьяк | As | 3 аллотропные модификации мышьяка:
— α-мышьяк, серый мышьяк (наиболее распространенная, металлическая модификация) с ромбоэдрической (тригональной) кристаллической решёткой, — β-мышьяк, чёрный мышьяк (неметаллическая модификация) в виде: стеклянной аморфной чёрной формы мышьяка или метастабильной орторомбической чёрной формы мышьяка, — γ-мышьяк, жёлтый мышьяк (неметаллическая модификация) |
| 34 | Селен | Se | Несколько аллотропных модификаций селена, в т.ч.:
— γ-селен, серый кристаллический селен, металлический селен (наиболее устойчивая форма) |
| 35 | Бром | Br | |
| 36 | Криптон | Kr | |
| 37 | Рубидий | Rb | |
| 38 | Стронций | Sr | 3 аллотропные модификации стронция:
— α-стронций с кубической гранецентрированной кристаллической решёткой, — β-стронций с гексагональной кристаллической решёткой, — γ-стронций с кубической объёмно-центрированной кристаллической решёткой |
| 39 | Иттрий | Y | 2 аллотропные модификации иттрия:
— α-иттрий с гексагональной плотноупакованной кристаллической решёткой, — β-иттрий кубической объёмно-центрированной кристаллической решёткой |
| 40 | Цирконий | Zr | 3 аллотропные модификации циркония:
— α-цирконий с гексагональной плотноупакованной кристаллической решёткой, — β-цирконий с кубической объёмно-центрированной кристаллической решёткой, — ω-цирконий с гексагональной кристаллической решёткой |
| 41 | Ниобий | Nb | |
| 42 | Молибден | Mo | |
| 43 | Технеций | Tc | |
| 44 | Рутений | Ru | |
| 45 | Родий | Rh | |
| 46 | Палладий | Pd | |
| 47 | Серебро | Ag | |
| 48 | Кадмий | Cd | |
| 49 | Индий | In | |
| 50 | Олово | Sn | 4 аллотропные модификации олова:
— α-олово, серое олово, с кубической алмазной кристаллической решёткой, — β-олово, белое олово, с тетрагональной объёмно-центрированной кристаллической решёткой, — γ-олово, — σ-олово |
| 51 | Сурьма | Sb | Несколько аллотропных модификаций сурьмы, в т.ч.:
— металлическая сурьма (металлическая форма) – наиболее стабильная форма, — взрывчатая сурьма, — чёрная сурьма, — жёлтая сурьма |
| 52 | Теллур | Te | 2 аллотропные модификации теллура:
— α-теллур (кристаллический, металлический теллур) с гексагональной кристаллической решёткой, — аморфный теллур в виде чёрно-коричневого порошка |
| 53 | Йод | I | |
| 54 | Ксенон | Xe | 2 аллотропные модификации ксенона:
— ксенон с кубической гранецентрированной кристаллической решёткой, — ксенон с гексагональной плотноупакованной кристаллической решёткой |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | 2 аллотропные модификации бария:
— α-барий с кубической объёмно-центрированной кристаллической решёткой, — β-барий |
| 57 | Лантан | La | 3 аллотропные модификации лантана:
— α-лантан с двойной гексагональной плотноупакованной кристаллической решёткой, — β-лантан с кубической гранецентрированной кристаллической решёткой, — γ-лантан с кубической объёмно-центрированной кристаллической решёткой |
| 58 | Церий | Ce | 4 аллотропные модификации церия:
— α-церий с кубической гранецентрированной кристаллической решёткой, — β-церий с двойной гексагональной плотноупакованной кристаллической решёткой, — γ-церий с кубической гранецентрированной кристаллической решёткой, — δ-церий с кубической объемно-центрированной кристаллической решёткой |
| 59 | Празеодим | Pr | 2 аллотропные модификации празеодима:
— α-празеодим с двойной гексагональной плотноупакованной кристаллической решёткой, — β-празеодим с кубической объёмноцентрированной кристаллической решёткой |
| 60 | Неодим | Nd | 2 аллотропные модификации неодима:
— α-неодим с двойной гексагональной плотноупакованной кристаллической решёткой, — β-неодим с кубической объемно-центрированной кристаллической решёткой |
Немного истории
Карбин — называют ещё УГЛЕРОД АЛЕКСЕЯ СЛАДКОВА.
В чистом виде углерод встречается в двух отличающихся формах: в виде алмаза и графита.
В 1960 году карбин был синтезирован советским химиком А.М. Сладковым 1922–1982 в стенах Института элементоорганических соединений в Москве и названо им карбин. Ему было не изестно, что, обладая уникальными свойствами, это искусственно созданное вещество заинтересовало весь мир и началось его практическое использование в разных областях жизнедеятельности человека, например, в медицине и электронике.
В 1968 году американские ученые, А. Эль Гореси и Г. Донней, исследуя образцы метеоритного кратера (ФРГ, Бавария), деминерализовали их обработкой различными кислотами. В нерастворимом концентрате это был графит. Учёные обнаружили в нём вкрапления неизвестного вещества серебристо-белого цвета —углерода. Оптические свойства вещества абсолютно не были похожи на свойства природного алмаза или искусственно полученной его кристаллической модификации – лонсдейлита. Обнаруженное вещество оказалось новой аллотропной формой углерода (“белого углерода”), что было подтвердило исследованием его с помощью рентгенографии. Учёные пришли к выводу, что эта форма угреда образовалась из графита в результате падения метеорита под воздействием высокой температуры и давления.
Самое парадоксальное в этой истории то, что существование карбина, который в лаборатории А.М. Сладкова можно было увидеть, потрогать, провести с ним опыты, до обнаружения его в природе официально не признавалось. Точнее, осторожничали с его признанием, тем самым еще раз подтверждая, сколь все же сильны в науке консервативные проявления, сколь трудно доказывать ошибочность утверждений признанных авторитетов. Один из первых, кто решился бросить вызов авторитету предшественников, стал талантливый русский ученый Алексей Михайлович Сладков. Проведенная им в Институте элементоорганических соединений работа, которую отличали, как утверждают сотрудники его лаборатории И. Гольдинг и Н. Васнева, “удивительная тонкость и ясность замысла”, – окислительная поликонденсация ацетилена – привела к открытию новой линейной аллотропной формы углерода.
Будучи сыном известного русского ученого-химика репрессированного в тридцатых годах , профессора Московского химико-технологического института им. Д.И. Менделеева, научного руководителя крупнейшего Института пищевых продуктов и красителей (НИОПИК), А.М. Сладков не находил признания в то время. Он всячески уклонялся от общественных дел и не был в рядах КПСС из-за отца. НЕ трудно догадаться: (…хотя бы уже по тому, что он (его отец) трижды(!) приговаривался к расстрелу. Чтобы сломать человека, изощренные изуверы-палачи шли и на такое: приговор – потом его отмена, новый приговор – и снова отмена. В третий раз отмены не последовало…)
Авторское свидетельство на способ получения карбина Комитетом по делам изобретений и открытий при Совете Министров СССР была зарегистрировано как открытие с приоритетом 1960 года лишь 7 декабря 1971 года. Т.е. спустя одиннадцать лет после серии успешных опытов. Потребовалось одиннадцать лет ожидания , чтобы сломить недоверие к открытию, опровергающему мировые авторитеты. Получив карбин, А.М.Сладков пришёл к мысли о множественности карбиновых форм углерода, о существовании большого количества основных углеродных полимеров. Последующие исследования ученых эту догадку подтвердили. Часто в научной литературе имеют место публикации, заявляющие о синтезе новой кристаллической формы или алло-тропной модификации углерода.
В подверждении этому в 1985 году, например, было совершено открытие большого семейства сферообразных углеродных молекул, названных фуллеренами. Данное открытие дало новый толчок исследованиям во всем мире в области углерода и его аллотропных форм. Авторам очередного открытия – группе американских ученых – принесло в 1996 году Нобелевскую премию. Всё это не означает ли, что, будучи первооткрывателем этих новых форм углеродных молекул, российский ученый имеет все основания на право претендовать, больше того, получить за своё выдающееся открытие КАРБИНА Нобелевскую премию!?
Графитовый

На верхнем изображении представлена модель со сферами и нитями кристаллической структуры графита. К счастью, тени сфер помогают визуализировать π-облака, являющиеся продуктом делокализации их неспаренных электронов. Об этом упоминалось в первом разделе без особых подробностей.
Эти π-облака можно сравнить с двумя системами: системой бензольных колец и системой «электронных морей» в металлических кристаллах.
Орбитали п они соединяются вместе, чтобы построить трек, по которому электроны свободно перемещаются; но только между двумя шестиугольными слоями; перпендикулярно им, нет потока электронов или тока (электроны должны пройти через атомы углерода).
Когда происходит постоянная миграция электронов, постоянно образуются мгновенные диполи, которые индуцируют другие диполи атомов углерода, расположенные выше или ниже; то есть слои или листы графита остаются едиными благодаря лондонским силам дисперсии.
Эти гексагональные слои, как и следовало ожидать, создают гексагональный кристалл графита; или, скорее, серия маленьких кристаллов, соединенных под разными углами. Π-облака ведут себя так, как если бы они были «электрическим маслом», позволяя слоям соскальзывать с кристаллов при любых внешних возмущениях.
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…
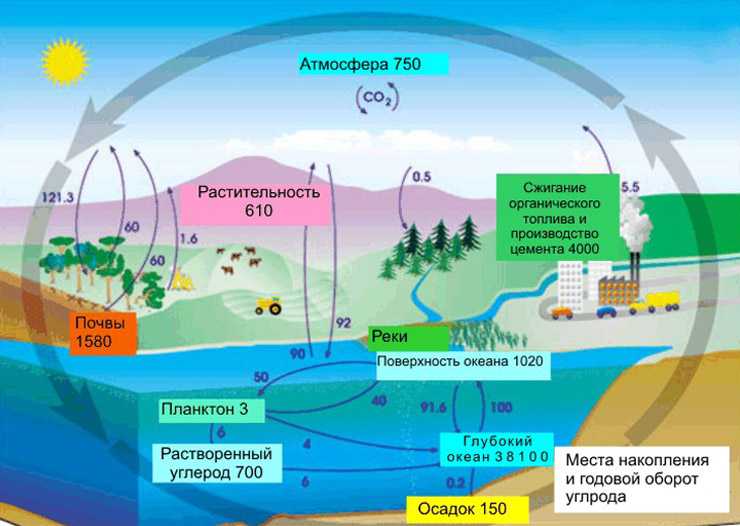 Круговорот углерода в природе
Круговорот углерода в природе
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
-
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
-
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
-
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
-
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
-
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.