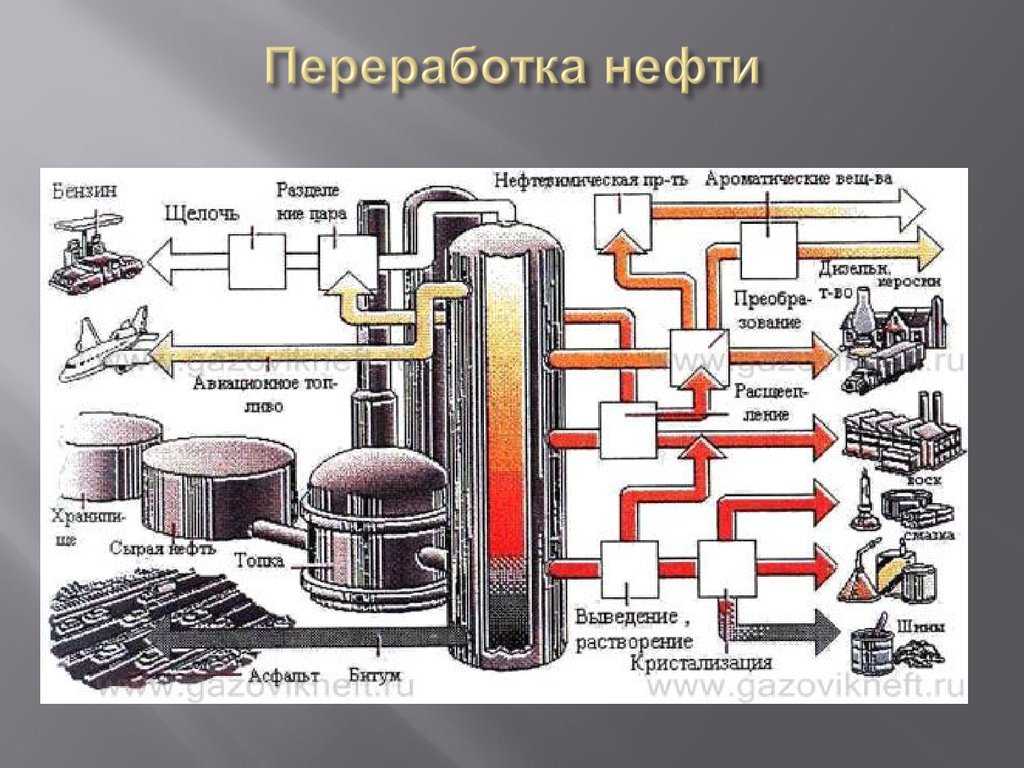
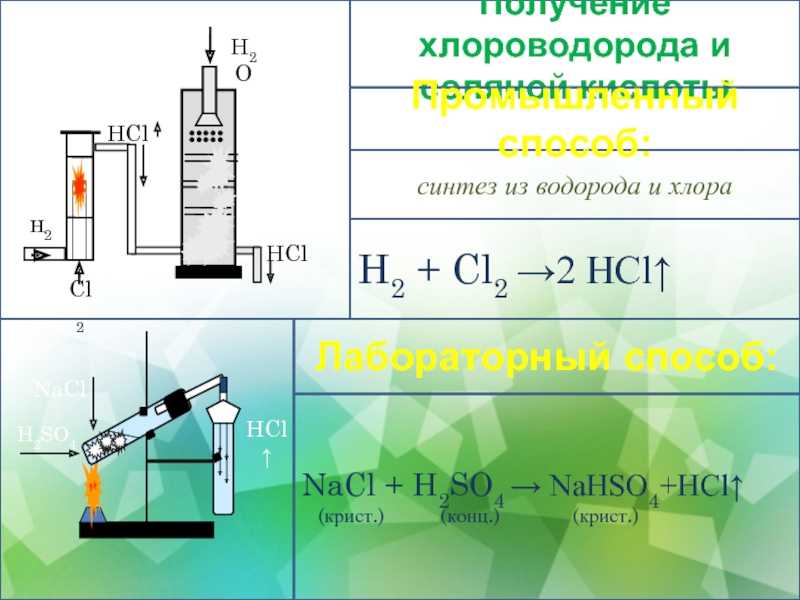
Производство серной кислоты
В качестве серосодержащего сырья для производства серной кислоты могут быть использованы сера или сероводород (побочные продукты нефтепереработки), минерал пирит FeS2, а также сульфиды некоторых других d-элементов. Никакие другие виды сырья не используются.
В настоящий момент основным сырьем для производства серной кислоты являются сероводород и сера, поскольку они в огромных количествах образуются в качестве побочных продуктов нефтепереработки.
Однако же в школьной программе пока еще по-прежнему считается, что серная кислота производится преимущественно из пирита, в связи с чем и мы будем рассматривать основные стадии производства серной кислоты именно этого же сырья.
Первая стадия
Заключается в сжигании предварительно измельченного пирита в токе обогащенного кислородом воздуха. Процесс протекает в соответствии с уравнением:
Обжиг осуществляют при температуре около 800 оС в печи для обжига. В процессе обжига используют так называемый метод кипящего слоя – частицы измельченного пирита подаются в печь сверху, а воздух — снизу. В результате этого раскаленные частицы пирита оказываются подвешенными в токе воздуха, внешне напоминая кипящую жидкость.
После обжига пирита полученный печной газ, содержащий диоксид серы, отделяется от твердых примесей огарка (Fe2O3) с помощью циклона. Циклоном называют аппарат, в котором происходит грубая очистка печных газов за счет центробежной силы от наиболее крупных твердых частиц. Далее после грубой очистки смесь газов проходит более глубокую очистку уже от оставшихся мелких твердых частиц с помощью электрофильтра. Принцип действия электрофильтра основан на том, что к наэлектризованным металлическим пластинам прилипает пыль, которая после скопления ссыпается с них под собственным весом в приемник.
После очистки от твердых примесей печной газ направляется в нижнюю часть так называемой сушильной башни, в верхнюю часть которой впрыскивается концентрированная серная кислота на встречу газу. При таком варианте осуществления фактически сталкиваются два потока — смеси газов, идущей снизу, и струи жидкой концентрированной серной кислоты, текущей сверху. Очевидно, что в результате этого достигается максимальная степень «смешения» газа с осушающей жидкостью. Данный прием носит название принципа противотока.
Вторая стадия
После очистки от твердых примесей и осушки концентрированной серной кислотой газы поступают в контактный аппарат. В контактном аппарате расположены полки с катализатором V2O5, который катализирует взаимодействие диоксида серы с кислородом в соответствии с уравнением:
Аналогично реакции взаимодействия азота с водородом, рассмотренной выше, данная реакция также является каталитической, экзотермической и протекает с уменьшением количества газообразных веществ. Поэтому с точки зрения принципа Ле Шателье ее следовало бы проводить при низких температурах. Однако при низких температурах скорость реакции крайне низка, и ее осуществляют при оптимальной температуре около 400-500 оС. Смещения равновесия реакции в сторону разложения SO3 при повышении температуры удается практически полностью избежать, проводя реакцию при повышенном давлении.
Третья стадия (заключительная)
После второй стадии образовавшийся триоксид серы поступает в часть установки, называемую поглотительной башней.
Из названия данного аппарата логичным было бы предположить, что триоксид серы в нем поглощается в этой части установки водой, ведь триоксид серы, взаимодействуя с водой, образует серную кислоту. Однако в реальности серный ангидрид SO3поглощают не водой (!!!), а концентрированной серной кислотой. Связано это с тем, что при смешении серного ангидрида с водой выделяется колоссальное количество теплоты, в результате чего сильно возрастают температура, давление и образуются мельчайшие капли трудноуловимого сернокислотного тумана.
В результате поглощения SO3 концентрированной серной кислотой фактически образуется раствор SO3 в безводной серной кислоте, который называют олеумом. Далее образующийся олеум собирается в металлические емкости и отправляется на склад. Серную кислоту необходимой концентрации получают, добавляя к олеуму воду в нужной пропорции. В результате добавления воды избыток SO3 превращается в серную кислоту.
Что такое электролиз
Чтобы понять, что такое электролиз, нужно представить систему, состоящую из электродов с противоположной полярностью, погруженных в жидкий электролит. Электролиз – система процессов, работающих при взаимодействии элементов системы в присутствии постоянного электрического тока из стороннего источника и приводящих к возникновению ионного тока.
На аноде анионы отдают свободные электроны, производя окислительную реакцию. Катионы, наоборот, забирают на катоде электроны, проводя восстановительную реакцию, имеющую вид Men+ + ne → Me (где n – валентность металла). Так происходит окислительно-восстановительный процесс в системе.

Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
-
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
-
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
-
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Электролиз и законы Фарадея
Майкл Фарадей – английский физик-экспериментатор, совершивший несколько важных открытий, касающихся электромагнитных явлений. Электрохимические исследования природы реакций, опубликованные ученым в 1836 году, позволили ему сформулировать законы электролиза. Они формулируют связь между количеством вещества, полученного в процессе электрохимической реакции, и объемом электроэнергии, повлиявшей на электролит.
Первый закон
В общем виде первое правило электролиза Фарадея звучит так: масса вещества, присоединившаяся к электроду при реакции прямо пропорциональна объему электричества, прошедшего через электролит с помощью электродов. Формула реакции:
m = kq = k*I*t
(значения переменных: q – заряд, k –электрохимический эквивалент (коэффициент) вещества, I – сила тока, влияющего на электролит, t – время прохождения электричества).

Второй закон
Этим термином обозначают молярную массу, деленную на целое число, определяющееся реакцией химии, в которой элемент участвует. В другой формулировке закон выглядит так: равное количество электроэнергии ведет к выделению на электродах в течение электролиза эквивалентных масс разных элементов.
Эта константа стала называться числом Фарадея. Самая простая формулировка закона гласит: электрохимический эквивалент каждого элемента прямо пропорционален его молярной массе и обратно пропорционален валентности этого же элемента. Формула:
m = Q/F*A/z
(значения переменных: m – искомая масса полученного вещества, Q – количество полного заряда, прошедшего через электроды, F – число Фарадея, А- молярная масса, z – химическая валентность элемента). Соединяя вместе все значения, описанные в обоих законах, можно вывести общую формулу, определяющую массу собранного на электродах вещества: m = A*I*t/(n*F) (n – заряд иона или количество электронов, участвующих в реакции электролиза).

Производство метанола
Производство метанола основано на реакции взаимодействия угарного газа CO с водородом H2, которая протекает в соответствии с уравнением:
Технологическая цепочка производства метанола практически идентична таковой для получения аммиака. Это обусловлено определенным сходством реакций. Так, например, реакции образования аммиака и метанола являются экзотермическими, обратимыми, каталитическими и протекают с уменьшением объема газообразных веществ.
В синтезе метанола из угарного газа и водорода используются все те же приемы, что и в синтезе аммиака из азот-водородной смеси, в частности:
- наличие катализатора в колонне синтеза;
- принцип теплообмена;
- использование высокого давления для повышения выхода продукта;
- использование высокой температуры для увеличения скорости реакции;
- принцип циркуляции.
процесс
На верхнем изображении показан вольтметр Хоффмана. Цилиндры заполняются водой и выделенными электролитами через среднее сопло. Роль этих электролитов заключается в повышении проводимости воды, потому что в нормальных условиях очень мало ионов H3О+ и ОН- продукты вашего авто ионизации.
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
Электроны перемещаются по всему контуру, пока вы не достигнете другого электрода, где вода выигрывает и становится Н2 и ОН-. На данный момент анод и катод уже определены, которые могут быть дифференцированы по высоте водяных столбов; тот, который имеет меньшую высоту, соответствует катоду, где образуется Н2.
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м3/кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
ссылки
- Wikipedia. (2018). Электролиз воды. Получено с: en.wikipedia.org
- Чаплин М. (16 ноября 2018 г.). Электролиз воды. Структура воды и наука. Получено с: 1.lsbu.ac.uk
- Энергоэффективность и возобновляемая энергия. (Н.Д.). Производство водорода: электролиз. Получено от: energy.gov
- Phys.org. (14 февраля 2018 г.) Высокоэффективный, недорогой катализатор для электролиза воды. Получено с: phys.org
- Химия LibreTexts. (18 июня 2015 г.) Электролиз воды. Получено от: chem.libretexts.org
- Сян С., М. Пападантонакисаб К. и С. Льюис Н. (2016). Принципы и реализации электролизных систем для вододеления. Королевское химическое общество.
- Регенты Университета Миннесоты. (2018). Электролиз воды 2. Университет Миннесоты. Получено из: chem.umn.edu
Электролиз в промышленности
Принцип разделения веществ с помощью электричества не сложен и хорошо изучен, поэтому много где применяется. В результате разложения получаются различные химических вещества (металлы, щелочи, газы) в чистом виде, производится синтез органических частиц и неорганического материала, очистка сточных вод, разряжаются аккумуляторы, защищаются от коррозии и других негативных воздействий поверхности техники, инструментов и предметов быта.
Применение электролиза в технике, благодаря способности катода осаждать на себе молекулы химических элементов, позволяет создавать прочные бесшовные трубы, надежное защитное покрытие для металлических поверхностей, ювелирные украшения, точные слепки со сложных форм.
Добыча металлов
Электролиз расплавов эффективно используется при выделении из руды или солей активных металлов вроде алюминия, калия, бериллия или натрия.
В емкости, где проходит электролиз, катодом является дно, покрытое слоем углерода, а анодом – инертный углеродный стержень. В результате этой реакции продукт электролиза – чистый алюминий – скапливается на дне и сливается через специальные отверстия.
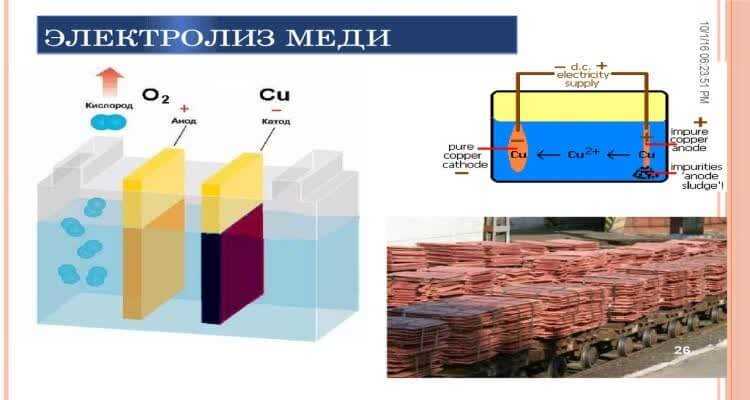
Электрометаллургия
Добыча металлов в электрометаллургии производится двумя видами процессов – электротермическими и электрохимическими. В первом случае выделение из руд и концентратов чистого вещества или образования сплава достигается за счет использования электричества как источника тепловой энергии. Во втором случае производство металла основывается на принципах электрохимического взаимодействия веществ.
Процесс рафинирование – это очистка меди
Чтобы получить очень чистую, рафинированную медь, в качестве электродов используются стержни или пластины из уже очищенного и с примесями металла и электролита – раствора сульфата меди.
Молекулы меди осаждаются на чистом катоде, а примеси выпадают на дно емкости в виде осадка. Таким же способом очищают золото, серебро и другие цветные металлы.
Гальванопластика
С помощью нанесения на исходный предмет равномерного металлического слоя возможно создать неограниченное число его копий. Для этого с оригинала снимается слепок и покрывается слоем электропроводящего вещества. Таким образом делаются слепки со сложных поверхностей, украшения и многого другого.

Гальванополировка
Если он заряжен положительно, то в процессе электролиза быстрее всего теряет выступающие электроны и таким способом становится более гладким, то есть полируется.
Анодирование
Защитное покрытие поверхности металла в этом случае выполняется за счет неметаллических соединений и серной кислоты.
Сфера применения технологии остаточно широка, ее принципы давно использовались даже в домашних условиях
Но очень важно тщательно соблюдать технику безопасности

Гальваническое покрытие
Электролизом можно нанести тонкий равномерный слой металла на поверхность предметов с целью сделать ее менее активной, защитить от негативных влияний, украсить, повысить или понизить электропроводимость.
В зависимости от дальнейшего предназначения гальванизируемого предмета его таким способом покрывают цветными и драгоценными металлами.
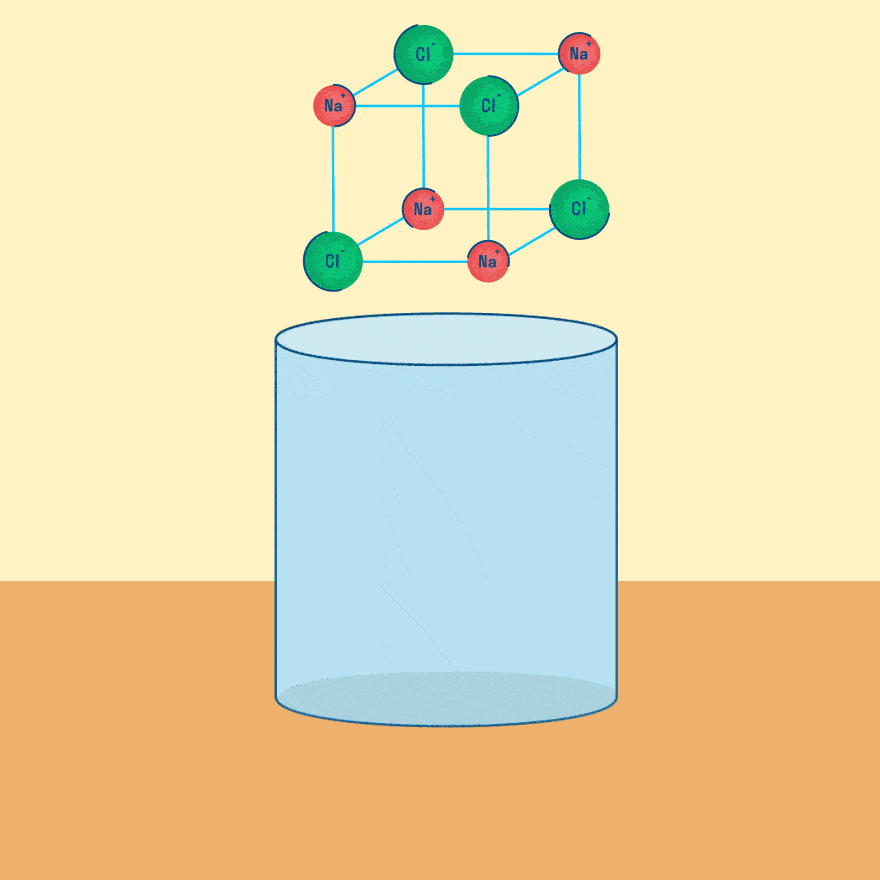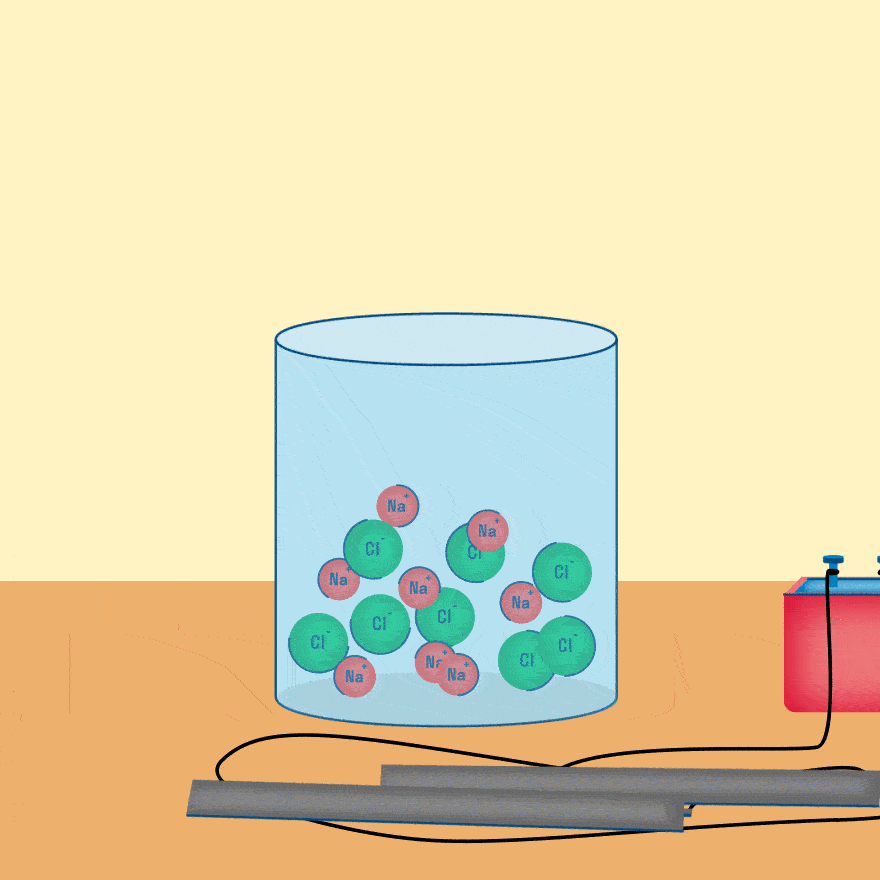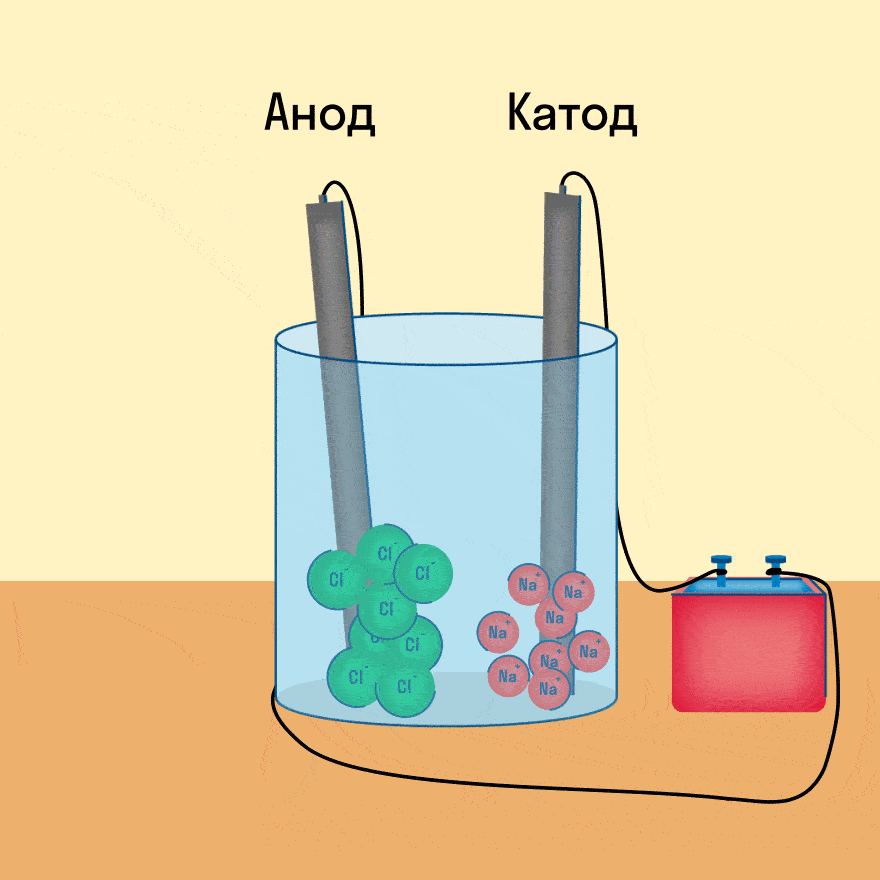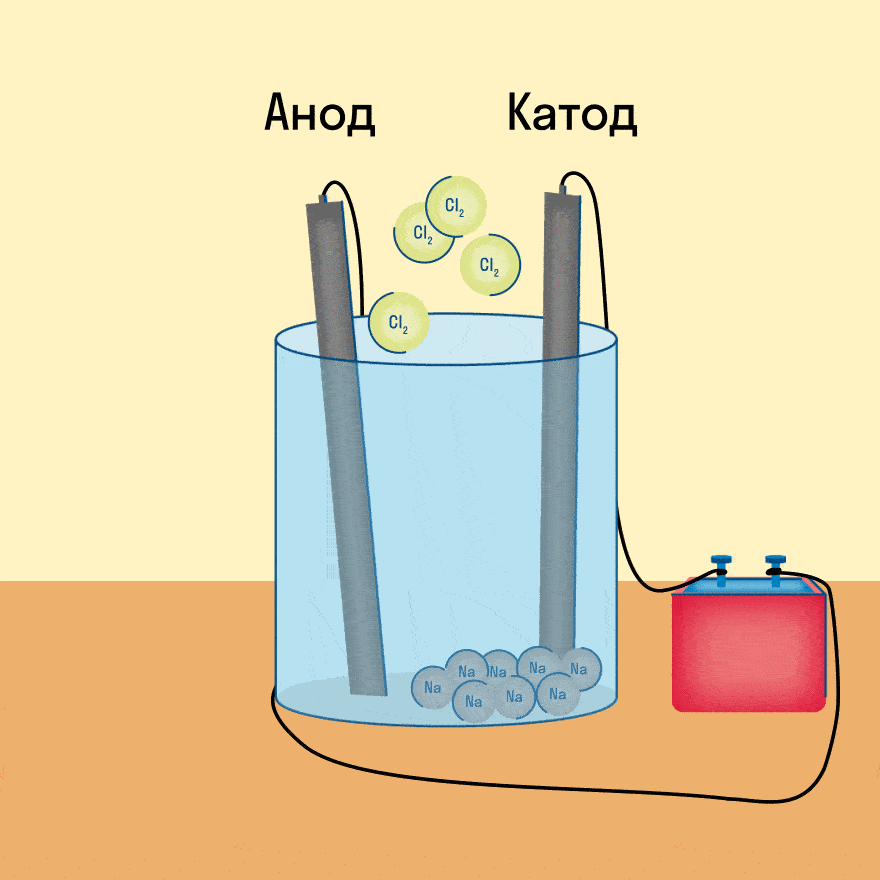
Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na+ + 2e− = 2Na
А+: 2Cl− − 2e− = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
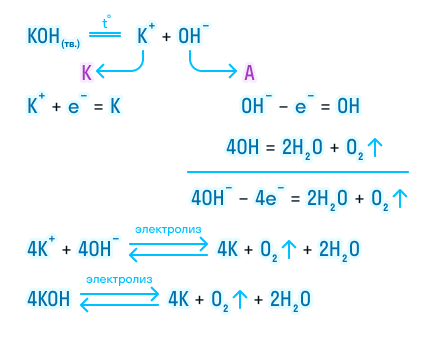
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве – для производства азотсодержащих удобрений;
- в промышленности – для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии – для изготовления азотной кислоты, соды;
- в медицине – в качестве нашатырного спирта.
 Рис. 3. Производство удобрений.
Рис. 3. Производство удобрений.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
-
/5
Вопрос 1 из 5
Какие условия необходимы для получения аммиака промышленным путём?
- Высокая температура, низкое давление, катализатор
- Высокая температура, высокое давление, катализатор
- Низкая температура, высокое давление, катализатор
- Низкая температура, низкое давление, катализатор
методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
4H2O (l) + 4e- => 2H2(г) + 4ОН-(Aq)
4OH-(ac) => O2(г) + 2Н2O (l) + 4e-
Как видно, как на катоде, так и на аноде вода имеет основной pH; и кроме того, ОН- мигрировать на анод, где они окисляются до O2.
Электролиз с полимерной электролитической мембраной
В этой технике используется твердый полимер, который служит проницаемой мембраной для H+, но водонепроницаемый для газов. Это гарантирует большую безопасность при электролизе.
Полуклеточные реакции для этого случая:
4H+(ac) + 4e- => 2H2(G)
2H2O (l) => O2(г) + 4Н+(ac) + 4e-
Ионы Н+ они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Очень отличающийся от других методов, он использует оксиды в качестве электролитов, которые при высоких температурах (600-900ºC) функционируют в качестве среды переноса анионов.2-.
Реакции:
2H2O (г) + 4e- => 2H2(г) +202-
2O2- => O2(г) + 4е-
Обратите внимание, что на этот раз оксидные анионы, или2-, те, кто путешествует на анод
Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
2H2O (l) => 2H2(г) + О2(G)
Как видно из уравнения, вмешиваются две молекулы воды: одну обычно нужно уменьшить или получить электроны, а другую — окислить или потерять электроны..
H2 Это продукт восстановления воды, потому что усиление электронов способствует протонов H+ может быть ковалентно связан, и кислород превращается в ОН-. Поэтому Н2 происходит на катоде, который является электродом, где происходит восстановление.
В то время как O2 происходит от окисления воды, потому что она теряет электроны, которые позволяют ей связываться с водородом, и, следовательно, высвобождает протоны H+. O2 происходит на аноде, электроде, где происходит окисление; и в отличие от другого электрода, pH вокруг анода является кислым, а не основным.
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
2H2O + 2e- => H2 + 2OH- (Катод, основной)
2H2O => O2 + 4H+ + 4e- (Анод, кислота)
Однако вода не может потерять больше электронов (4e-) из которых другая молекула воды побеждает на катоде (2e-); следовательно, первое уравнение должно быть умножено на 2, а затем вычтено со вторым уравнением, чтобы получить чистое уравнение:
2 (2H2O + 2e- => H2 + 2OH-)
2H2O => O2 + 4H+ + 4e-
6H2O => 2H2 + О2 + 4H+ + 4OH-
Но 4Н+ и 4OH- они образуют 4H2Или, таким образом, они устраняют четыре из шести молекул H2Или оставив два; и в результате глобальная реакция только что изложил.
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
Факторы, влияющие на электролиз
Формулы описывают прохождение реакции в идеальной среде, без учета множества сопутствующих факторов, способных изменить ожидаемый результат. Кроме учтенного в законах комплекса составляющих, на суммарное составляющие реакции влияют:
- Состав электролита. На ход реакции и ее результат влияют посторонние примеси, попавшие в электролит. Их разделяют на катионные, анионные и органические. Посторонние молекулы имеют более или менее отрицательный потенциал, чем основное соединение, а это сильно мешает процессу. У концентрации органических загрязнений (это могут быть ПАВ или масла) есть конечное допустимое значение.
- Плотность электричества. Законы Фарадея утверждают, что, чем мощнее сила тока, тем больше количество вещества, которое осядет на электродах. На практике увеличение силы тока часто становится причиной неблагоприятных явлений – интенсивный нагрев электролита, концентрированная поляризация электродов, чрезмерное напряжение тока. Чтобы получить ожидаемый от электролиза результат, следует соблюдать оптимальные для каждой ситуации значения плотности энергии.
- Температура электролита. Ее действие неоднозначно. С одной стороны, с ее увеличением растет интенсивность реакции, с другой – повышается активность посторонних примесей. Поэтому необходимо следить, чтобы температура жидкости находилась в оптимальных пределах для конкретного случая, обычно это 38-45 градусов.
- Кислотно-щелочной баланс электролита. Оптимальное значение pH среды зависит от определенного вещества. Возможно контролировать скорость протекания электролиза и его результат, доводя его до оптимального, если верно сочетать влияние имеющихся факторов. Для каждого вида реакции опытным путем выработаны нужные режимы работы, которых необходимо придерживаться.

Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В апреле 2001 года на холодильной установке в колбасном цехе ОАО «Поиск» в Томске произошел взрыв емкости с аммиаком. В момент взрыва в цехе находились 40 человек, шестеро из них получили ранения.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Какая польза от электролиза воды?
Электролиз воды дает H2 (г) и О2 (G). Приблизительно 5% газообразного водорода, производимого в мире, образуется в результате электролиза воды..
H2 это побочный продукт электролиза водных растворов NaCl. Присутствие соли облегчает электролиз за счет увеличения электропроводности воды.
Глобальная реакция, которая имеет место:
2NaCl + 2H2O => Cl2 + H2 + 2 NaOH,
Чтобы понять огромную важность этой реакции, будут упомянуты некоторые виды использования газообразных продуктов; потому что, в конце концов, именно они стимулируют разработку новых методов для достижения электролиза воды более эффективным и экологичным способом.. Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива.
Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива..
Производство водорода и его использование
-Водород, получаемый при электролизе, может быть использован в химической промышленности, действующей в реакциях зависимости, в процессах гидрирования или в качестве восстановителя в процессах восстановления..
-Кроме того, это важно в некоторых действиях, имеющих коммерческое значение, таких как: производство соляной кислоты, перекиси водорода, гидроксиламинов и т. Д
Участвует в синтезе аммиака по каталитической реакции с азотом.
-В сочетании с кислородом он производит пламя с высокой калорийностью, с температурами в диапазоне от 3000 до 3500 К. Эти температуры могут использоваться для резки и сварных швов в металлургической промышленности, для роста синтетических кристаллов, производства кварца и т. Д..
-Обработка воды: слишком высокое содержание нитратов в воде может быть уменьшено путем их удаления в биореакторах, в которых бактерии используют водород в качестве источника энергии
-Водород вмешивается в синтез пластмасс, полиэстера и нейлона. Кроме того, он является частью производства стекла, увеличивая сгорание во время выпекания.
-Реагирует с оксидами и хлоридом многих металлов, в том числе серебра, меди, свинца, висмута и ртути с образованием чистых металлов.
-И, кроме того, он используется в качестве топлива в хроматографических анализах с детектором пламени..
Как метод отладки
Электролиз растворов хлорида натрия используется для очистки воды бассейна. Во время электролиза водород образуется в катоде и хлоре (Cl2) на аноде. Говорят об электролизе в этом случае как хлоратор соли.
Хлор растворяется в воде с образованием хлорноватистой кислоты и гипохлорита натрия. Хлорноватистую кислоту и гипохлорит натрия стерилизуют водой.
В качестве источника кислорода
Электролиз воды также используется для генерации кислорода на Международной космической станции, которая служит для поддержания кислородной атмосферы на станции..
Водород можно использовать в топливном элементе, способе накопления энергии и использовать воду, которая генерируется в элементе для потребления астронавтами..
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H+ и OH- как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К−: 4H2O + 4e− = 2H2 + 4OH−
А+: 2H2O − 4e− = O2 + 4H+
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

-
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
-
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
-
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
-
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
-
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
-
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
-
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
-
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
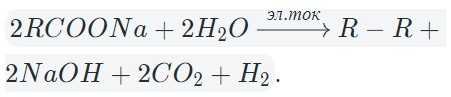
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
[править] Физические свойства
Аммиак — бесцветный газ с характерным резким запахом и едким вкусом. Он почти в два раза легче воздуха. При −33,35 °С и обычном давлении аммиак сжижается в бесцветную жидкость, а при −77,75 °C замерзает, превращаясь в бесцветную кристаллическую массу. Его хранят и транспортируют в жидком состоянии в стальных баллонах под давлением 6-7 атм.
В воде аммиак растворяется очень хорошо: при 0 °С и обычном давлении в 1 объеме воды растворяется около 1200 объемов NH3, а при 20 °С — 700 объемов. Концентрированный раствор содержит 25 % NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом. Обычный медицинский нашатырный спирт содержит до 10 % NH3, аммиачная вода — от 10 % и более. При нагревании раствора аммиак легко испаряется.
Аммиак, жидкость, твердое тело, характеристики:
Жидкий аммиак – бесцветная жидкость, сильно преломляющая свет.
Аммиак как жидкость является хорошим растворителем для очень большого числа органических, а также для многих неорганических соединений. В жидком аммиаке хорошо растворяются щелочные, щелочноземельные металлы, а также другие простые вещества, как, например, фосфор, йод, сера. Слабо растворяются в жидком аммиаке азотнокислые, хлористые и бромистые соли, а соли серной, угольной, уксусной и фосфорной кислот, как правило, нерастворимы.
Чистый жидкий аммиак является диэлектриком, поэтому способен к образованию на стенках сосудов статического электричества.
Сжиженный безводный аммиак относится к трудногорючим веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Твёрдый аммиак внешне представляет собой снегообразную массу из кубических кристаллов правильной формы.