Проверь себя
Задание 1.Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.С каким из следующих простых веществ не реагирует кремний?
- Углерод;
- Бром;
- Фосфор;
- Кислород.
Задание 3.С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.
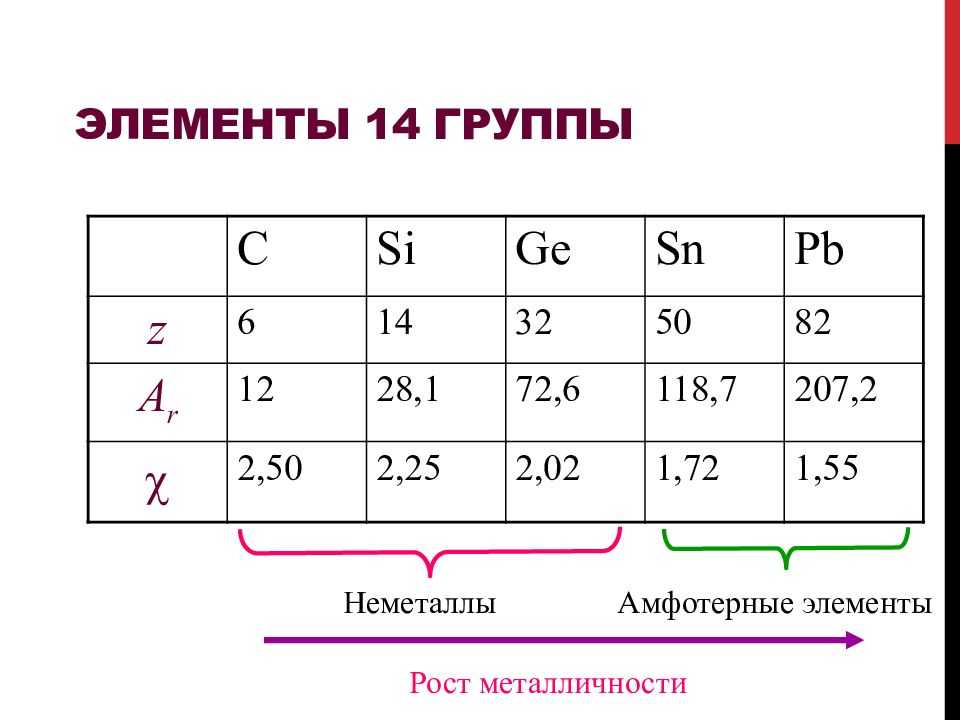
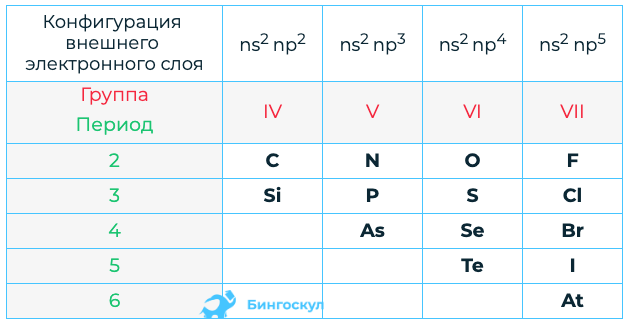
Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Определение
К неметаллам (нМ) относятся те элементы Периодической системы, которые характеризуются способностью захватывать электроны до заполнения наружного энергетического слоя.
НМ (кроме H2) в менделеевской таблице находятся в правом верхнем углу системы, в главных подгруппах. При этом образуется как бы треугольник с вершиной, занимаемой фтором, и диагональю от кремния до астата.
Характерные особенности неметаллов
- Малый радиус атомов нМ относительно атомов металлов.
- Наличие большого числа электронов (от 4-х до 8-и) на последнем наружном энергоуровне. Их количество там растёт с возрастанием заряда атомного ядра.
- Значительный показатель электроотрицательности. Он меняется от двух до четырёх. С перемещением в таблице вверх и вправо у атомов увеличивается стремление к захвату электронов у других элементов. В основном атомы неметаллов по строению внешней электронной оболочки являются p – элементами.
- В реакциях нМ проявляют свойства окислителей. Самые сильные из них F, O2, Cl. У Si, C, P, As, Te преобладают окисляющие свойства. N, S, I в равной степени показывают и окисляющие и восстанавливающие качества.
- В нормальных условиях (н.у.) неметаллы являются газами (O2, N, Cl, F), жидкостями (Br) и могут быть в твердом состоянии (S, P, I).
- Окраска нМ разнообразна: у S — жёлтая, у Br – тёмно-бурая, у фосфорных модификаций может быть белая или красная. O2 и N – бесцветны.
- Естественно, неметаллы не проявляют металлических свойств: ковкость, пластичность, электропроводность.
Химические свойства кремния
У кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:

- Реакции с неметаллами

| Кремний не реагирует с водородом и фосфором в силу близких значений электроотрицательностей! |
- Реакция со щелочами
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:

- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
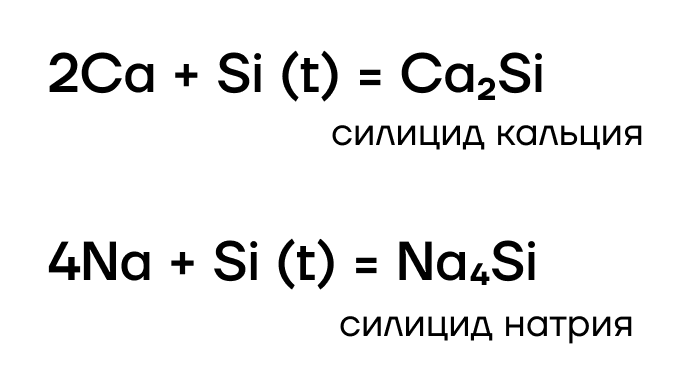
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:

Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):

(оксид кремния(IV) входит в состав песка, который мы видим на улице)
Получение кремния
Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
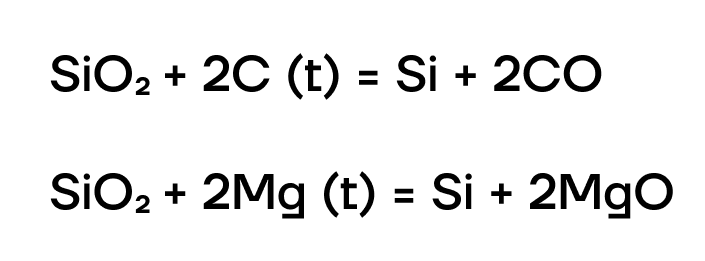
Характеристика неметаллов группы VIIА (галогенов):
Свойства фтора (F): располагается: 2-й период, главная подгруппа VII группы. Порядковый номер 9; обладает 2-мя энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I; С.О. -1, 0; кроме Ar, He и Ne действует на все элементы.
Свойства хлора (Cl): месторасположение: 3-й период, главная подгруппа VII группы. Порядковый номер 17; обладает 3-мя энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; действует на все металлы (на некоторые при нагреве и во влажной среде). Реагирует со многими неметаллами в обычных условиях, кроме N, C, O2 и благородных газов
С водородом образует очень важное вещество – хлористый водород HCl. Свойства брома (Br): располагается: 4-й период, главная подгруппа VII группы
Порядковый номер 35; обладает 4-мя энергоуровнями с 7- ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; реагирует с неметаллами при н.у., кроме N, C, O2 и благородных газов. Взаимодействует с большинством металлов, а также со щелочами.
Свойства иода (I): располагается: 5-й период, главная подгруппа VII группы. Порядковый номер 53; обладает 5-ю энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; образует иодиды с металлами с выделением тепловой энергии (HgI2), при нагреве с водородом получают сильный восстановитель – иодистый водород. С водой взаимодействует слабо.
Свойства астата (At): располагается: 6-й период, главная подгруппа VII группы. Порядковый номер 85; обладает 6-ю энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, V; С.О. -1, 0, +1, +5; является радиоактивным элементом, по свойствам астат схож с йодом.
§ 41. Элементы IVA-группы. Углерод и кремний
Углерод и кремний как химические элементы
Углерод 6С и кремний 14Si являются химическими элементами IVА-группы периодической системы, относятся к неметаллам. Кроме них группа включает также германий 32Ge, олово 50Sn, свинец 82Pb и флеровий 114Fl.
На внешнем электронном слое атомы содержат по 4 электрона, общая электронная конфигурация которого ns2np2:
6C 14Si 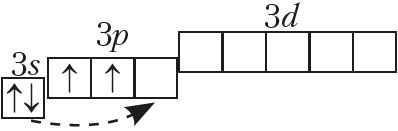 32Ge
32Ge 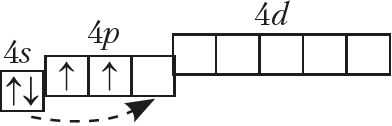
Присоединяя электроны, атомы углерода и кремния проявляют отрицательную степень окисления ‒4, при потере электронов — +2 и +4.
При образовании химических связей атомов углерода с атомами других элементов полной отдачи или полного присоединения четырёх электронов не происходит, то есть формируются преимущественно ковалентные связи.
В отличие от других элементов IVА-группы число валентных электронов углерода равно числу валентных орбиталей. Это одна из причин большой устойчивости связи C—C и склонности атомов углерода соединяться друг с другом в цепи:
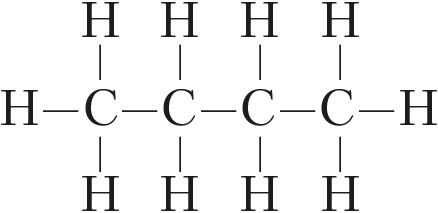 ,
,
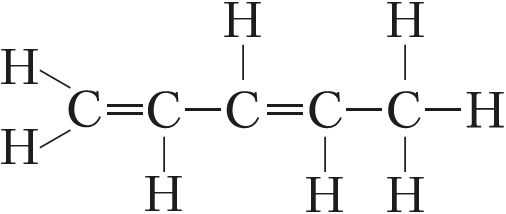 и др.
и др.
Распространённость в природе. Кремний — второй по распространённости на Земле элемент. Углерод, по большинству оценок, занимает 16-е место. Сведения о природных соединениях представлены в таблице 30.
Таблица 30. Химические элементы углерод и кремний
| Элемент | Радиус атома, нм | χ | Степени окисления | Природные соединения |
| Углерод 6С | 0,077 | 2,5 | –4, 0, +2, +4 | Простые вещества — алмаз, графит. Мел, мрамор, известняк, ракушечник, жемчуг, кальцит (СаСО3); углекислый газ, природный газ, нефть, органические вещества |
| Kремний 14Si | 0,117 | 1,9 | ‒4, 0, +2, +4 | Кремнезём, кварц, горный хрусталь (основной компонент SiО2); силикаты металлов |
Углерод и кремний как простые вещества. Углерод как простое вещество существует в виде нескольких аллотропных модификаций, важнейшие из которых — алмаз, графит, фуллерены. Кремний аллотропных модификаций не образует, существует в виде одного простого вещества с алмазоподобной структурой.
Кристаллические решётки аллотропных модификаций углерода приведены на . Из материала § 16 вы уже знаете, почему алмаз — самое твёрдое вещество, почему графит электропроводен и легко расслаивается. Вам также известно, что фуллерены состоят из сферических молекул С60, С80 ().

Графен — аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом.
Материал, обладающий уникальными свойствами — высокой проводимостью и прочностью, гидрофобностью, особыми оптическими свойствами, — вызвал интерес не только учёных, но и технологов, связанных с производством процессоров.
Имеют большое значение и находят широкое применение аморфные формы углерода — древесный уголь, активированный уголь, сажа.
Кремний, в отличие от алмаза, является полупроводником, что позволяет его широко использовать в современных микросхемах. Его применяют также в производстве жаропрочных сталей.
Итак, особенности строения веществ определяют их свойства, а значит, и области использования.
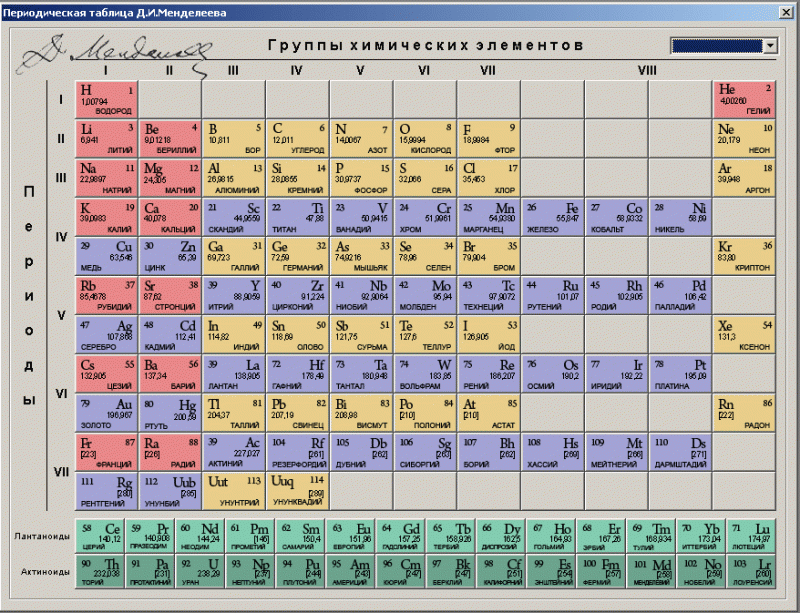
Периодическая система элементов Менделеева – ТАБЛИЦА МЕНДЕЛЕЕВА
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А – главные (s- и р-элементы) и В – побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период – 2 элемента (1s2)2 период – 8 элементов (2s22p6)3 период – 8 элементов (3s23p6)4 период – 18 элементов (4s23d104p6)5 период – 18 элементов (5s24d105p6)6 период – 32 элемента (6s24f145d106p6)7 период – 32 элемента (6s24f145d106p6)8 период – не завершен |
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956Скандий | 47,88Титан | 50,942Ванадий | 51,996Хром | 54,938Марганец | 55,847Железо | 58,9332Кобальт | 58,69Никель |
| 63,546Медь | 65,39Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906Иттрий | 91,224Цирконий | 92,906Ниобий | 95,94Молибден | 98,906Технеций | 101,07 Рутений | 102,905Родий | 106,42Палладий |
| 107,868Серебро | 112,41Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49Гафний | 180,948Тантал | 183,85Вольфрам | 186,207Рений | 190,2Осмий | 192,22Иридий | 195,09Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | Полоний | Астат | Радон | |||
| 7 | Франций | 226,025 Радий | Актиний | Резерфордий | Дубний | Сиборгий | Борий | Хассий | Мейтнерий | Дармштадтий |
| Рентгений | Коперниций | Унутрий | Флеровий | Унунпентий | Ливерморий | Унунсептий | Унуноктий | |||
| 8 | Унуненний | Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH |
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | Плутоний | Америций | Кюрий | Берклий | Калифорний | Эйнштейний |
| Фермий | Менделевий | Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий |
| s – элементы | p – элементы | d – элементы | f – элементы |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s – элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d – элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f – элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Группа периодической системы

TR | UK | KK | BE | EN | группа периодической системы управления, группа периодической системы орошенияГруппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы.
Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп).
Элементы одной подгруппы обладают сходными химическими свойствами.
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Нумерация групп
С 1989 года Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного варианта периодической системы утверждена длиннопериодная форма. В связи с этим IUPAC рекомендует сплошную нумерацию групп: арабскими цифрами от 1 до 18.
Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием римских цифр и латинских букв, отличающиеся для Америки и Европы.
Современная система нумерации содержит следующие группы (старые системы, европейская и американская, приведены в скобках):
- Группа 1 (IA, IA): щелочные металлы
- Группа 2 (IIA, IIA): щёлочноземельные металлы
- Группа 3 (IIIB, IIIA): подгруппа скандия
- Группа 4 (IVB, IVA): подгруппа титана
- Группа 5 (VB, VA): подгруппа ванадия
- Группа 6 (VIB, VIA): подгруппа хрома
- Группа 7 (VIIB, VIIA): подгруппа марганца
- Группа 8 (VIIIВ, VIIIA): подгруппа железа
- Группа 9 (VIIIВ, VIIIA): подгруппа кобальта
- Группа 10 (VIIIВ, VIIIA): подгруппа никеля
- Группа 11 (IB, IB): подгруппа меди
- Группа 12 (IIB, IIB): подгруппа цинка
- Группа 13 (IIIA, IIIB): подгруппа бора
- Группа 14 (IVA, IVB): подгруппа углерода
- Группа 15 (VA, VB): подгруппа азота
- Группа 16 (VIA, VIB): подгруппа кислорода (халькогены)
- Группа 17 (VIIA, VIIB): галогены
- Группа 18 (VIIIA, VIIIB): инертные газы
Примечания
- ↑ Сайфуллин Р.С., Сайфуллин А.Р. Новая таблица Менделеева // Химия и жизнь.— 2003.— № 12.— С. 14—17.
- ↑ Подгруппа гелия (инертные газы) иногда, особенно в старых изданиях, обозначается цифрой 0.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
|
группа периодической системы орошения, группа периодической системы отопления, группа периодической системы очистки, группа периодической системы управления
Группа периодической системы Информацию О
Группа периодической системы
Группа периодической системыГруппа периодической системы Вы просматриваете субъектГруппа периодической системы что, Группа периодической системы кто, Группа периодической системы описание
There are excerpts from wikipedia on this article and video
Поисковая система, разработанная для вас, доставляет вам самую актуальную и точную информацию с простым дизайном и системой быстрого функционирования. Вы можете найти почти любую информацию, которую вы ищете на нашем сайте.
На данный момент мы служим только на английском, турецком, русском, украинском, казахском и белорусском языках. Очень скоро в систему будут добавлены новые языки.
Жизнь известных людей дает вам информацию, изображения и видео о сотнях тем, таких как политики, правительственные деятели, врачи, интернет-сайты, растения, технологические транспортные средства, автомобили и т. д.
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s23p2.

В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns1np3.
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:

У кремния возможны следующие степени окисления: -4, +2, +4.
Заключение
Из 118 известных хим. элементов неметаллических всего 14, но каких! Из них O2 и Si составляют 76% всей твёрдой оболочки планеты. 98,5% массового объёма растений – неметаллы. Почти столько же их в массе человеческого тела. Воздух состоит из N, O2, CO2. Углерод (С), кислород (O), азот (N), сера (S), фосфор (P) являются органогенами. Они образуют основу жизни на Земле – живую клетку с белками, жирами, углеводами, нуклеиновыми кислотами.
Смотри также:
- Закономерности изменения свойств элементов и их соединений по периодам и группам
- Общая характеристика металлов IА–IIIА групп
- Характеристика переходных элементов (меди, цинка, хрома, железа)


















![Простые и комплексные соединения [1972 семишин в.и. - периодическая система химических элементов д. и. менделеева]](http://mediaex.ru/wp-content/uploads/f/1/4/f148a79cace2f95a0539469b83fec5f7.jpeg)