Презентация на тему: » Общая характеристика элементов IV группы главной подгруппы.» — Транскрипт:
1
Общая характеристика элементов IV группы главной подгруппы

2
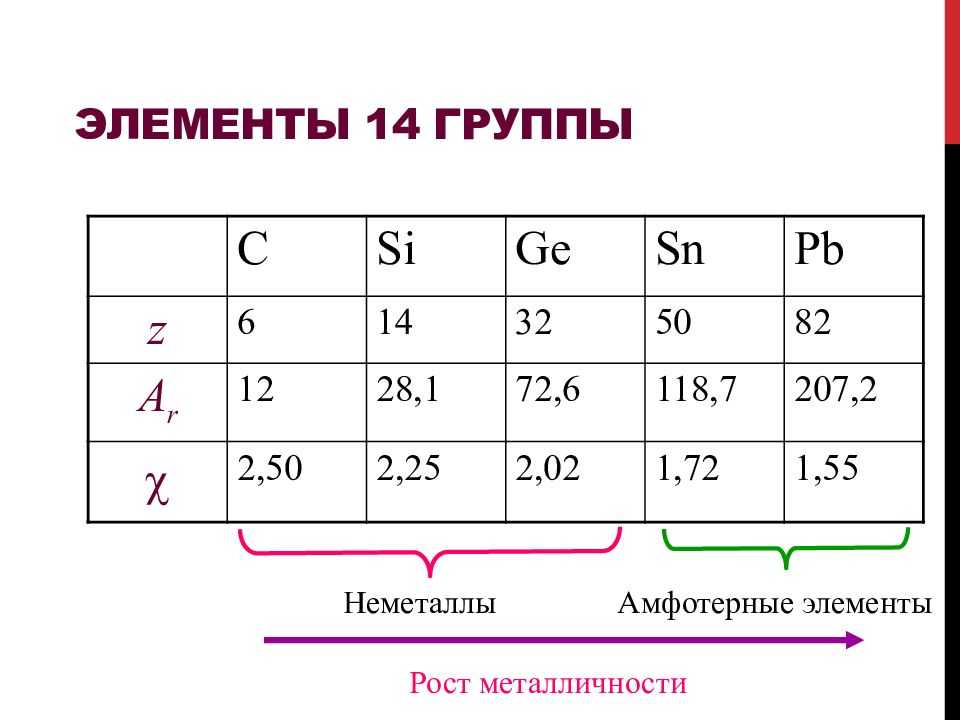
Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) элементы 4 группы главной подгруппы ПСЭ. На внешнем электронном слое атомы этих элементов имеют 4 электрона: ns 2 np 2. В подгруппе с ростом порядкового номера элемента увеличивается атомный радиус, неметаллические свойства ослабевают, а металлические усиливаются: углерод и кремний – неметаллы; германий, олово, свинец амфотерные металлы. Элементы этой подгруппы проявляют как положительную, так и отрицательную степени окисления: -4, 0, +2, +4.

3
Высшие оксиды углерода и кремния (С0 2, Si0 2 ) обладают кислотными свойствами, оксиды остальных элементов подгруппы — амфотерны (Ge0 2, Sn0 2, Pb0 2 ). Угольная и кремниевая кислоты (Н 2 СО 3, H 2 SiO 3 ) слабые кислоты. Гидроксиды германия, олова и свинца амфотерны, проявляют слабые кислотные и основные свойства: H 2 GeO 3 = Ge(OH) 4, H 2 SnO 3 = Sn(ОН) 4, Н 2 РЬО 3 = Pb(OH) 4. Водородные соединения: СН 4 ; SiH 4, GeH 4. SnH 4, PbH 4. Метан CH 4 прочное соединение, силан SiH 4 — менее прочное соединение, остальные же неустойчивые

4
Углерод Нахождение в природе Среди множества химических элементов, без которых невозможно существование жизни на Земле, углерод является главным. Более 99% углерода в атмосфере содержится в виде углекислого газа. Элементарный углерод присутствует в атмосфере в малых количествах в виде графита и алмаза, а в почве — в форме древесного угля.

5
Аллотропные видоизменения углерода. Углерод существует в трех аллотропных модификациях: алмаз, графит и карбин.

6
Графит. Мягкий графит имеет слоистое строение. Непрозрачен, серого цвета с металлическим блеском. Довольно хорошо проводит электрический ток, благодаря наличию подвижных электронов. Скользок на ощупь. Один из самых мягких среди твердых веществ.
7
Алмаз. Алмаз — самое твердое природное вещество. Кристаллы алмазов высоко ценятся и как технический материал, и как драгоценное украшение. Хорошо отшлифованный алмаз — бриллиант. Преломляя лучи света, он сверкает чистыми, яркими цветами радуги. Самый крупный из когда-либо найденных алмазов весит 602 г, имеет длину 11 см, ширину 5 см, высоту 6 см. Этот алмаз был найден в 1905 г и носит имя «Кэллиан». Рис. Модель решетки алмаза.

8
Аморфный углерод Сорта: 1. Сажа – используется для изготовления типографской краски, картриджей, резины, косметической туши и т. д. 2. Кокс – в доменных печах при выплавке чугуна. 3. Древесный уголь – в качестве топлива, при выплавке цветных металлов, очистки от примесей.

9
Химические свойства углерода 1)+ O 2 2)+ H 2 3)+ Me 4)+ основные оксиды

10
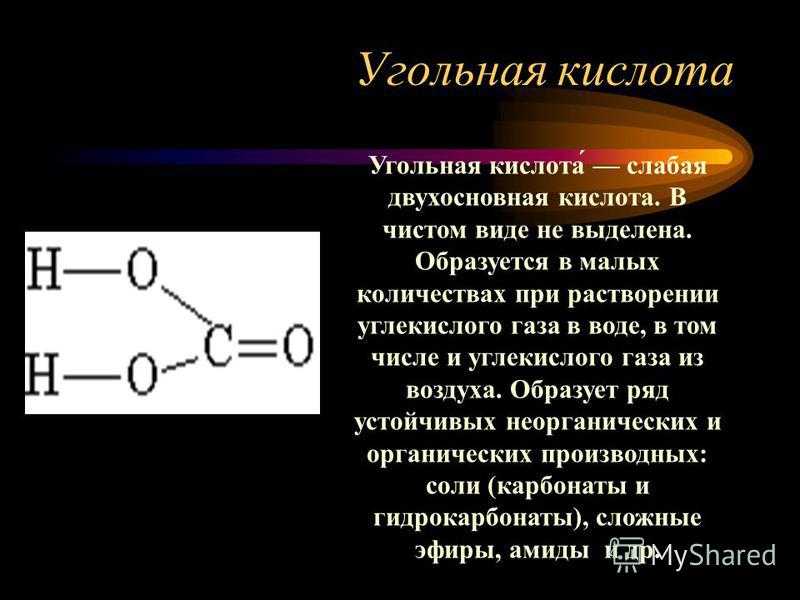
Угольная кислота Угольная кислота́ слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.

12
Кремний Кремний – неметалл, существует в кристаллическом и аморфном состоянии. Кристаллический кремний – вещество серовато – стального цвета с металлическим блеском, весьма твердое, но хрупкое. Аморфный кремний – бурый порошок.


14
Химические свойства Химически кремний малоактивен. При комнатной температуре реагирует только c фтором, образуя летучий тетрафторид кремния: Si + 2F 2 SiF 4 Si + 2F 2 SiF 4 Si + Cl 2 Si + Cl 2 Si + Br 2 Si + Br 2

15
При нагревании до 400 – С кремний реагирует с кислородом с образованием диоксида кремния: Si + O 2 Si + O 2

16
При взаимодействии с металлом, кремний проявляет себя как окислитель. При взаимодействии образуются: силициды. 2Са + Si Ca 2 Si

17
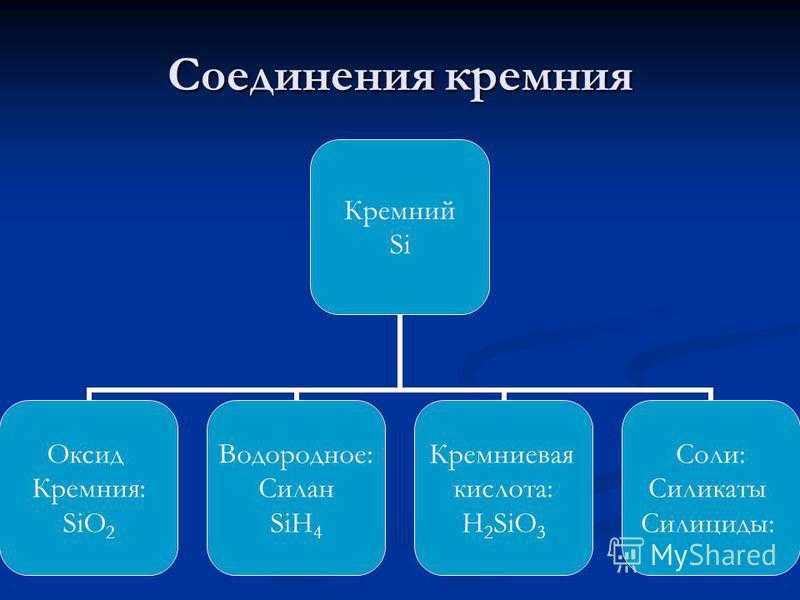
Соединения кремния Кремний Si Оксид Кремния: SiO2 Водородное: Силан SiH4 Кремниевая кислота: H2SiO3 Соли: Силикаты Силициды:
18
Оксид кремния (IV) Кристаллы белого цвета, t пл °C, обладают высокой твёрдостью и прочностью твёрдостьюпрочностьютвёрдостьюпрочностью

19
Кремниевая кислота Двухосновная, кислород содержащая, слабая (слабее угольной кислоты)нерастворимая в воде.

20
Соли кремниевой кислоты Силикаты Силикаты Растворимыми являются только соли щелочных металлов, остальные образуют нерастворимые или вообще не образуют солей(Al +3, Cr +3, Ag + ). Растворимыми являются только соли щелочных металлов, остальные образуют нерастворимые или вообще не образуют солей(Al +3, Cr +3, Ag + ).

2.3 Структура периодической системы: периоды, группы, подгруппы
Взаимодействие тетраалкинилидов олова с хлорангидридами карбоновых кислот
Комплексные соединения палладия хорошо катализируют ацилирование IIIA группы металлов. Исследования реакции показали способность хлорангидридов карбоновых кислот к ацилированию R3A1 и R2RAl реагентов в присутствии палладиевых катализаторов…
Строение атома водорода в периодической системе
Первый элемент периодической системы (1-й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе, поэтому в таблицах условно помещается в IА группу и/или VIIA-группу…
Воздействие окружающей среды на металлы
I. Строение атомов металлов. Положение металлов в периодической системе. Группы металлов
В настоящее время известно 105 химических элементов, большинство из них – металлы. Последние весьма распространены в природе и встречаются в виде различных соединений в недрах земли, водах рек, озер, морей, океанов, составе тел животных…
Качественное обнаружение вольфрама
Положение в периодической системе химических элементов
Вольфрам – элемент VI группы периодической системы химических элементов, его порядковый номер 74, атомная масса 183,85. Природный вольфрам состоит из смеси стабильных изотопов с массами: 180 (0,16%) 182 (26,35%) 183 (14,32%) 184 (30,68%) 186 (28…
Классы неорганических веществ. Растворы электролитов. Размеры атомов и водородная связь
f2. Местоположение в периодической системе
Элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum)…
Периодическая система элементов и история ее создания
Описание периодической системы
В таблице помещены символы элементов, принятые в 1961 г. Международным съездом Союза чистой и прикладной химии. Для ряда элементов в литературе употребляются различные названия; например, 86-й элемент наз. радоном (Rn), или эманацией (Еm )…
Получение фосфорнокислого цинка
1.1.2 Положение цинка в периодической системе Д.И. Менделеева
Цинк – элемент побочной подгруппы второй группы, четвертого периода периодической системы химических элементов Д.И. Менделеев, с атомным номером 30. Атомная масса 65,39. Конфигурация внешних электронных оболочек атома 3d10 4s2. Степень окисления +2…
Применение органических реагентов в аналитической химии
4.2 Индикаторы группы азосоединений
Индикаторы группы азосоединений (азоиндикаторы) – это многочисленная группа индикаторов, являющихся производными пара-аминобензола и пара-диметиламинобензола, которые сами по себе практически не растворимы в воде…
fРтуть – элемент таблицы периодической системы химических элементов Д. И. Менделеева
80 Ртуть Hg 200,59 4f145d106s2 Ртуть — элемент побочной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum) …
Общая характеристика элементов подгруппы азота
Азот фосфор Мышьяк Сурьма Висмут Строение внешнего электронного слоя 2sІ2pі 3sІ3pі 4sІ4pі 5sІ5pі 6sІ6pі Энергия ионизации атома, эВ 14,53 10,484 9,81 8,636 7,287 Относительная электроотрицательность 3,07 2,2 2,1 1,8 1,7 Радиус атома, нм 0…
2.1. Характеристика кобальта по положению в периодической системе. Электронная формула
Со, химический элемент с атомным номером 27. Его атомная масса 58,9332. Природный кобальт состоит из двух стабильных нуклидов: 59Со (99,83% по массе) и 57Со (0,17%). В периодической системе элементов Д. И…
Характеристика элементов подгруппы азота
f1. Характеристика элементов подгруппы азота
Азот – важнейшая составная часть атмосферы (78% ее объема). В природе встречается в белках, в залежах нитрата натрия. Природный азот состоит из двух изотопов: 14N (99,635% массы) и 15N (0,365% массы). Фосфор входит в состав всех живых организмов…
1.1 Элементы первой группы периодической системы
Элементы первой группы периодической системы характеризуются прежде всего одинаковым строением внешнего электронного слоя атомов, в котором у всех членов группы содержится только один электрон…
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Группа периодической системы
TR | UK | KK | BE | EN | группа периодической системы управления, группа периодической системы орошенияГруппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы.
Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп).
Элементы одной подгруппы обладают сходными химическими свойствами.
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Нумерация групп
С 1989 года Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного варианта периодической системы утверждена длиннопериодная форма. В связи с этим IUPAC рекомендует сплошную нумерацию групп: арабскими цифрами от 1 до 18.
Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием римских цифр и латинских букв, отличающиеся для Америки и Европы.
Современная система нумерации содержит следующие группы (старые системы, европейская и американская, приведены в скобках):
- Группа 1 (IA, IA): щелочные металлы
- Группа 2 (IIA, IIA): щёлочноземельные металлы
- Группа 3 (IIIB, IIIA): подгруппа скандия
- Группа 4 (IVB, IVA): подгруппа титана
- Группа 5 (VB, VA): подгруппа ванадия
- Группа 6 (VIB, VIA): подгруппа хрома
- Группа 7 (VIIB, VIIA): подгруппа марганца
- Группа 8 (VIIIВ, VIIIA): подгруппа железа
- Группа 9 (VIIIВ, VIIIA): подгруппа кобальта
- Группа 10 (VIIIВ, VIIIA): подгруппа никеля
- Группа 11 (IB, IB): подгруппа меди
- Группа 12 (IIB, IIB): подгруппа цинка
- Группа 13 (IIIA, IIIB): подгруппа бора
- Группа 14 (IVA, IVB): подгруппа углерода
- Группа 15 (VA, VB): подгруппа азота
- Группа 16 (VIA, VIB): подгруппа кислорода (халькогены)
- Группа 17 (VIIA, VIIB): галогены
- Группа 18 (VIIIA, VIIIB): инертные газы
Примечания
- ↑ Сайфуллин Р.С., Сайфуллин А.Р. Новая таблица Менделеева // Химия и жизнь.— 2003.— № 12.— С. 14—17.
- ↑ Подгруппа гелия (инертные газы) иногда, особенно в старых изданиях, обозначается цифрой 0.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
|
группа периодической системы орошения, группа периодической системы отопления, группа периодической системы очистки, группа периодической системы управления
Группа периодической системы Информацию О
Группа периодической системы
Группа периодической системыГруппа периодической системы Вы просматриваете субъектГруппа периодической системы что, Группа периодической системы кто, Группа периодической системы описание
There are excerpts from wikipedia on this article and video
Поисковая система, разработанная для вас, доставляет вам самую актуальную и точную информацию с простым дизайном и системой быстрого функционирования. Вы можете найти почти любую информацию, которую вы ищете на нашем сайте.
На данный момент мы служим только на английском, турецком, русском, украинском, казахском и белорусском языках. Очень скоро в систему будут добавлены новые языки.
Жизнь известных людей дает вам информацию, изображения и видео о сотнях тем, таких как политики, правительственные деятели, врачи, интернет-сайты, растения, технологические транспортные средства, автомобили и т. д.
Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Определение
К неметаллам (нМ) относятся те элементы Периодической системы, которые характеризуются способностью захватывать электроны до заполнения наружного энергетического слоя.
НМ (кроме H2) в менделеевской таблице находятся в правом верхнем углу системы, в главных подгруппах. При этом образуется как бы треугольник с вершиной, занимаемой фтором, и диагональю от кремния до астата.
Характерные особенности неметаллов
- Малый радиус атомов нМ относительно атомов металлов.
- Наличие большого числа электронов (от 4-х до 8-и) на последнем наружном энергоуровне. Их количество там растёт с возрастанием заряда атомного ядра.
- Значительный показатель электроотрицательности. Он меняется от двух до четырёх. С перемещением в таблице вверх и вправо у атомов увеличивается стремление к захвату электронов у других элементов. В основном атомы неметаллов по строению внешней электронной оболочки являются p – элементами.
- В реакциях нМ проявляют свойства окислителей. Самые сильные из них F, O2, Cl. У Si, C, P, As, Te преобладают окисляющие свойства. N, S, I в равной степени показывают и окисляющие и восстанавливающие качества.
- В нормальных условиях (н.у.) неметаллы являются газами (O2, N, Cl, F), жидкостями (Br) и могут быть в твердом состоянии (S, P, I).
- Окраска нМ разнообразна: у S — жёлтая, у Br – тёмно-бурая, у фосфорных модификаций может быть белая или красная. O2 и N – бесцветны.
- Естественно, неметаллы не проявляют металлических свойств: ковкость, пластичность, электропроводность.
Характеристика неметаллов группы VIIА (галогенов):
Свойства фтора (F): располагается: 2-й период, главная подгруппа VII группы. Порядковый номер 9; обладает 2-мя энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I; С.О. -1, 0; кроме Ar, He и Ne действует на все элементы.
Свойства хлора (Cl): месторасположение: 3-й период, главная подгруппа VII группы. Порядковый номер 17; обладает 3-мя энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; действует на все металлы (на некоторые при нагреве и во влажной среде). Реагирует со многими неметаллами в обычных условиях, кроме N, C, O2 и благородных газов
С водородом образует очень важное вещество – хлористый водород HCl. Свойства брома (Br): располагается: 4-й период, главная подгруппа VII группы
Порядковый номер 35; обладает 4-мя энергоуровнями с 7- ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; реагирует с неметаллами при н.у., кроме N, C, O2 и благородных газов. Взаимодействует с большинством металлов, а также со щелочами.
Свойства иода (I): располагается: 5-й период, главная подгруппа VII группы. Порядковый номер 53; обладает 5-ю энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, III, V, VII; С.О. -1, 0, +1, +3, +5, +7; образует иодиды с металлами с выделением тепловой энергии (HgI2), при нагреве с водородом получают сильный восстановитель – иодистый водород. С водой взаимодействует слабо.
Свойства астата (At): располагается: 6-й период, главная подгруппа VII группы. Порядковый номер 85; обладает 6-ю энергетическими уровнями с 7-ю электронами на верхней орбите; возможна валентность I, V; С.О. -1, 0, +1, +5; является радиоактивным элементом, по свойствам астат схож с йодом.
Заключение
Из 118 известных хим. элементов неметаллических всего 14, но каких! Из них O2 и Si составляют 76% всей твёрдой оболочки планеты. 98,5% массового объёма растений – неметаллы. Почти столько же их в массе человеческого тела. Воздух состоит из N, O2, CO2. Углерод (С), кислород (O), азот (N), сера (S), фосфор (P) являются органогенами. Они образуют основу жизни на Земле – живую клетку с белками, жирами, углеводами, нуклеиновыми кислотами.
Смотри также:
- Закономерности изменения свойств элементов и их соединений по периодам и группам
- Общая характеристика металлов IА–IIIА групп
- Характеристика переходных элементов (меди, цинка, хрома, железа)