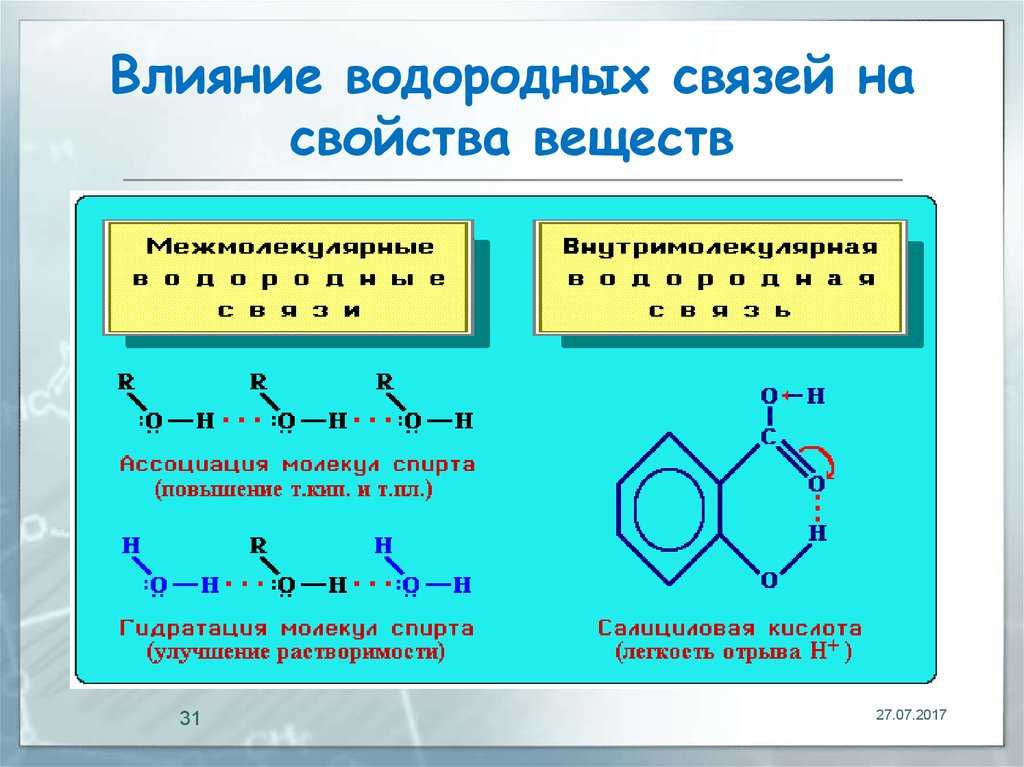
Строение атома
Сегодня мы будем путешествовать в микромир – мир атома. Даже если превратить нас в песчинку, то по сравнению с размером ядра атомов химических элементов, мы будем гигантами.
Атом нельзя увидеть, невозможно потрогать, он на столько мал, что существует только в нашем воображении. До XIX века учёные оперировали только одной характеристикой атома – это его масса. Наука не оперировала понятиями, что ядро атома содержит более мелкие частицы. Почему элементы отличаются массой. Атом долгое время считали «неделимым». Но отличия в массе подвигли искать причину в строении.
Как описать строение, то чего невозможно увидеть, а можно только представить. Ведь современные электронные микроскопы появились только в XX веке.
Атом – как мельчайшая частица, известна ещё с древних времён. Древнегреческий философ Демокрит считал, что свойства веществ определяются определённым типом атома. Даже тонкая материя, душа, по его мнению, состоит из атомов. Так тела бывают в разных агрегатных состояниях, поэтому атомы металлов будут с зубцами, жидкости будут обладать гладкими, это будет причиной их текучести.
Долгое время атом считали неделимым. Заглянув в словарь синонимов, можно увидеть пару синонимов для слова атом, неделимый, мельчайшая частица. Теория о неделимости существовала до XIX века, пока экспериментально не подтвердили, что ядро атома состоит из более мелких частиц. Но как они располагаются в атоме, как конфеты драже в кармашке, или по версии Томсона, который сравнивал электроны с изюминками, хаотично разбросанных в кексе. Учёный с Японии Хантаро Нагаока сравнил атом с загадочной планетой Сатурн, которая известна своим кольцом. Саму планету он сравнил с массивным ядром, а роль кольца отдал электронам.
В конце XIX века, начале XX происходит стремительное развитие науки, открываются новые частицы α и β. Позже было установлено, что это ядро атома элемента Не и электроны.
Английский физик Резерфорд сравнил атом с Солнечной системой. Солнце – это очень большая звезда, которая находится в центре. Масса Солнца занимает 99,86 % от массы всей Солнечной системы. Подобно планетам, электроны вращаются вокруг ядра, каждый из них занимает своё положение — орбиталь. Т.е. электроны – это оболочка атома.

В ходе данных исследований было доказано, что атом представляет совокупность заряженных и нейтральных частичек.
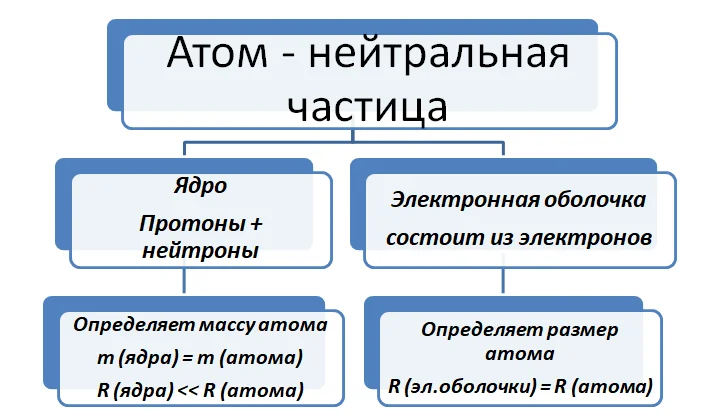
Анализируя размеры, важно запомнить, что радиус ядра атома, будет всегда значительно меньше радиуса всего атома. Этот факт объясняется тем, что частицы составляющие ядро более компактно упакованы, чем электроны
Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
«Строение электронных оболочек атомов»
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Если N — максимальное число электронов на электронном слое с номером n, то для определения числа N можно воспользоваться формулой N = 2n2.
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
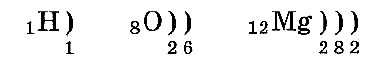
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)

Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.
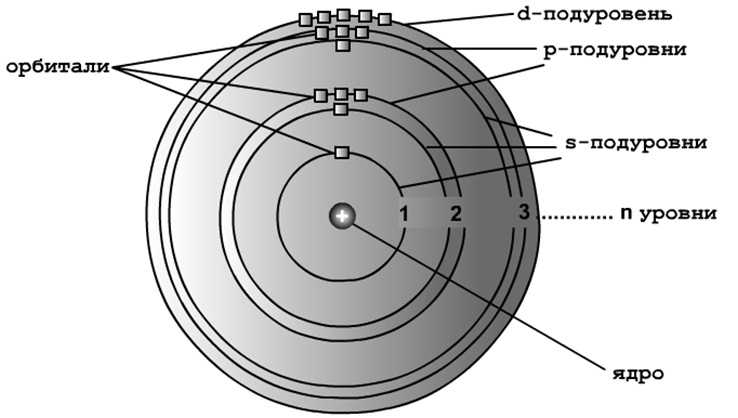
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
Электроны первых 30 химических элементов от водорода до цинка размещены на орбиталях трех видов — s, р и d. Вместимость любой орбитали — два электрона. На 1-м энергетическом уровне одна s-орбиталь.
Таблица. Строение электронных оболочек атомовпервых 20 элементов Периодической системы Д.И. Менделеева
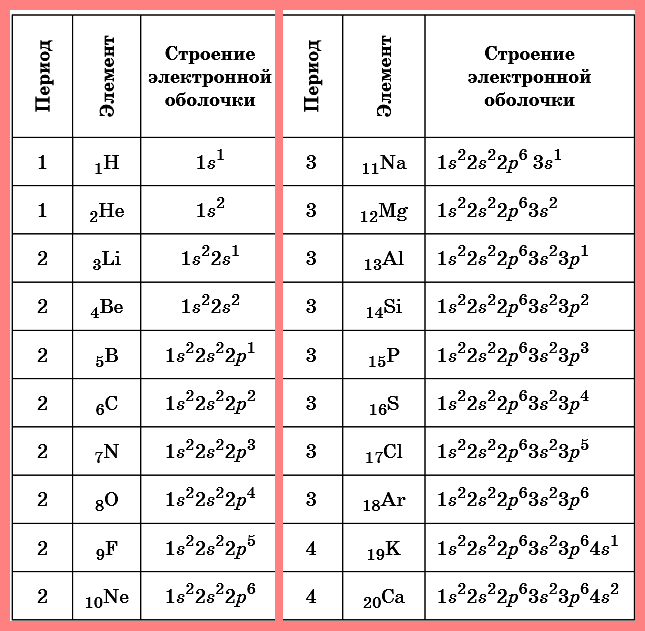
Приведем некоторые сведения, которые следуют из электронной формулы атома на примере атома фтора: F 1s2 2s2 2р5.
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Конспект урока «Строение электронных оболочек атомов».
Строение атома и периодический закон Менделеева
Периодический закон открыт Д. И. Менделеевым 1 марта 1869 года.
Он гласит: свойства элементов (а также образуемых ими соединений) находятся в периодической зависимости от зарядов их ядер.
Что интересно, в своей первоначальной таблице
Дмитрий Иванович определил место для эфирного первоэлемента.
Химическая таблица элементов организована таким образом, что атомы с родственной формой электронных облаков
(наиболее вероятных областей локализации электронов в соответствии с квантовой механикой) занимают близкие позиции.
Например, существуют
s ,
p ,
d и
f -блоки,
для которых электронные облака имеют свои геометрии. Так, s-облако принимает форму сферы, а p — гантели.
Схожесть формы внешних электронных облаков элементов отражает схожесть химических свойств их атомов.
Вы можете почитать о свойствах химических элементов в представленной ниже
модернизированной Таблице Менделеева:
| 1 H Водород 1s1 1,00794 -259,14°C -252,87°C 2,02 / — |
2 He Гелий | ||||||||||||||||
| 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | 43 Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 55 Cs Цезий | 56 Ba Барий | 57 La Лантан | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Ti Таллий | 82 Pb Свинец | 83 Bi Висмут | 84 Po Полоний | 85 At Астат | 86 Rn Радон |
| 87 Fr Франций | 88 Ra Радий | 89 Ac Актиний | 104 Rf/Ku Резерфордий/Курчатовий | 105 Db/Ns Дубний/Нильсборий | 106 Sg Сиборгий | 107 Bh Борий | 108 Hs/Uno Хассий/Уннилоктий/Эка-осмий | 109 Mt/Une Мейтнерий/Унниленний/Эка-иридий | 110 Ds/Uun Дармштадтий/Унуннилий/ | 111 Rg/Uuu Рентгений/Унунуний/ | 112 Cn/Uub Коперниций/Унунбий/Эка-ртуть | 113 Uut Унунтрий/Эка-таллий | 114 Fl/Uuq Флеровий/Унунквадий/Эка-свинец | 115 Uup Унунпентий/Эка-висмут | 116 Lv/Uuh Ливерморий/Унунгексий/Эка-полоний | 117 Uus Унунсептий/Эка-астат | 118 Uuo Унуноктий/Эка-радон |
| 119 Uue Унуненний/Эка-франций | 120 Ubn Унбинилий/Эка-радий | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | 61 Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмий | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | ||
| 90 Th Торий | 91 Pa Протактиний | 92 U Уран | 93 Np Нептуний | 94 Pu Плутоний | 95 Am Америций | 96 Cm Кюрий | 97 Bk Берклий | 98 Cf Калифорний | 99 Es Эйнштейний | 100 Fm Фермий | 101 Md Менделевий | 102 No Норбелий | 103 Lr Лоупенсий |
Цветовая легенда:
| Металлы | Полуметаллы | Неметаллы | ||||||||
| Щелочные м-лы(Li — Fr, Uue) | Щёлочноземельныем-лы (Be-Ra, Ubn) | Переходные металлы(Sc-Zn,Y-Cd,Hf-Hg,Rf-Cn) | Лантаноиды(La — Lu) | Актиноиды(Ac — Lr) | Постпереходные / лёгкие м-лы(Al-Tl,Uut,Sn,Pb,Fl,Bi,Uup,Lv) | Металлоиды(B,Si,Ge,As,Sb,Te,Po) | Халькогены(H,C,N,O,P,S,Se) | Галогены(F-At,Uus) | Инертные газы(He-Rn, Uuo) | Суперактиноиды(?) |
Примечание: Н/и — не известен (не найден, не открыт, не синтезирован)
Суперактино́иды (суперактини́ды, англ. superactinide) — гипотетически возможные химические элементы
с атомными номерами 121 (унбиуний) — 153 (унпенттрий), у которых полностью заполнена 5g-оболочка.
Группа суперактиноидов следует после трансактиноидных элементов и располагается ниже группы
лантаноидов и актиноидов в расширенной периодической таблице элементов.
- WebElements Periodic Table: the periodic table on the web Удобная онлайн-таблица Менделеева.
Строение электронных оболочек атомов
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
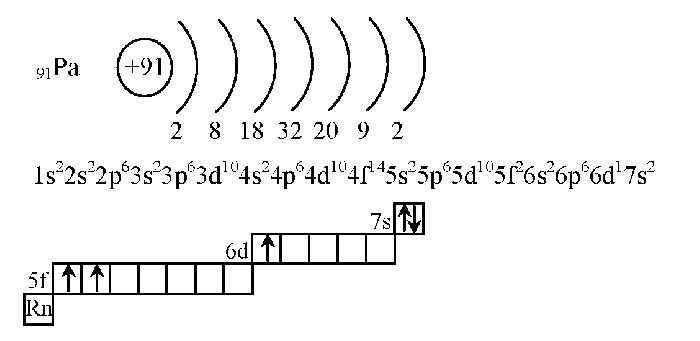 Рис. 3. Схема строения электронной оболочки атома.
Рис. 3. Схема строения электронной оболочки атома.
Что мы узнали?
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
-
/10
Вопрос 1 из 10
Элементы малых периодов
В первых трех периодах, которые называются малыми (или типичными), с увеличением заряда ядра происходит заполнение электронами внешнего энергетического уровня, номер которого совпадает с номером периода в периодической системе.
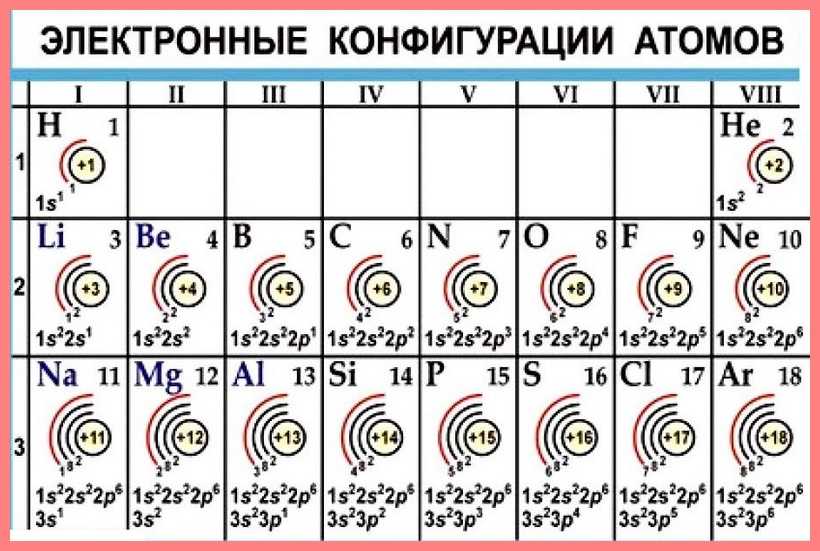
Первый период состоит из двух элементов. У атома водорода один электрон размещается на единой орбитали s-подуровня первого энергетического уровня (n = 1). Электронная формула водорода записывается:
В соответствии с принципом Паули на s-орбитали может находиться два электрона с антипараллельными спинами, поэтому электронная формула атома гелия имеет следующий вид:
Благодаря такому размещению электронов образуется устойчивая конфигурация, которая определяет химическую инертность гелия. В атоме гелия завершается застройка ближайшего к ядру первого энергетического уровня.
Элементы, в атомах которых застраивается электронами s-орбитали внешнего энергетического уровня, называются s-элементами.
Все s-элементы объединяются в s-электронную семью, которая в периодической системе элементов размещается в двух первых группах, за исключением s-элемента гелия Не, который традиционно зачисляют в VIII группу благодаря его принадлежности к инертным элементам.
У элементов второго периода происходит заполнение второго энергетического уровня (второй энергетический уровень, n = 2): сначала заполняется 2s-орбиталь, а затем последовательно три 2р-орбитали. Для упрощения на электронных схемах указываются только полностью заполненные энергетические уровни, например
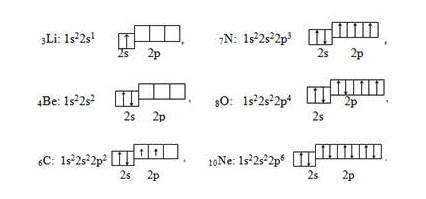
Элементы Li и Be относятся к s-электронной семьи, поскольку в их атомах именно на s-подуровень поступает последний электрон — так называемый формообразующие электрон (или просто формирующий ), то есть, который определяет принадлежность атома к элементам конкретной электронной семьи. В следующих шести элементах, начиная от карбона 6С и заканчивая неоном 10Ne, формирующие электроны заполняют р-подуровень ( l = 1) второго энергетического L-уровня (n = 2).
Элементы, в атомах которых заполняются электронами р-орбитали внешнего энергетического уровня, называются р-элементами.
Cовокупность всех р-элементов составляет р-электронную семью. Р-элементы размещаются в III-VIII группах периодической системы Д.И.Менделеева.
Для s- и р-элементов присуща интересная особенность: количество внешних (валентных) электронов равно номеру группы. Справедливо и обратное утверждение: по количеству валентных электронов в атомах можно установить, в какой группе находится данный элемент.
Третий период, в котором проходит застройка третьего энергетического уровня (n = 3), как и второй, содержит восемь элементов: два s-элемента (Na, Mg) и шесть р-элементов (Al, Si, P, S, Cl, Ar ), причем конфигурация внешнего энергетического уровня соответствующих элементов второго и третьего периодов аналогична. Например, у элементов VII группы фтора и хлора заполнения электронами внешних энергетических уровней происходит подобным образом, что хорошо видно при сравнении электронных формул:
![]()
Благодаря одинаковой электронной конфигурации внешнего электронного слоя, для изображения внешнего энергетического уровня элементов F и Cl можно использовать общую формулу ns2 np5 , где n — значение главного квантового числа для внешнего уровня и одновременно номер периода.
Элементы с одинаковой электронной конфигурацией внешнего энергетического уровня называются элементами-аналогами .
Необходимо помнить, что у элементов третьего периода остается свободным 3d-подуровень.
Фторид натрия
Фторид натрия (NaF) является сходным по строению, кристаллической решетке с хлоридом натрия (NaCl), который является обычной поваренной солью, используемой повсеместно. Но(!) фторид натрия является крайне токсичным веществом, уступая лишь дихромату аммония ((NH4)2Cr2O7) в токсичности. Этот фторид является основным компонентом некоторых крысиных ядов. Он также опасен и для других животных, в том числе и человека, способен вызывать раковые опухоли (например, саркому Юинга), остеопороз, помимо того он разрушает эмаль зубов, которая является одной из самых прочных образований в теле человека.
Электронные формулы химических элементов
Здесь приводится таблица-подсказка для некоторых химических элементов.
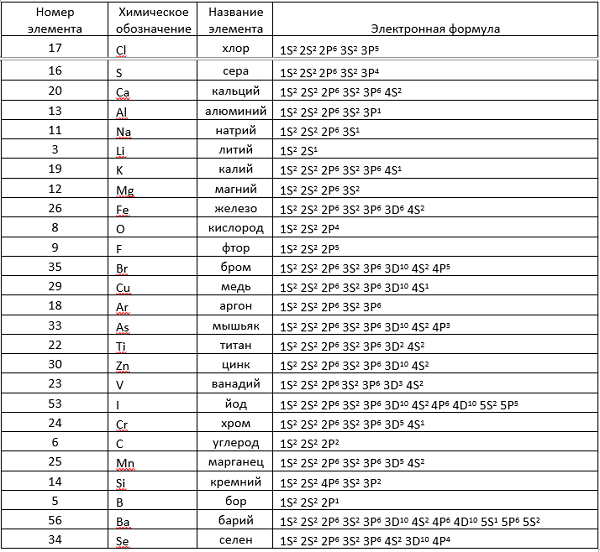
Теперь, руководствуясь данными таблицы, разберем электронные записи элементов на примере «аргона» (Ar).
В таблице Менделеева его номер восемнадцать. Руководствуясь описанным выше, высчитываем количество частиц (всего их 18).

Ещё до построения электронно-графической формулы Аргона, вспомним, как формируются орбитали и строятся ячейки:
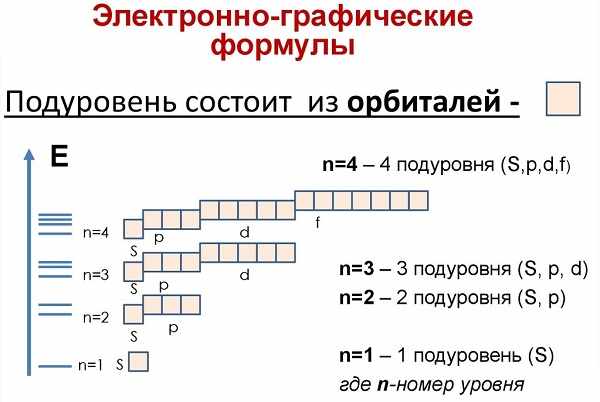
Начинаем распределять электроны Ar:
- a) поскольку аргон находится в третьем периоде, то у него три подуровня. Смотрим в учебник химии и находим, что это p-элемент,
- b) запишем формулу: 1 s, 2 s, 2 p, 3 s, 3 p,
- c) теперь рисуем орбитальные ячейки и заполняем их.
Графическое изображение формулы аргона

Важно знать: непарные заряды во внешних орбиталях, называемые валентными зарядами, отвечают за большинство химических и физических проявлений элементов
Таблица электронных формул атомов химических элементов (4 часть):
| 91 | Протактиний | Pa | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f2 6s2 6p6 6d1 7s2 |
| 92 | Уран | U | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2 |
| 93 | Нептуний | Np | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2 |
| 94 | Плутоний | Pu | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f6 6s2 6p6 7s2 |
| 95 | Америций | Am | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f7 6s2 6p6 7s2 |
| 96 | Кюрий | Cm | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f7 6s2 6p6 6d1 7s2 |
| 97 | Берклий | Bk | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f9 6s2 6p6 7s2 |
| 98 | Калифорний | Cf | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f10 6s2 6p6 7s2 |
| 99 | Эйнштейний | Es | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f11 6s2 6p6 7s2 |
| 100 | Фермий | Fm | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f12 6s2 6p6 7s2 |
| 101 | Менделевий | Md | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f13 6s2 6p6 7s2 |
| 102 | Нобелий | No | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 7s2 |
| 103 | Лоуренсий | Lr | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d1 7s2 |
| 104 | Резерфордий (Курчатовий) | Rf | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d2 7s2 |
| 105 | Дубний (Нильсборий) | Db | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d3 7s2 |
| 106 | Сиборгий | Sg | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d4 7s2 |
| 107 | Борий | Bh | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d5 7s2 |
| 108 | Хассий | Hs | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d6 7s2 |
| 109 | Мейтнерий | Mt | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d7 7s2 |
| 110 | Дармштадтий | Ds | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d8 7s2
либо 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d9 7s1 |
Коэффициент востребованности
3 069
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атомаравен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | 1 |
| нейтрон | n | 1 | |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной
массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом
Очень
важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:182
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,на 2-м — 8 e−,на внешнем уровне — 8 e−;
- числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Рис. 1. Атом.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
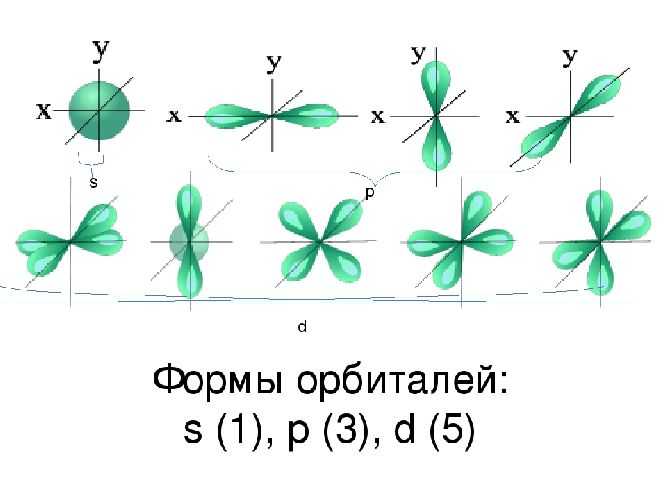 Рис. 2. Формы электронных орбиталей.
Рис. 2. Формы электронных орбиталей.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
N=2n2,
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Открытие новых химических элементов (новости)
Элемент, получивший временное название унунсептий (собственно, «сто семнадцатый» по-латински), впервые
был получен в 2010 г. в лабораторных условиях группой российских и американских исследователей.
Тогда для получения элемента мишень из изотопа 97-го элемента, берклия-249, была обстреляна ионами кальция-48.
Однако по требованиям Международного союза теоретической и прикладной химии для внесения нового элемента в таблицу Менделеева
его существование должно быть подтверждено двумя независимыми исследованиями.
И вот, в мае 2014 года команда немецких учёных под руководством Кристофа Дюллмана подтвердила существование 117-го элемента таблицы Менделеева.
Им удалось создать 4 атома унунсептия, которые просуществовали всего десятую долю секунды.
К слову, 117-й элемент появлялся в одной из серий «Футурамы», где он носил название «фарнсий».
Ученые, открывающие новые элементы, получают право самостоятельно придумывать их названия и буквенные обозначения.
Главная
Химия :
История химии |
Атомы |
Аналитическая химия |
Неорганическая химия |
Органическая химия |
Физическая химия |
Надмолекулярная химия |
Нефтехимия |
Материаловедение |
Справочники |
Публикации по химии
Связанные по теме страницы:
Месторождения золота
На правах рекламы (см.
условия):
|
Алфавитный перечень страниц: |
|
|
На русском языке: атомы, периодическая таблица Менделеева, атомарная структура вещества, свойства химических элементов, На английском языке: atom, Mendeleev periodical table, chemical elements. |
«Сайт Игоря Гаршина», 2002, 2005.
Автор и владелец — Игорь Константинович Гаршин
(см. резюме).
Пишите письма
().
Страница обновлена 27.07.2022
Заключение
Чтобы немного отстранится от научных теорий, стоит пофантазировать. Представьте атомное ядро и окружающие его заряды вселенной. Ядро – это солнце, а заряды планеты. Формула наглядно описывает положение подобных «планет» в космосе (атомного вещества). Чтобы перейти с одного уровня на другой, потребуется большая энергия.
В квантовой физике некоторые специалисты выдвинули теорию о том, что при вмешательстве в структуру атома можно сделать объект невидимым. Ведь если подумать, то фотон (мельчайшая частица света) может не вступать в связь с электронами атома и, не встречая сопротивления, преодолевать объект.
Впечатляет? Химическая формула элемента очень важна для физики. Благодаря труду Менделееву и его таблице, нам стали доступны современные технологии. Химические формулы и эксперименты скучны и сложны, хочется верить, что эта статья сделала их более понятными.