Содержание:
В окись этилена Это органическое соединение семейства эпоксидов. При комнатной температуре он газообразный, бесцветный и, хотя он почти не имеет запаха, имеет легкий сладкий запах, похожий на запах эфиров.
Это очень универсальный химический строительный блок, поскольку он используется в широком спектре промышленных приложений для производства других химических соединений с множеством применений. Это связано с его высокой реакционной способностью, то есть с легкостью реагирования с другими веществами.
Одно из основных его применений — это сырье при производстве компонентов антифриза для автомобильных радиаторов. Его производные используются в качестве ингредиентов в промышленных или бытовых чистящих средствах, косметических продуктах и шампунях, пластификаторах, фармацевтических препаратах или мазях.
Это широко используемое дезинфицирующее средство, например, при стерилизации медицинского и стоматологического оборудования, поскольку оно способно уничтожать вирусы, бактерии, грибки и споры, особенно в сухих условиях. Кроме того, его использовали для фумигации пищевых продуктов для упаковки, хотя такое использование вызывает сомнения.
Несмотря на его полезность, с ним нужно обращаться с особой осторожностью, так как он может вызвать раздражение глаз и кожи. Вдыхание оксида этилена в течение длительного времени может повлиять на нервную систему
Поэтому лица, подвергающиеся воздействию его паров или растворов, должны носить защитную одежду и оборудование.
Полезные факты
1) Этилен является природным растительным гормоном, он влияет на рост, развитие, созревание и старение всех растений.
2) Газ не вреден и не токсичен для человека в определенной концентрации (100-150 мг).
3) Он используется в медицине в качестве обезболивающего средства.
4) Действие этилена замедляется при низких температурах.
5) Характерным свойством является хорошая проникающая способность через большинство веществ, например через картонные упаковочные коробки, деревянные и даже бетонные стены.
6) В то время как он имеет неоценимое значение благодаря своей способности инициировать процесс созревания, он также может быть очень вредным для многих фруктов, овощей, цветов и растений, ускоряя процесс старения и снижая качество продукта и его срок годности. Степень повреждения зависит от концентрации, продолжительности воздействия и температуры.
7) Этилен взрывоопасен при высоких концентрациях.
![]() Этилен используется в производстве стекла специального назначения для автомобильной промышленности.
Этилен используется в производстве стекла специального назначения для автомобильной промышленности.
9) Изготовление металлоконструкций: газ используется в качестве кислородно-топливного газа для резки металла, сварки и высокой скорости термического напыления.
10) Нефтепереработка: этилен используется в качестве хладагента, особенно на производстве по сжижению природного газа.
11) Как уже говорилось ранее, этилен является очень реактивным веществом, кроме того, он еще и очень легко воспламеняется. Из соображений безопасности, его обычно транспортируют по специальному отдельному газопроводу.
12) Одним из самых распространенных продуктов, изготовленных непосредственно из этилена, является пластмасса.
ГОСТ 25070-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ЭТИЛЕН
Технические условия
Ethylene. Specifications
МКС 71.080.10
Дата введения 2015-01-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ» (ФГУП «ВНИЦСМВ») и Обществом с ограниченной ответственностью «ВНИИОС-наука» (ООО «ВНИИОС-наука»)
2 ВНЕСЕН Межгосударственным техническим комитетом по стандартизации МТК 527 «Химия»
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44-2013)За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
|
Казахстан |
Госстандарт Республики Казахстан |
|
|
Молдова |
Молдова-Стандарт |
|
|
Россия |
Росстандарт |
|
|
Таджикистан |
Таджикстандарт |
|
|
Узбекистан |
Узстандарт |
|
|
Украина |
Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 1912-ст межгосударственный стандарт ГОСТ 25070-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2015 г.
5 ВЗАМЕН ГОСТ 25070-87
6 ПЕРЕИЗДАНИЕ. Март 2016 г.Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок — в ежемесячно издаваемом информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Примечания и ссылки
- ↑ и
- рассчитывается молекулярная масса от .
- ↑ и (in) Ивона Овцарек и Кристина Блазей, « Рекомендуемые критические температуры. Часть I. Алифатические углеводороды ” , J. Phys. Chem. Ref. Данные , т. 32, п о 4,4 августа 2003 г., стр. 1411 ( DOI )
- ↑ и (ru) Роберт Х. Перри и Дональд В. Грин , Perry’s Chemical Engineers ‘Handbook , США, McGraw-Hill,1997 г., 7- е изд. , 2400 с. ( ISBN 0-07-049841-5 ) , стр. 2-50
- (in) Ивона Кристина Блажей Овцарек и « Рекомендуемые критические давления. Часть I. Алифатические углеводороды ” , J. Phys. Chem. Ref. Данные , т. 35, п о 4,18 сентября 2006 г., стр. 1461 ( DOI )
- (in) Уильям М. Хейнс , Справочник CRC по химии и физике , Бока-Ратон, CRC Press / Тейлор и Фрэнсис,1 — го июля 2010, 91- е изд. , 2610 с. , стр. 14-40
- (in) Ирвин Глассман и Ричард А. Йеттер, Combustion , Амстердам / Бостон, Elsevier ,2008 г., 4- е изд. , 773 с. ( ISBN 978-0-12-088573-2 ) , стр. 6
- (in) Карл Л. Яс, Справочник по термодинамическим диаграммам: органические соединения от C8 до C28 , т. 1, Хьюстон, Техас, паб Gulf. Co.,1996 г., 396 с. ( ISBN 0-88415-857-8 )
- (in) Дэвид Р. Лид , Справочник CRC по химии и физике , Бока-Ратон, CRC Press,18 июня 2002 г., 83- е изд. , 2664 с. , стр. 5-89
- (in) Дэвид Р. Лид , Справочник CRC по химии и физике , Бока-Ратон, CRC Press / Тейлор и Фрэнсис,17 июня 2008 г., 89- е изд. , 2736 с. , стр. 10-205
- ↑ и
- Уоррен Р. Тру, Oil & Gas Journal , 2012, т. 110, выпуск 7
- Скотт К.Дж., МакГлассон В.Б. и Робертс Э.А., « Перманганат калия в качестве абсорбента этилена в полиэтиленовых пакетах для задержки созревания бананов во время хранения », Австралийский журнал экспериментального земледелия и животноводства , вып. 10, п о 43,1970 г., стр. 237 ( DOI )
- Скотт KJ, Блейк, JR, Stracha, G, Tugwell, BL и McGlasson WB, « Транспортировка бананов при температуре окружающей среды с использованием полиэтиленовых пакетов », Tropical Agriculture (Trinidad) , vol. 48,1971 г., стр. 163–165
- Скотт К.Дж. и Ганданегара С. « Влияние температуры на срок хранения бананов в полиэтиленовых мешках с этиленовым абсорбентом », Тропическое сельское хозяйство (Тринидад) , том. 51,1974 г., стр. 23–26
- ↑ и (in) Карстен Варнеке и Йуст де Гоу, , NOAA / ESRL .
Производство
Мировое производство этилена составило 107 миллионов тонн в 2005 году, 109 миллионов тонн в 2006 году, 138 миллионов тонн в 2010 году и 141 миллион тонн в 2011 году. К 2013 году этилен производили по крайней мере 117 компаний в 32 странах. Чтобы удовлетворить постоянно растущий спрос на этилен, резко увеличиваются производственные мощности во всем мире, особенно на Ближнем Востоке и в Китае .
Промышленный процесс
Этилен в нефтехимической промышленности производят несколькими способами . Первичный метод — паровой крекинг (SC), при котором углеводороды и пар нагреваются до 750–950 ° C. Этот процесс превращает крупные углеводороды в более мелкие и вводит ненасыщенность. Когда этан является сырьем, этилен является продуктом. Этилен отделяют от полученной смеси повторным сжатием и перегонкой . В Европе и Азии этилен получают в основном из крекинга нафты, газойля и конденсатов с совместным производством пропилена, олефинов C4 и ароматических углеводородов (пиролизный бензин). Другие технологии, используемые для производства этилена, включают окислительное сочетание метана , синтез Фишера-Тропша , превращение метанола в олефины (МТО) и каталитическое дегидрирование.
Лабораторный синтез
Хотя этилен имеет большое промышленное значение, его редко синтезируют в лаборатории, и его обычно покупают. Она может быть получена с помощью дегидратации этанола с серной кислотой или в газовой фазе с оксидом алюминия .
Биосинтез
Этилен в природе производится из метионина . Непосредственным предшественником является 1-аминоциклопропан-1-карбоновая кислота .
Схема применения этилена
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации — это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах. Области применения этилена многочисленны. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов. Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), окись этилена (антифриз, полиэфирные волокна и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и синтетического каучука. Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.
Использует
Основные промышленные реакции этилена включают в себя в порядке масштаба: 1) полимеризацию , 2) окисление , 3) галогенирование и гидрогалогенирование , 4) алкилирование , 5) гидратацию , 6) олигомеризацию и 7) гидроформилирование . В США и Европе примерно 90% этилена используется для производства этиленоксида , этилендихлорида , этилбензола и полиэтилена . Большинство реакций с этиленом представляют собой электрофильное присоединение .
Основные виды промышленного использования этилена. По часовой стрелке от верхнего правого угла: его превращения в оксид этилена , предшественник этиленгликоля; в этилбензол , предшественник стирола ; к различным видам полиэтилена ; до этилендихлорида , предшественника винилхлорида .
Полимеризация
Полиэтилен потребляет более половины мировых поставок этилена. Полиэтилен, также называемый полиэтиленом и полиэтиленом , является наиболее широко используемым пластиком в мире. Он в основном используется для изготовления пленок для упаковки , мешков для переноски и вкладышей для мусора . Линейные альфа-олефины , полученные путем олигомеризации (образования коротких полимеров), используются в качестве прекурсоров , детергентов , пластификаторов , синтетических смазок , добавок, а также в качестве сомономеров при производстве полиэтиленов.
Окисление
Этилен окисляется с образованием окиси этилена , ключевого сырья для производства поверхностно-активных веществ и детергентов путем этоксилирования . Оксид этилена также гидролизуется с образованием этиленгликоля , широко используемого в качестве автомобильного антифриза, а также гликолей с более высокой молекулярной массой, простых эфиров гликоля и полиэтилентерефталата .
Этилен окисляется палладием с образованием ацетальдегида . Это преобразование остается основным промышленным процессом (10 млн кг / год). Процесс протекает через начальное комплексообразование этилена до центра Pd (II).
Галогенирование и гидрогалогенирование
Основные промежуточные продукты галогенирования и гидрогалогенирования этилена включают этилендихлорид , этилхлорид и этилендибромид . Добавление хлора влечет за собой « оксихлорирование », т.е. сам хлор не используется. Некоторые продукты, полученные из этой группы, включают поливинилхлорид , трихлорэтилен , перхлорэтилен , метилхлороформ , поливинилиденхлорид и сополимеры , а также бромистый этил .
Алкилирование
Основным химическим промежуточным продуктом алкилирования этиленом является этилбензол , предшественник стирола . Стирол используется в основном в полистироле для упаковки и изоляции, а также в бутадиен-стирольном каучуке для шин и обуви. В меньшем масштабе — этилтолуол , этиланилины, 1,4-гексадиен и алкилы алюминия . Продукты этих промежуточных продуктов включают полистирол , ненасыщенные полиэфиры и тройные сополимеры этилена и пропилена .
Оксо реакция
Гидроформилирования (реакция оксо) результатов этилена в пропионовом , предшественник пропионовой кислоты и н-пропилового спирт .
Гидратация
Этилен долгое время был основным неферментирующим предшественником этанола . Первоначальный метод предусматривал его преобразование в диэтилсульфат с последующим гидролизом. Основным методом, применяемым с середины 1990-х годов, является прямая гидратация этилена, катализируемая твердыми кислотными катализаторами :
- С 2 Н 4 + Н 2 О → СН 3 СН 2 ОН
Димеризация в бутены
Этилен димеризован от hydrovinylation с получением п -butenes с использованием процессов , лицензированного Ламмесом или IFP . Процесс Lummus дает смешанные н- бутены (в основном 2-бутены ), а процесс IFP дает 1-бутен . 1-бутен используется в качестве сомономера при производстве некоторых видов полиэтилена .
Плоды и цветение
Этилен — гормон, влияющий на созревание и цветение многих растений. Он широко используется для контроля свежести в садоводстве и фруктах .
Ниша использует
Примером нишевого использования является анестезирующее средство (при соотношении этилена 85% и кислорода 15%). Другое применение — как сварочный газ.
Этилен как загрязнитель воздуха
Этилен после переработки в техасскую химическую промышленность. Белые треугольники указывают на промышленные источники, идентифицированные Агентством по охране окружающей среды штата Техас.
- Этилен, как фито-гормоны может оказать воздействие на alteragenic определенных видов.
- В присутствии солнечных ультрафиолетовых лучей, то есть дневного света, этот газ также является одним из предшественников озона . Поскольку этилен очень реакционноспособен и светочувствителен , его продолжительность жизни в воздухе сокращается (менее часа в полдень на широте Техаса). Поэтому он долгое время мало изучался и мало отслеживался как загрязнитель . Затем выяснилось, что ночью он может сохраняться гораздо дольше . Недавно были разработаны инструменты для измерения этиленовых шлейфов в реальном времени. NOAA в Техасе провело исследование (TexAQS2000) этиленовых шлейфов, генерируемых химической промышленностью (из Фрипорта ).
- Во-первых, это показало, что промышленные выбросы были очень сильно занижены в кадастрах, проведенных штатом Техас на основе заявлений производителей.
- Он также показал, что уровни этилена, намного превышающие нормальные, все еще присутствовали с подветренной стороны от этих источников на большом расстоянии (от десятков до сотен километров), особенно ночью. Авторы этого исследования пришли к выводу, что в результате производство приземного озона из некоторых промышленных шлейфов (содержащих этилен) было недооценено моделями.
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
В высоких концентрациях этилен оказывает на человека и животных наркотическое действие.
Химические свойства алкинов.
Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция присоединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присоединение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «размазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов.
1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,
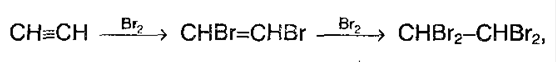
А суммарно:
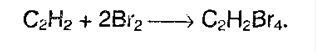
Алкины также как алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов.
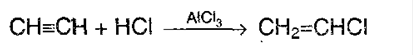
2. Гидрогалогенирование. Галогенводороды присоединяются к тройной связи несколько тружднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях модно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:
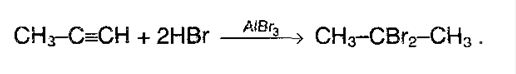
Если же галогенводород в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:
3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:
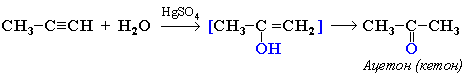
На 1ой стадии образуется непредельный спирт, в котором гидроксигруппа находится у атома углерода, образующего двойную связь. Такие спирты называются виниловыми или фенолами.
Отличительная черта таких спиртов – неустойчивость. Они изомеризуются в более стабильные карбонильные соединения (альдегиды и кетоны) вследствие переноса протона от ОН-группы к углероду при двойной связи. При этом π-связь рвется (между атомами углерода), и образуется новая π-связь между атомомами углерода и атомом кислорода. Такая изомеризация происходит из-за большей плотности двойной связи С=О по сравнению с С=С.
Только ацетилен превращается в альдегид, его гомологи — в кетоны. Реакция протекает по правила Марковникова:
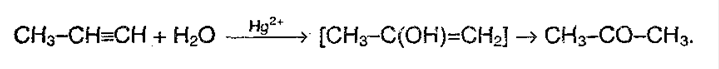
Эта реакция носит названия – реакции Кучерова.
4. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи .
Причиной поляризации служит сильная электроотрицательность атома углерода в sp-гибридизации, поэтому алкины могут образовывать соли – ацетилениды:
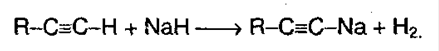
Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:
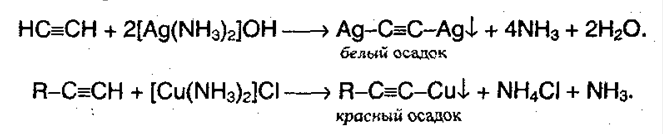
Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин:
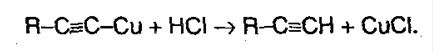
Поэтому алкины легко выделить из смеси других углеводородоров.
5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:
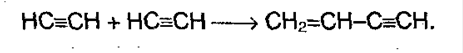
Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:
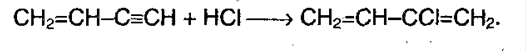
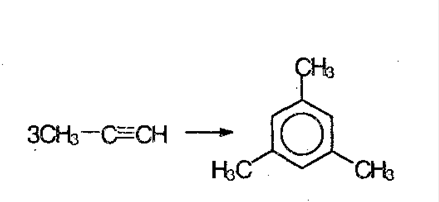
6. Если ацетилен пропускать через уголь при 600 ºС, получают ароматическое соединение – бензол. Из гомологов ацетилена, получают гомологи бензола:
7. Реакция окисления и восстановления. Алкины легко окисляются перманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:
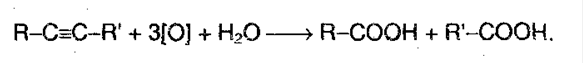
В присутствие металлических катализаторов происходит восстановление водородом:
Получение и применение в промышленности
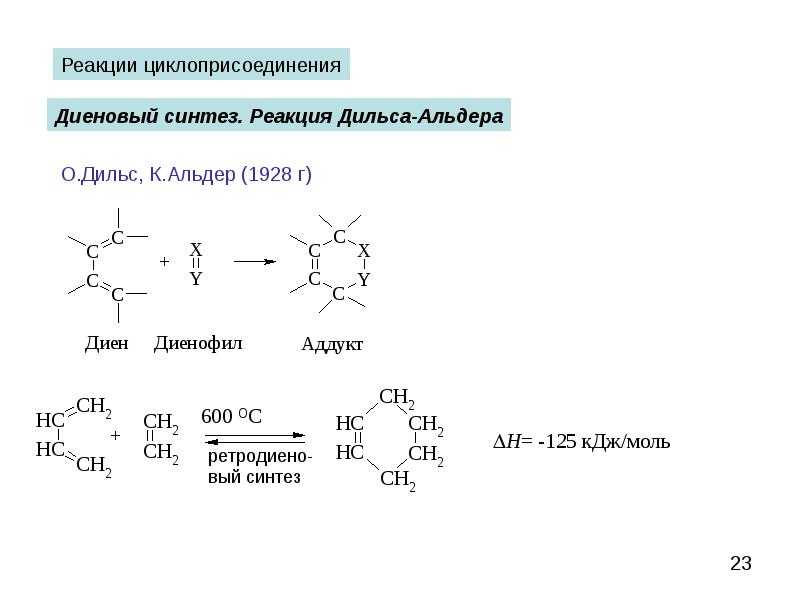
В промышленности так получают высокомолекулярный полиэтилен, стереорегулярный изотактический полипропилен, этилен — пропиленовый каучук. Реакционные карбены присоединяются к двойной связи с образованием циклопропанового фрагмента — циклопропанирования. Известны реакции 1,3-диполярного циклоприсоединения и диеновый синтез.
Есть углеводороды, которые легко окисляются и в зависимости от условий реакции окисления образуются различные вещества. Например, при действии KMnO4 (в кислой среде) — смесь карбоновых кислот и кетонов, при действии KMnO4 (слабощелочной раствор) — гликоли (реакция Вагнера), так же действует OsO4 в органических растворителях; HIO4 в присутствии OsO4 расщепляет молекулы этиленовых углеводородов по двойной связи с образованием смеси карбонильных соединений. То же происходит при озонолиза и разложении озонидов.
Реакцию Вагнера и озонирование используют для определения строения этиленовых углеводородов. Действие молекулярного кислорода на этиленовые углеводороды в газовой фазе (150-300 ° С) в присутствии катализатора (Ag) приводит к образованию эпоксисоединений. Таким образом в промышленности синтезируют этилен- и пропиленоксид.
Эпоксиды образуются количественно при воздействии на этиленовых углеводородов надкислот или Н2О2 в ацетонитриле.
При окислении этилена и пропилена кислородом воздуха (CuCl2 и PdCl2) получают соответственно ацетальдегид и ацетон. Известны также методы окисления этиленовых углеводородов, при которых привлекаются двойные связи; например в промышленности газофазным окислением пропилена получают акролеин, в результате окислительного аммонолиза образуется акрилонитрил. Основным способом добывания этиленовых углеводородов является использование нефтепродуктов и природного газа. Из газов жидкофазного и парофазного крекинга комбинацией методов розничной адсорбции, глубокого охлаждения и ректификации под давлением можно выделить индивидуальные этиленовые углеводороды. В лабораторных условиях и в небольшом количестве в промышленности этиленовых углеводородов получают дегидратацией спиртов над Al2O3 или ThO2 при температуре 400-420 ° С или с помощью кислотных дегидратных агентов (H2SO4, ZnCl2, P2O5 и др.).
Метод удобен в случае получения низших олефинов, так как в случае более сложных этиленовых углеводородов реакция часто сопровождается изомеризации. Есть углеводороды (Главным образом цис-изомеры) с заданным положением двойной связи можно получить пиролизом эфиров карбоновых кислот:
разложением четвертичных аммониевых оснований (реакция Гофмана) гидрированием ацетиленовых углеводородов или дегидрированием алканов;
действием алкилиденфосфоренив на карбонильные соединения (реакция Виттига), восстановительным сочетанием альдегидов и кетонов при обработке LiAlH4 и др.
Этиленовые углеводороды — основные исходные реагенты в химической промышленности. Из этилена и пропилена получают различные полимеры и эластомеры, эпоксисоединения, дихлорэтан, этанол, стирен и др.
Получение
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид . После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство сначала в Великобритании, а позднее и в других странах.
Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при +800-950 °С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30 %. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25 %. Наибольший выход этилена — до 50 % — достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара.
При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен . Методы отбора проб». Отбор пробы этилена может производиться и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Промышленно получаемый в России этилен должен соответствовать требованиям, изложенным в ГОСТ 25070-2013 «Этилен. Технические условия».
Получение и свойства этилена
Немецкий химик Иоган Бехер случайно использовал этиловый спирт в опытах с концентрированной серной кислотой. Так впервые был получен этен в лабораторных условиях (1680 год). В середине XIX века А.М. Бутлеров дал соединению название этилен. Физические свойства и химические реакции также были описаны известным русским химиком. Бутлеров предложил структурную формулу, отражающую строение вещества. Способы его получения в лаборатории:
- Каталитическое гидрирование ацетилена.
- Дегидрогалогенирование хлорэтана в реакции с концентрированным спиртовым раствором сильного основания (щелочи) при нагревании.
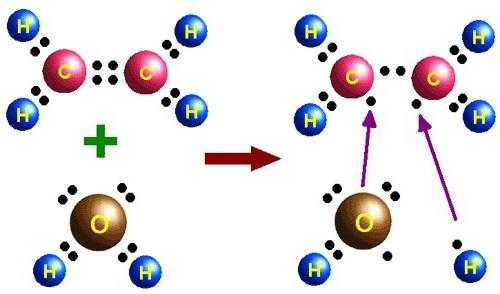
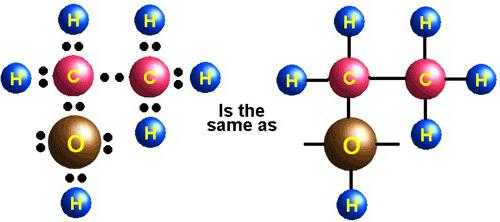
- Отщепление воды от молекул этилового спирта (дегидратация). Проходит реакция в присутствии серной кислоты. Ее уравнение: Н2С–СН2–OH → Н2С=СН2 + Н2О
Промышленное получение:
- переработка нефти — крекинг и пиролиз углеводородного сырья;
- дегидрирование этана в присутствии катализатора. H3C–CH3 → H2C=CH2 + H2
Строение этилена объясняет его типичные химические реакции — присоединение частиц атомами C, которые находятся при кратной связи:
- Галогенирование и гидрогалогенирование. Продуктами этих реакций являются галогенопроизводные.
- Гидрирование (насыщение водородом), получение этана.
- Окисление до двухатомного спирта этиленгликоля. Его формула: OH–H2C–CH2–OH.
- Полимеризация по схеме: n(H2C=CH2) → n(-H2C–CH2-).
Полимеризация олефинов
Повышение температуры, увеличение давления и применение катализаторов – это необходимые условия для проведения процесса полимеризации. Его механизм отличается от реакций присоединения или окисления. Он представляет собой последовательное связывание многих молекул этилена в местах разрыва двойных связей. Продуктом реакции является полиэтилен, физические характеристики которого зависят от величины n — степени полимеризации. Если она невелика, то вещество находится в жидком агрегатном состоянии. Если показатель приближается к 1000 звеньев, то из такого полимера изготовляют полиэтиленовую пленку, гибкие шланги. Если степень полимеризации превышает 1500 звеньев в цепи, то материал представляет собой твердое вещество белого цвета, жирное на ощупь.

Он идет на изготовление цельнолитых изделий и пластиковых труб. Галогенпроизводное соединение этилена – тефлон обладает антипригарными свойствами и является широко применяемым полимером, востребованным при изготовлении мультиварок, сковород, жаровен. Его высокая способность противостоять истиранию используется в производстве смазок к автомобильным двигателям, а низкая токсичность и толерантность к тканям человеческого организма позволили применять тефлоновые протезы в хирургии.

В нашей статье мы рассмотрели такие химические свойства олефинов, как горение этилена, реакции присоединения, окисления и полимеризации.