Примечания
- С. Т. Жуков Химия 8-9 класс, Глава 1. Основные представления и понятия химии
- Разброс экспериментальных данных связан, по видимому, с фазовым переходом графит-карбин и различной скоростью нагрева при измерениях. Климовский И. И., Марковец В. В. Влияние фазового перехода графит-карбин на излучательную способность графитовых образцов при их нагревании до температур 3000 K и более // International Scientific Journal for Alternative Energy and Ecology. — 2007. — № 6 (50). — С. 50-59.
- Андреев В. Д. Избранные проблемы теоретической физики.. — Киев: Аванпост-Прим,. — 2012.
- Мейер К. Физико-химическая кристаллография, М., «Металлография», 1972
- Lindemann F. A. // Phys.Z., 1910, v.11, p.609
- Wood W. W., Jacobson J. D. Preliminary Results from a Recalculation of the Monte Carlo Equation of State of Hard Spheres // J. Chem. Phys.. — 1957. — № 27. — С. 1207. — DOI:10.1063/1.1743956.
- Alder B. J., Wainwright T. E. Phase Transition in Elastic Disks // Phys. Rev.. — 1962. — № 127. — С. 359. — DOI:10.1103/PhysRev.127.359.
- Hoover W. G., Gray S. G., Johnson K. W. Thermodynamic Properties of the Fluid and Solid Phases for Inverse Power Potentials // J. Chem. Phys.. — 1971. — № 55. — С. 1128. — DOI:10.1063/1.1676196.
- Пайнс Д. Элементарные возбуждения в твёрдых телах. М., Мир, 1965.
- Андреев В. Д. Крэш (crash)-конформационная кинематика ковалентной решетки алмаза при плавлении. // Журнал структурной химии. — 2001. — № 3. — С. 486-495.
- Андреев В. Д. «Фактор плавления» при межатомных взаимодействиях в алмазной решетке. // Химическая физика. — 2002. — № 8,т.21. — С. 35-40.
Плавление — фазовый переход первого рода

Согласно своему определению, плавление является переходом первого рода, поскольку при нем происходит поглощение теплоты. При этом температура всей системы в процессе плавления не изменяется и является постоянной величиной. Этот факт объясняется тем, что подводимое к телу тепло расходуется не на увеличение кинетической энергии атомов и молекул, а на разрыв прочных химических связей между ними. Только после того, как все связи в твердом теле будут разрушены, дальнейший подвод тепла к уже жидкому веществу приведет к увеличению его температуры.
Сам процесс плавления не происходит спонтанно, а развивается в определенном промежутке времени, когда жидкая и твердая фазы сосуществуют в равновесии друг с другом.
Таким образом, плавление — это эндотермический процесс, что означает, что он идет с поглощением теплоты. Обратный процесс, при котором жидкость затвердевает, называется кристаллизацией.
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.
Интересное: Как варить чугун
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке
Плавление стали

Плавления стали при температуре 1400 °C Сталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 °C.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
Правильный ответ
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение — при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение — во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \)?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть — в газообразном
4) часть воды в жидком состоянии, часть — в кристаллическом
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см3. Во вторник она увеличилась и стала равной 15,4 г/см3. Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см3?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10-3 кг/м3, а плотность насыщенного пара при этой температуре 30·10-3 кг/м3?
1) 60%
2) 30%
3) 18 %
4) 1,7 %
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени \( 0-t_1 \) оба вещества находились в жидком состоянии
Часть 2
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. В процессе плавления кристаллическое твёрдое тело становится жидкостью. При этом
1) уменьшается внутренняя энергия тела 2) увеличивается средняя кинетическая энергия молекул 3) увеличивается внутренняя энергия тела 4) уменьшается средняя кинетическая энергия молекул
2. В одном сосуде находится лёд при температуре 0 °С, в другом — такая же масса воды при температуре 0 °С. Внутренняя энергия льда
1) равна внутренней энергии воды 2) больше внутренней энергии воды 3) меньше внутренней энергии воды 4) равна нулю
3. На рисунке представлен график зависимости температуры от времени для процесса нагревания льда. Процессу плавления льда соответствует участок графика
1) AB 2) BC 3) CD 4) DE
4. На рисунке приведён график зависимости температуры некоторого вещества от времени. Первоначально вещество находилось в жидком состоянии. Какая точка графика соответствует началу процесса отвердевания вещества?
1) А 2) Б 3) В 4) Г
5. На рисунке приведён график зависимости температуры некоторого вещества от времени. Первоначально вещество находилось в жидком состоянии. Какая точка графика соответствует окончанию процесса отвердевания вещества?
1) А 2) Б 3) В 4) Г
6. На рисунке изображён график зависимости температуры тела от времени. Первоначально тело находилось в жидком состоянии. Какой процесс характеризует отрезок БВ?
1) нагревание 2) охлаждение 3) плавление 4) кристаллизацию
7. На рисунке представлен график зависимости температуры ( t ) от времени ( tau ) при непрерывном нагревании и последующем непрерывном охлаждении вещества, первоначально находящегося в твёрдом состоянии. В каком состоянии находится вещество в точке Е?
1) только в жидком 2) только в твёрдом 3) только в газообразном 4) часть — в жидком, часть — в твёрдом
8. Удельную теплоту плавления можно рассчитать по формуле
1) ( frac{Q}{m(t_2-t_1)} ) 2) ( frac{Q}{m} ) 3) ( frac{Q}{(t_2-t_1)} ) 4) ( lambda m )
9. Чему равно количество теплоты, которое необходимо затратить на полное превращение 2 кг свинца в жидкое состояние, если его начальная температура 27 °С?
1) 50 кДж 2) 78 кДж 3) 128 кДж 4) 15000 кДж
10. Какое количество теплоты выделяется при превращении 500 г воды, взятой при 0 °С, в лёд при температуре -10 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
1) 10500 Дж 2) 175 500 Дж 3) 165 000 Дж 4) 10500 Дж
11. На рисунке представлен график зависимости температуры некоторого вещества от полученного количества теплоты. Первоначально вещество находилось в твёрдом состоянии.
Используя данные графика, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Удельная теплоёмкость вещества в твёрдом состоянии равна удельной теплоёмкости вещества в жидком состоянии. 2) Температура кипения вещества равна tx. 3) В точке В вещество находится в твёрдом состоянии. 4) В процессе перехода из состояния Б в состояние В внутренняя энергия вещества увеличивается. 5) Участок графика ГД соответствует процессу плавления вещества.
12. На рисунке представлены графики зависимости температуры от полученного количества теплоты для двух веществ одинаковой массы. Первоначально каждое из веществ находилось в твёрдом состоянии.
Используя данные графиков, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Удельная теплоёмкость первого вещества в твёрдом состоянии меньше удельной теплоёмкости второго вещества в твёрдом состоянии. 2) В процессе плавления первого вещества было израсходовано большее количество теплоты, чем в процессе плавления второго вещества. 3) Представленные графики не позволяют сравнить температуры кипения двух веществ. 4) Температура плавления второго вещества выше. 5) Удельная теплота плавления у второго вещества больше.
Часть 2
13. Зависимость температуры 1 л воды от времени при непрерывном охлаждении представлена на графике. Какое количество теплоты выделилось при кристаллизации воды и охлаждении льда?
Что такое отвердевание
Наблюдения показывают, что если расплавленное вещество охладить, то при достижении температуры Tотв (температура отвердевания) начинается обратный процесс перехода из жидкого состояния в твердое. Этот фазовый переход называется отвердеванием или кристаллизацией. Экспериментально доказано, что для кристаллических тел Tпл = Tотв. “Горячие” молекулы”, при охлаждении теряют скорость и отдают тепло в окружающую среду. Внутренняя энергия уменьшается, частицы под воздействием сил молекулярного взаимодействия начинают “занимать” постоянные места, восстанавливая структуру решетки.
Процессы плавления и отвердевания происходят не скачкообразно, а постепенно, так, что одновременно могут соседствовать твердая и жидкая компоненты. Эксперименты показывают, что до окончания плавления (или отвердевания) всей массы вещества, его температура остается постоянной.
Металлы, температура плавления которых больше 1650С, называют тугоплавкими. Например, температура плавления вольфрама равна 3370С. Поэтому из него делают долговечные нити накаливания для ламп. Тугоплавкие металлы и их сплавы незаменимы в ракетостроении, атомной энергетике, металлургии, космической технике — везде, где необходимы высокие жаропрочные свойства.
Переходы между агрегатными состояниями
Важно знать и понимать, каким образом осуществляются переходы между агрегатными состояниями веществ. Схему таких переходов изобразим на рисунке 4
Рис. 4.
1 – плавление;
2 – отвердевание (кристаллизация);
3 – парообразование: испарение или кипение;
4 – конденсация;
5 – сублимация (возгонка) – переход из твердого состояния в газообразное, минуя жидкое;
6 – десублимация – переход из газообразного состояния в твердое, минуя жидкое.
На сегодняшнем уроке мы уделим внимание таким процессам, как плавление и отвердевание кристаллических тел. Начать рассмотрение таких процессов удобно на примере наиболее часто встречающихся в природе плавления и кристаллизации льда
«Плавление и кристаллизация. Удельная теплота плавления»
Плавление
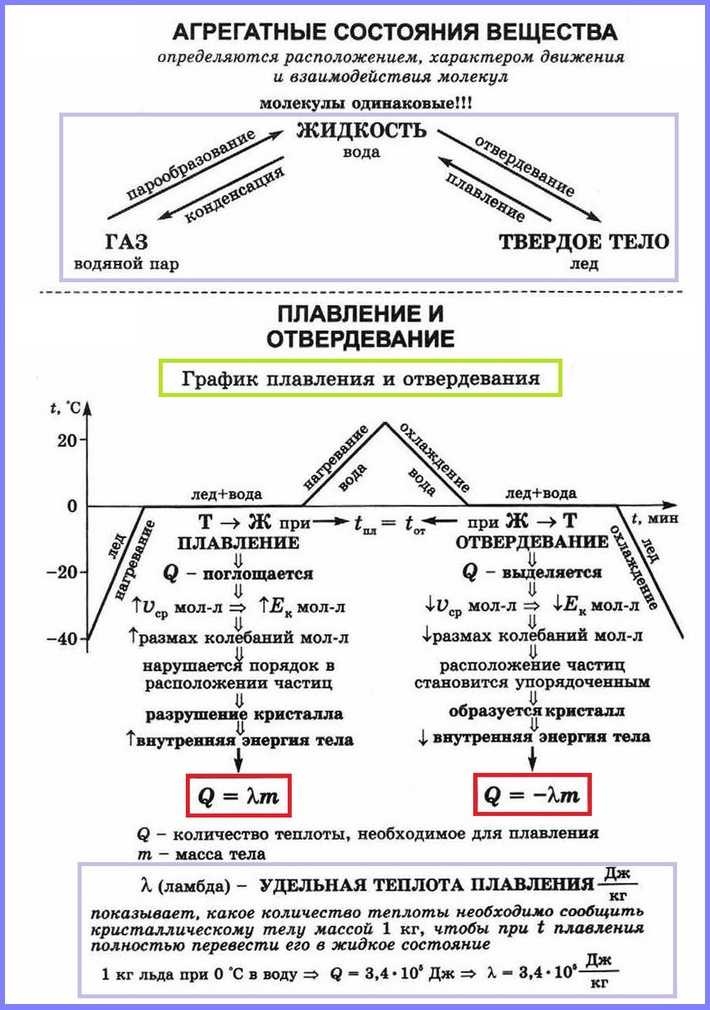
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления
Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.
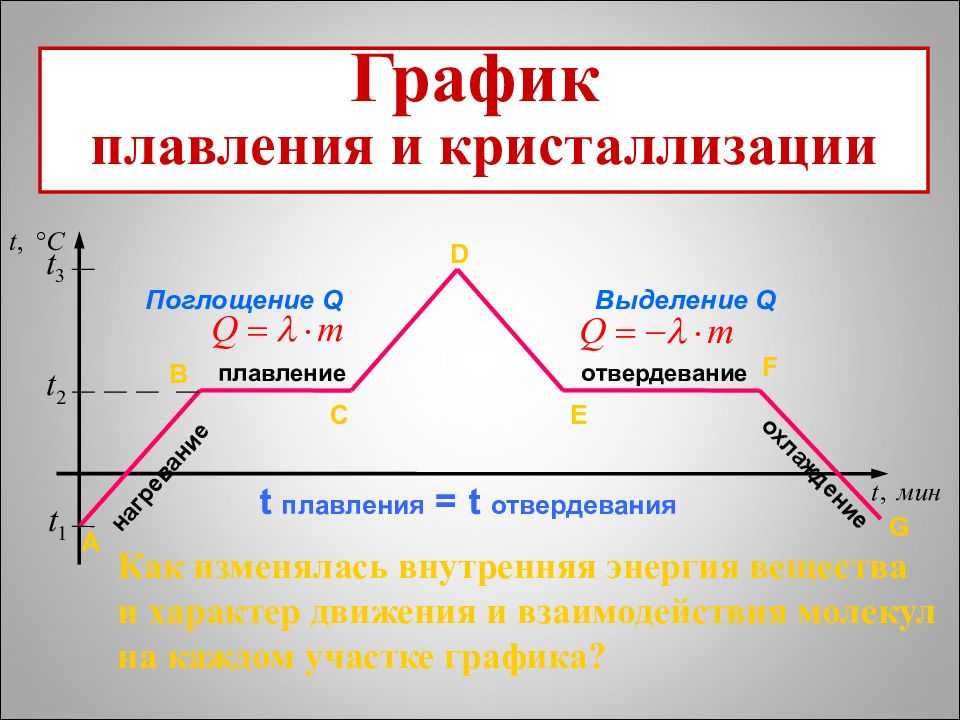
На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.
Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».
Плотность
Уникальные свойства молекулы воды позволяют ей трансформироваться в разные агрегатные состояния: жидкое, твердое, газообразное. Молекула льда, как и жидкой воды, имеет один и тот же состав.
Плотность льда (р-0,917 г/см3), жидкой воды (р-0,9982 г/см3)
Рассмотрим различия в строении молекулы на изображении № 4.

В кристалле льда между молекулами воды остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы воды. Поэтому он имеет наименьшую плотность.
Таким образом, образующийся зимой ледяной покров не тонет, а плавает на поверхности воды, так как его плотность меньше плотности жидкой воды.
Иначе все водоемы зимой наполнились бы льдом, и в них не могли бы существовать живые организмы. Большинство других веществ увеличивают свою плотность при замерзании.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
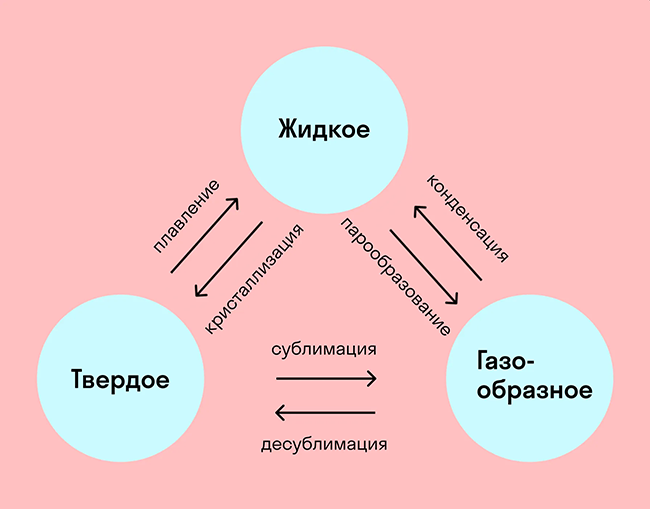
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
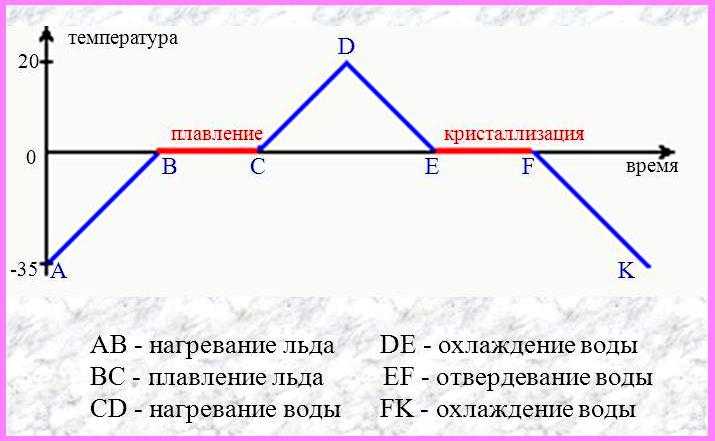
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
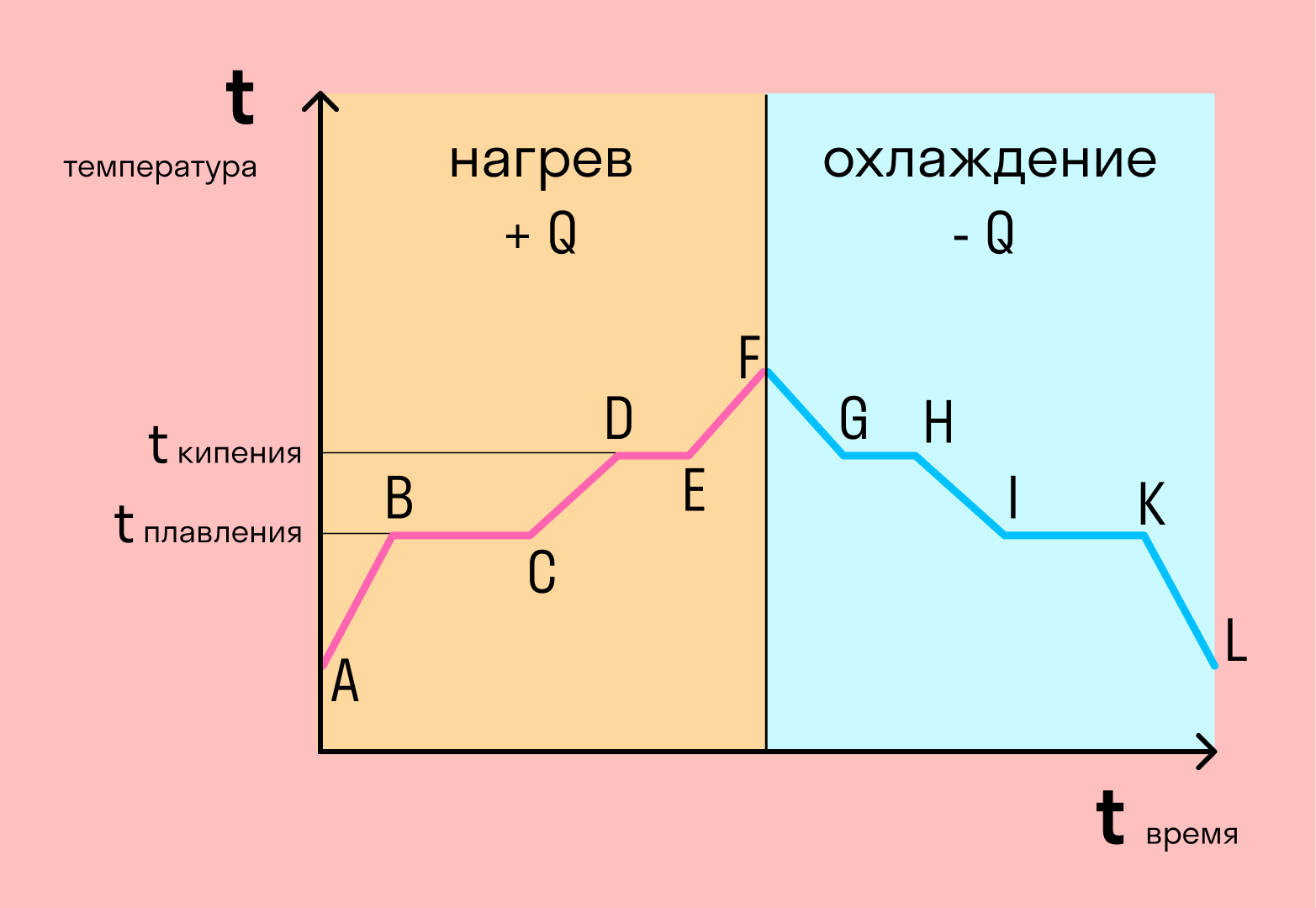
Разбираемся по шагам.
AB — нагревание льда
Сначала взяли лед, конечно, при отрицательной температуре,
потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
BC — плавление льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
CD — нагревание воды
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
EF — нагревание пара
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
FG — охлаждение пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
GH — конденсация пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
HI — охлаждение воды
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
IK — кристаллизация воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
KL — охлаждение льда
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
|
Нагревание Q = cm(tконечная − tначальная) Охлаждение Q = cm(tначальная − tконечная) Q — количество теплоты c — удельная теплоемкость вещества [Дж/кг · ˚C] m — масса tконечная — конечная температура tначальная — начальная температура |
|
Плавление Q = λm Кристаллизация Q = −λm Q — количество теплоты λ — удельная теплота плавления вещества [Дж/кг] m — масса |
|
Парообразование Q = Lm Конденсация Q = −Lm Q — количество теплоты L — удельная теплота парообразования вещества [Дж/кг] m — масса |
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Температура плавления
Как было сказано выше, плавление происходит при определенной температуре, которая называется точкой плавления. От чего зависит эта физическая величина? Во-первых, от энергии связи частиц, составляющих твердое тело, чем эта энергия больше, тем больше температура плавления. Например, тугоплавкий металл ниобий плавится при температуре 2742 К, а энергия связи на атом у этого металла равна 7,6 эВ, другой тугоплавкий металл вольфрам, имеет энергию связи 8,9 эВ и плавится при значительно большей температуре 3695 К.
Во-вторых, точка плавления определяется внешними условиями. В частности, при увеличении давления она также возрастает.
В-третьих, на эту величину для данного вещества сильно влияют примеси. Как правило, примеси приводят к понижению точки плавления.
Теплота плавления
Теперь перейдем от определения плавления к формуле, которая количественно описывает этот процесс. Когда происходит плавление, то внешний подвод тепла расходуется на разрыв связей в твердом теле и его перевод в жидкое состояние. Энергия, которую необходимо затратить, чтобы определенное количество твердого вещества, находящегося при температуре плавления, перешло в жидкое состояние называется теплотой плавления. Формула в этом случае записывается так: λ=Q/m, где Q — количество теплоты, m — масса тела.
Значение теплоты плавления λ зависит от физико-химических свойств материала. Например, для льда это значение составляет 333,55 Дж/г или 6,02 кДж/моль, а для железа 13,81 кДж/моль. Значения приведены при давлении 1 атмосфера.
Теплота плавления
Теперь перейдем от определения плавления к формуле, которая количественно описывает этот процесс. Когда происходит плавление, то внешний подвод тепла расходуется на разрыв связей в твердом теле и его перевод в жидкое состояние. Энергия, которую необходимо затратить, чтобы определенное количество твердого вещества, находящегося при температуре плавления, перешло в жидкое состояние называется теплотой плавления. Формула в этом случае записывается так: λ=Q/m, где Q — количество теплоты, m — масса тела.
Значение теплоты плавления λ зависит от физико-химических свойств материала. Например, для льда это значение составляет 333,55 Дж/г или 6,02 кДж/моль, а для железа 13,81 кДж/моль. Значения приведены при давлении 1 атмосфера.
Температура плавления
Платина, как отдельные элемент, имеет температуру плавления 1774 градуса. Но этот показатель может меняться в зависимости от содержания лигатур в сплаве. Например:
- сплав платины с иридием 850/900/950 пробы — 1800-1820/1780-1800/1780-1790 градусов;
- сплав платины с палладием 850/900/950 пробы — 1730-1750/1740-1755/1755-1765 градусов;
- сплав с кобальтом 950 пробы — 1765-1780 градусов;
- сплав платины с рутением 950 пробы — 1780-1795 градусов.
Температура плавления платины и другие ее физические характеристики позволяют использовать металл при производстве вискозного волокна. Из сплава изготавливают специальные высокопрочные формы, через которые продавливают пластичный материал.
Температуру плавления драгметалла необходимо учитывать при введении в его состав лигатурных компонентов в процессе формирования ювелирных материалов.