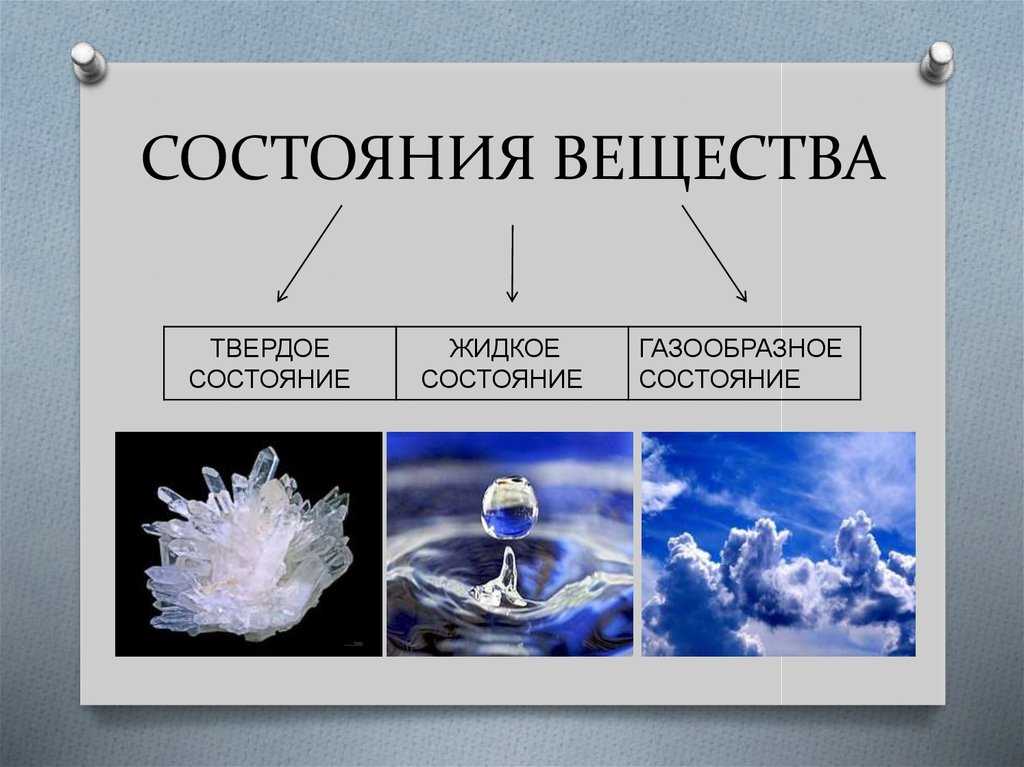
Жидкое агрегатное состояние
К жидкостям относят тела, изменить форму которых очень легко, чего нельзя сказать про их объем.
Например, налив воду из графина в стакан, жидкость примет форму сосуда, но её объем останется прежним (рисунок 4).
Рисунок 4. Изменение формы жидкого вещества
Наполним шприц водой, закроем пальцем отверстие и попробуем сжать воду. У нас ничего не получится. Жидкость практически несжимаема. Это такое агрегатное состояние, в котором тело способно сохранять свой объем, но не сохраняет форму.
Молекулы жидкости находятся довольно близко (расстояние между каждыми двумя молекулами меньше размеров молекул) и их взаимодействие ощутимое. Молекулярное строение жидкости представлено на рисунке 5.
Рисунок 5. Молекулярное строение жидкого вещества (воды)
Также на свойстве жидкости легко изменять свою форму основано изготовление предметов из расплавленного стекла (рисунок 6).
Рисунок 6. Выдувание из расплавленного (жидкого) стекла
В состоянии невесомости жидкость имеет форму шара, потому что внешние силы уравновешены и форма определяется только силами молекулярного взаимодействия. У последних нет единого направления, поэтому форма жидкости симметрична в любых направлениях.
{"questions":[{"content":"Какую форму принимает жидкость в <b>состоянии невесомости</b>?`choice-26`","widgets":{"choice-26":{"type":"choice","options":,"explanations":,"answer":}}}]}
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее. Эти перескоки происходят периодически. Временной отрезок между такими перескоками получил название среднее время оседлой жизни
(или среднее время релаксации
) и обозначается буквой?. Иными словами, время релаксации – это время колебаний около одного определённого положения равновесия. При комнатной температуре это время составляет в среднем 10 -11 с. Время одного колебания составляет 10 -12 …10 -13 с.
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть
. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Происхождение сил упругости
Зависимость сил
взаимодействия молекул от расстояния
между ними объясняет появление силы
упругости при сжатии и растяжении тел.
Если пытаться сблизить молекулы на
расстояние, меньшее г0, то начинает
действовать сила, препятствующая
сближению. Наоборот, при удалении молекул
друг от друга действует сила притяжения,
возвращающая молекулы в исходные
положения после прекращения внешнего
воздействия.
При малом смещении
молекул из положений равновесия силы
притяжения или отталкивания растут
линейно с увеличением смещения. На малом
участке кривую можно считать отрезком
прямой (утолщенный участок кривой на
рис. 2.10). Именно поэтому при малых
деформациях оказывается справедливым
закон Гука, согласно которому сила
упругости пропорциональна деформации.
При больших смещениях молекул закон
Гука уже несправедлив.
Так как при
деформации тела изменяются расстояния
между всеми молекулами, то на долю
соседних слоев молекул приходится
незначительная часть общей деформации.
Поэтому закон Гука выполняется при
деформациях, в миллионы раз превышающих
размеры молекул.
История
Вопрос о том, как расположены частицы в твердых телах, занимает умы ученых еще с семнадцатого века. Все началось с того, что были выведены несколько эмпирических законов, описывающих влияние на твердые тела температуры, механической энергии, световых и электромагнитных волн и т. д. К ним относятся:
- закон Ома;
- закон Гука;
- закон Дюлонга;
- закон Франца и другие.
В девятнадцатом веке сформулирована теория упругости, в которой впервые твердые тела рассматриваются как сплошная среда. Представление о кристаллической структуре тел сформулировано Огюстом Браве. Он, в свою очередь, вдохновлялся работами Гаюи, Ньютона, Бернулли и Коши.
Строение и свойства твердых веществ
Большинство известных веществ как природного, так и искусственного происхождения при обычных условиях находятся в твердом состоянии. Из всех известных на сегодня соединений около 95% относятся к твердым веществам, которые приобрели важное значение, поскольку является основой не только конструкционных, но и функциональных материалов
- Конструкционные материалы — это твердые вещества или их композиции, которые используются для изготовления орудий труда, предметов быта, и различных других конструкций.
- Функциональные материалы — это твердые вещества, использование которых обусловлено наличием в них тех или иных полезных свойств.
Например, сталь, алюминий, бетон, керамика принадлежат к конструкционным материалам, а полупроводники, люминофоры — к функциональным.
В твердом состоянии расстояния между частицами вещества маленькие и имеют по величине такой же порядок, что и сами частицы. Энергии взаимодействия между ними достаточно велики, что предотвращает свободное движение частиц — они могут только колебаться относительно определенных равновесных положений, например, вокруг узлов кристаллической решетки. Неспособность частиц к свободному перемещению приводит к одной из самых характерных особенностей твердых веществ — наличие собственной формы и объема. Способность к сжатию у твердых веществ очень незначительна, а плотность высокая и мало зависит от изменения температуры. Все процессы, происходящие в твердом веществе, происходят медленно. Законы стехиометрии для твердых веществ имеют другой и, как правило, более широкий смысл, чем для газообразных и жидких веществ.
Подробное описание твердых веществ слишком объемно для этого материала и поэтому рассматривается в отдельных статьях: Аморфное и кристаллическое состояние вещества, Кристаллическая решетка, Дефекты кристаллической решетки, Основы зонной теории и Типы твердых тел.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
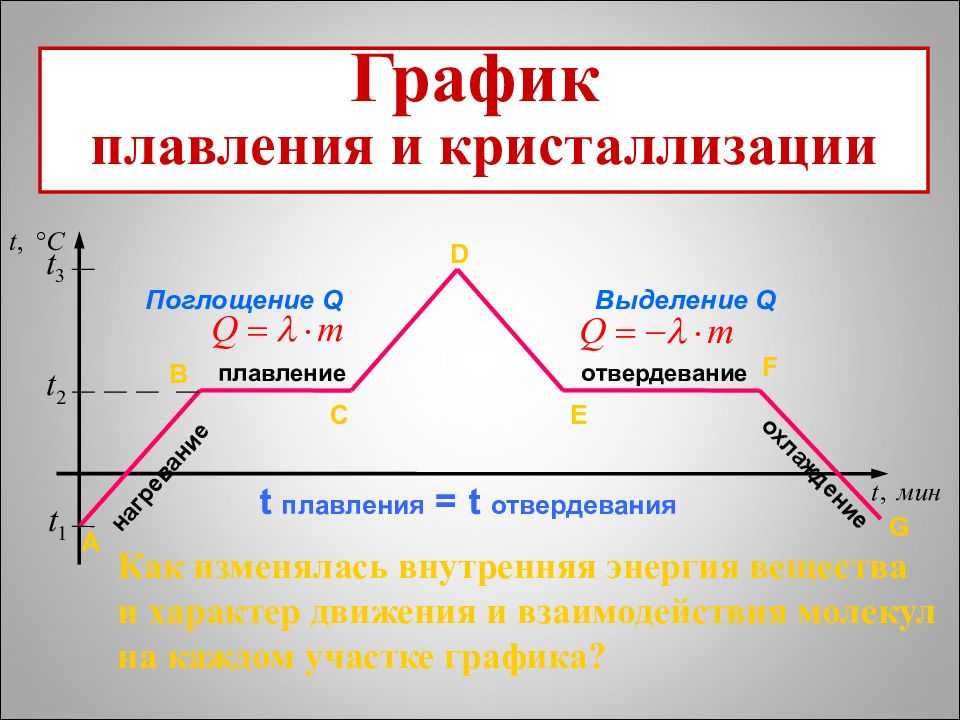
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам.
AB — нагревание льда
Сначала взяли лед, конечно, при отрицательной температуре,
потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
BC — плавление льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
CD — нагревание воды
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
EF — нагревание пара
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
FG — охлаждение пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
GH — конденсация пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
HI — охлаждение воды
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
IK — кристаллизация воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
KL — охлаждение льда
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
|
Нагревание Q = cm(tконечная − tначальная) Охлаждение Q = cm(tначальная − tконечная) Q — количество теплоты c — удельная теплоемкость вещества [Дж/кг · ˚C] m — масса tконечная — конечная температура tначальная — начальная температура |
|
Плавление Q = λm Кристаллизация Q = −λm Q — количество теплоты λ — удельная теплота плавления вещества [Дж/кг] m — масса |
|
Парообразование Q = Lm Конденсация Q = −Lm Q — количество теплоты L — удельная теплота парообразования вещества [Дж/кг] m — масса |
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Взаимодействие между атомами и молекулами вещества. Строение твердых, жидких и газообразных тел
Между молекулами вещества действуют одновременно силы притяжения и силы отталкивания. Эти силы в большой степени зависят от расстояний между молекулами.
Согласно экспериментальным и теоретическим исследованиям межмолекулярные силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами:
где для сил притяжения n = 7, а для сил отталкивания .
Взаимодействие двух молекул можно описать при помощи графика зависимости проекции равнодействующей сил притяжения и отталкивания молекул от расстояния r между их центрами. Направим ось r от молекулы 1, центр которой совпадает с началом координат, к находящемуся от него на расстоянии центру молекулы 2 (рис. 1).
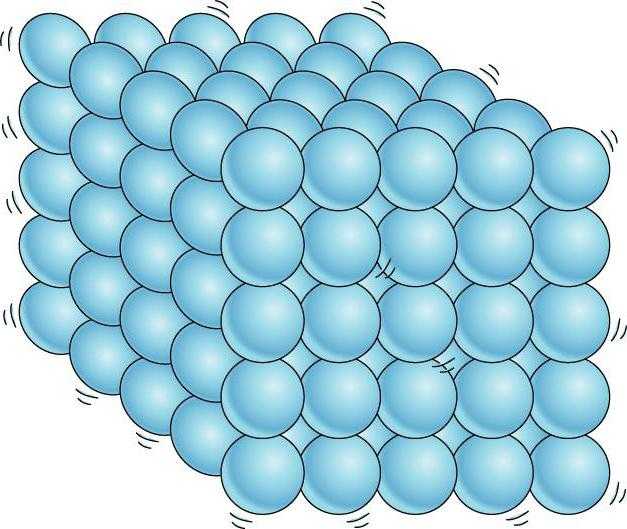
Твердое агрегатное состояние
В твердых веществах за счет сильного взаимного притяжения у частиц нет возможности развивать необходимую кинетическую энергию и тем самым передвигаться свободно от заданной позиции при условии сохранения текущей температуры и давления. Частицы твердых веществ располагаются тесно друг от друга и образуют определенную структуру, которую называют кристаллической решеткой.
В твердом веществе молекулы плотно «упакованы». Как правило они образуют регулярную структуру, называемую кристаллической решеткой.
Эталонным примером регулярной кристаллической решетки является кристалл.
Описание
Для того чтобы понять, как расположены частицы в твердых телах, необходимо иметь представление об агрегатных состояниях веществ. Они могут находиться в кристаллическом и аморфном состоянии.
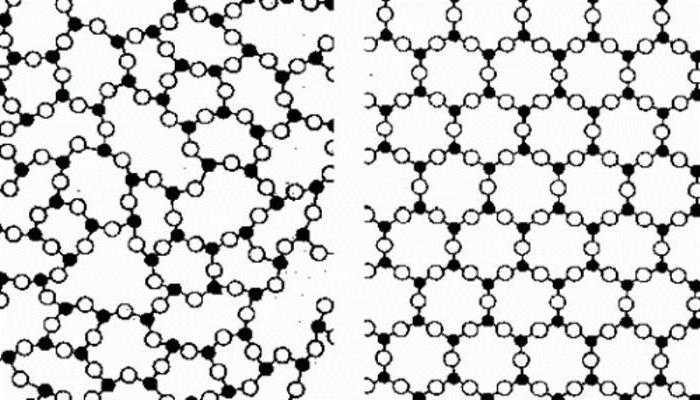
Для кристаллов характерно равномерное распределение атомов, которое достигается благодаря равновесию между молекулами и упорядочиванию их в решетку. В естественном виде кристаллы представляют собой многогранники.
Аморфные твердые тела представляют собой группу произвольно расположенных молекул, прочно соединенных между собой. Кристаллическая решетка в таких телах отсутствует, но на маленьких расстояниях частицы все равно сохраняют некоторую упорядоченность. В качестве примера можно назвать стеклообразное состояние. В теории каждое аморфное тело должно перейти в кристаллическую форму, но на это требуется бесконечно большое количество времени. С другой стороны, такое тело можно назвать жидкостью, имеющей большую вязкость.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре −20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь. Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит, что его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40–50%.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Атомно-силовой микроскоп
На действии сил
отталкивания между атомами и молекулами
на малых расстояниях основано устройство
атомно-силового микроскопа (АСМ). Этот
микроскоп в отличие от туннельного
позволяет получать изображения не
проводящих электрический ток поверхностей.
Вместо вольфрамового острия в АСМ
используют маленький осколок алмаза,
заостренный до атомных размеров. Этот
осколок закрепляется на тонком
металлическом держателе. При сближении
острия с исследуемой поверхностью
электронные облака атомов алмаза и
поверхности начинают перекрываться и
возникают силы отталкивания. Эти силы
отклоняют кончик алмазного острия.
Отклонение регистрируется с помощью
лазерного луча, отражающегося от
зеркальца, закрепленного на держателе.
Отраженный луч приводит в действие
пьезоэлектрический манипулятор,
аналогичный манипулятору туннельного
микроскопа. Механизм обратной связи
обеспечивает такую высоту алмазной
иглы над поверхностью, чтобы изгиб
пластины держателя оставался неизменным.
На рисунке 2.11 вы
видите изображение полимерных цепей
аминокислоты аланина, полученное с
помощью АСМ. Каждый бугорок представляет
собой одну молекулу аминокислоты.

В настоящее время
сконструированы атомные микроскопы,
устройство которых основано на действии
молекулярные сил притяжения на
расстояниях, в несколько раз превышающих
размеры атома. Эти силы примерно в 1000
раз меньше сил отталкивания в АСМ.
Поэтому применяется более сложная
чувствительная система для регистрации
сил.
Атомы и молекулы
состоят из электрически заряженных
частиц. Благодаря действию электрических
сил на малых расстояниях молекулы
притягиваются, но начинают отталкиваться,
когда электронные оболочки атомов
перекрываются.
Газообразное состояние
При нормальных условиях (273 К, 101325 Па) в газообразном состоянии могут находиться как простые вещества, молекулы которых состоят из одного атома (Не, Ne, Ar) или из нескольких несложных атомов (Н2, N2, O2), так и сложные вещества с малой молярной массой (СН4 , HCl, C2H6).
Поскольку кинетическая энергия частиц газа превышает их потенциальную энергию, то молекулы в газообразном состоянии непрерывно хаотически двигаются. Благодаря большим расстояниям между частицами силы межмолекулярного взаимодействия в газах настолько незначительны, что их не хватает для привлечения частиц друг к другу и удержания их вместе. Именно по этой причине газы не имеют собственной формы и характеризуются малой плотностью и высокой способностью к сжатию и к расширению. Поэтому газ постоянно давит на стенки сосуда, в котором он находится, одинаково во всех направлениях.
Для изучения взаимосвязи между важнейшими параметрами газа (давление Р, температура Т, количество вещества n, молярная масса М, масса m) используется простейшая модель газообразного состояния вещества — идеальный газ, которая базируется на следующих допущениях:
- взаимодействием между частицами газа можно пренебречь;
- сами частицы являются материальными точками, которые не имеют собственного размера.
Наиболее общим уравнением, описывающим модель идеального газа, считается уравнения Менделеева-Клапейрона для одного моля вещества:
Однако поведение реального газа отличается, как правило, от идеального. Это объясняется, во-первых, тем, что между молекулами реального газа все же действуют незначительные силы взаимного притяжения, которые в определенной степени сжимают газ. С учетом этого общее давление газа возрастает на величину a/V2, которая учитывает дополнительное внутреннее давление, обусловленное взаимным притяжением молекул. В результате общее давление газа выражается суммой Р+ а/V2. Во-вторых, молекулы реального газа имеют хоть и малый, но вполне определенный объем b , поэтому действительный объем всего газа в пространстве составляет V — b. При подстановке рассмотренных значений в уравнение Менделеева-Клапейрона получаем уравнение состояния реального газа , которое называется уравнением Ван-дер-Ваальса:
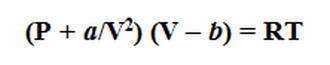
где а и b — эмпирические коэффициенты, которые определяются на практике для каждого реального газа. Установлено, что коэффициент a имеет большую величину для газов, которые легко сжижаются (например, СО2 , NH3 ), а коэффициент b — наоборот, тем выше по величине, чем больше размеры имеют молекулы газа (например, газообразные углеводороды).
Уравнение Ван-дер-Ваальса гораздо точнее описывает поведение реального газа, чем уравнения Менделеева-Клапейрона, которое тем не менее, благодаря наглядному физическому смыслу широко используется в практических расчетах. Хотя идеальное состояние газа является предельным, мнимым случаем, однако простота законов, которые ему отвечают, возможность их применения для описания свойств многих газов в условиях низких давлений и высоких температур делает модель идеального газа очень удобной.
Взаимодействие молекул
Все тела состоят из движущихся молекул. Между ними есть промежутки. Встает вопрос: почему тела не рассыпаются на молекулы или мелкие крошки? Наоборот, ломая деревянную палку, надо сильно потрудиться.

Молекулы крепко удерживаются вместе. А если попытаться соединить две части сломанной палки, она целой не станет. Значит, между молекулами есть постоянная связь (взаимодействие).
Тела не распадаются на отдельные частички, благодаря притяжению молекул и атомов. С другой стороны, если бы существовало только межмолекулярное притяжение, то не было бы среди молекул промежутков, а они есть. Значит, должно быть и отталкивание. Но оно начинает проявляться при условии, когда молекулы сближаются на расстояния, меньшие размеров самих молекул. Чем ближе сдвигаются молекулы, тем сильнее они отталкиваются.
В случае со сломанной палкой края обломков разрушились, и человек не может просто так, одними руками, соединить их так близко, чтобы молекулы начали взаимодействовать. Поэтому результат опыта будет нулевым.
А теперь другой эксперимент. Нужно разъединить два стеклянных листа, лежащих друг на друге.

Сделать это не просто. Почему? Нетрудно догадаться. Молекулы обоих листов достаточно близки, так как листы очень гладкие. Наступает взаимодействие (притяжение молекул).
Влажный бумажный лист гораздо труднее поднять, чем сухой с полированной крышки стола. В жидкости молекулы легче сдвинуть на расстояния, когда начинает возникать притяжение. Если две отдельные капельки воды соединить, то они сольются в одну.
Наблюдается взаимное притяжение жидкости к твердому телу. Оно называется смачиванием. Например, вода смачивает многие ткани, дерево, бумагу, но к пластилину, воску, жирным поверхностям не притягивается. Этот процесс называется несмачиванием. Смачивание и несмачивание встречается в быту, технике, живой и неживой природе.
В каких случаях будет наблюдаться смачивание, а в каких несмачивание?


Итак:
- Между молекулами действует взаимное притяжение и отталкивание
- Величина притяжения и отталкивания определяется расстоянием между молекулами
- Взаимодействовать друг с другом могут молекулы и атомы различных веществ
Газообразное агрегатное состояние
Большинство газов бесцветны и прозрачны, а потому невидимы. Его присутствие мы можем почувствовать при дуновении ветра, сквозняка в комнате или же на примере простых опытов (рисунок 7).
Рисунок 7. Иллюстрация опыта, подтверждающего наличие воздуха в окружающем нас пространстве
Опустим в воду воронку, предварительно соединив ее резиновой трубкой со стеклянной трубочкой. Из трубочки начнут выходить пузырьки воздуха, которые до этого были в воронке и во всей системе в целом. Подобные простые опыты подтверждают наличие воздуха вокруг нас.
Каково расположение молекул газа? Молекулы газа находятся на больших расстояниях друг от друга и в постоянном хаотичном движении. Поэтому часто взаимодействие между молекулами газа не учитывается, и большое пространство между частицами позволяет сильно сжимать газы. Молекулярное строение газа представлено на рисунке 8.
Рисунок 8. Молекулярное строение газа (паров воды)
{"questions":[{"content":"Сопоставьте свойства объема и формы в соответствии с <b>агрегатными состояниями</b>.`matcher-1`","widgets":{"matcher-1":{"type":"matcher","labels":,"items":}}}]}
Силы взаимодействия молекул
Молекулярные силы. Между молекулами вещества существуют силы взаимодействия, называемые Молекулярными силами. Если бы между молекулами не было сил притяжения, то все вещества при любых условиях находились бы только в газообразном состоянии.
Лишь благодаря силам притяжения молекулы удерживаются друг возле друга и образуют жидкие и твердые тела.
Однако одни только силы притяжения не могут обеспечить существование устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами действуют силы отталкивания.
- Строение
- атомов и молекул.
Атом, а тем более молекула, — это сложная система, состоящая из отдельных заряженных частиц — электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними на малых расстояниях действуют значительные электрические силы. Происходит взаимодействие между электронами и ядрами соседних молекул.
Описание движения частиц внутри атомов и молекул и сил взаимодействия между молекулами очень сложная задача. Ее рассматривают а атомной физике. Мы приведем только результат: примерную зависимость силы взаимодействия двух молекул от расстояния между ними.
Атомы и молекулы состоят из заряженных частиц противоположных знаков заряда. Между электронами одной молекулы и атомными ядрами другой действуют силы притяжения. Одновременно между электронами обеих молекул и между их ядрами действуют силы отталкивания. Вследствие электрической нейтральности атомов и молекул молекулярные силы являются короткодействующими.
На расстояниях, превышающих размеры молекул в несколько раз, силы взаимодействия между ними практически не сказываются.
Зависимость молекулярных сил от расстояния между молекулами. Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция силы взаимодействия между ними на прямую, соединяющую центры молекул. На расстояниях, превышающих 2-3 диаметра молекул, сила отталкивания практически равна нулю.
В результате на сравнительно больших расстояниях молекулы притягиваются, а на малых отталкиваются.
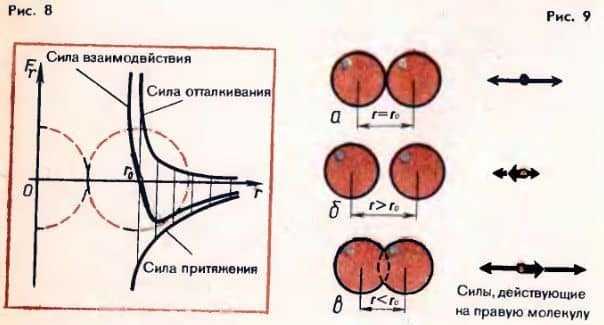
На расстоянии r0, равном примерно сумме радиусов молекул, проекция результирующей силы Fr = 0, так как сила притяжения равна по модулю силе отталкивания (рис. 9, а). При r > r0 сила притяжения превосходит силу отталкивания и проекция результирующей силы (жирная стрелка) отрицательна (рис 9, б). Если r → ∞, то Fr → 0. На расстояниях r
9, в).
Происхождение сил упругости. Зависимость сил взаимодействия молекул от расстояния между ними объясняет появление силы упругости при сжатии и растяжении тел.
Если пытаться сблизить молекулы на расстояние, меньшее r0, то начинает действовать сила, препятствующая сближению.
Наоборот, при удалении молекул друг от друга действует сила притяжения, возвращающая молекулы в исходное положение после прекращения внешнего воздействия.
При малом смешении молекул из положений равновесна сила притяжения или отталкивания растут линейно с увеличением смещения. На малом участке кривую можно считать отрезком прямой (утолщенный участок кривой на рис 8). Именно поэтому при малых деформациях оказывается справедливым закон Гука, согласно которому сила упругости пропорциональна деформации.
При больших смещениях молекул закон Гука уже несправедлив.
Так как при деформации тела изменяются расстояния между всеми молекулами, то на долю соседних слоев молекул приходится незначительная часть общей деформации. Поэтому закон Гука выполняется при деформациях в миллионы раз превышающих размеры молекул.
Влияние давления и различных примесей на кипение или плавление
Вторым фактором, влияющим на агрегатное состояние вещества это давление. Повышая давление сила прижатия одной частицы вещества к другой растет, и таким образом необходимо для перехода из одного состояния в другое приложить большую кинетическую энергию (температуру). Образуется следующая взаимосвязь: температура кипения и плавления растет при повышении давления.
Примеси в частицах вещества также влияют на фактическую температуру плавления или кипения за чтоб того, что они влияют на существующие силы притяжения между частицами. Одним из ярких примеров влияние примесей — рассыпанные кристаллы соли на льду, которые заставляют лед превращаться в жидкость при температуре окружающей среды ниже нуля.
Взаимное притяжение молекул
Твёрдые предметы способны сохранять свою цельность. Это происходит благодаря наличию притяжения между мельчайшими частицами вещества — молекулами.

В жидкостях эта связь гораздо слабее, поэтому они способны течь. Это связано с тем, что здесь расстояния между частицами увеличиваются. У газов они ещё больше. Здесь силы притяжения из-за больших расстояний фактически не действуют, позволяя веществу расширяться и заполнять весь доступный объём.
В наличии описанных сил легко убедиться, наблюдая физические явления реальной жизни.
Баланс различных сил, действующих между частицами, имеет важное значение в кристаллах.
Здесь их результатом является образование кристаллической решётки, которая имеет повторяющуюся структуру. При этом молекулы и атомы находятся в строго определённых местах.
Если разделить кусок свинца на две части и отполировать получившийся разрез до блеска, то можно наблюдать необычный эффект. Если обе части прислонить друг к другу, то они прилипнут без всяких видимых причин.
Если поднять одну часть, то другая поднимется вместе с ней. Такое соединение легко выдерживает вес до пяти килограммов. Физика объясняет, что в этом опыте демонстрируется притяжение, существующее между частицами.
Когда человек пытается разломать предмет, то он стремится преодолеть силы, которые притягивают частицы друг к другу. При этом видно, что одни предметы подвергаются воздействию легко, а строение других демонстрируют высокую прочность. Разница между ними состоит в том, что у них различная сила притяжения.
Классификация
В зависимости от того, как расположены частицы в твердых телах, зависят их физические и химические свойства. А на расположение атомов непосредственно влияет тип связи между частицами:
- ионная;
- ковалентная;
- металлическая;
- молекулярная;
- водородная.
Все твердые тела можно разделить на те, которые всегда проводят электричество, и индифферентные к нему. А также есть такие, которые проводят ток только при определенных условиях.
- Проводники. Электроны свободно движутся сквозь кристаллическую решетку, образуя ток. К ним относятся металлы.
- Полупроводники. Для того чтобы электрон продвигался между атомами вещества, требуется определенное количество энергии, поэтому ток сквозь такие материалы проходит с трудом.
- Диэлектрики. Для продвижения электрона необходимо большое количество свободной энергии, поэтому такие вещества непроницаемы для электрического тока, например резина или дерево.
Задания
Задание №1
Налейте в пластмассовую бутылку воды до верху и закройте крышкой. Попытайтесь сдать в ней воду. Затем вылейте воду, снова закройте бутылочку. Теперь попробуйте сжать воздух. Объясните результаты опыта.
Существенно сжать бутылку, наполненную водой, у нас не получится. Максимум, вы только помнете бутылку, но ее объем останется прежним. Связано это с тем, что в воде расстояние между молекулами небольшое, и она практически несжимаема.
Рисунок 9. Сжатие пустой бутылки
А вот когда мы выльем из бутылки воду, то сможем значительно деформировать бутылку и уменьшить ее объем. Почему? Теперь бутылку наполняет воздух. А его молекулы находятся на больших расстояниях друг от друга, поэтому нам было так легко сжать этот газ внутри бутылки.
Задание №2
На блюдце с холодной водой поставьте перевернутый очень теплый стакан. Через 15-20 минут проследите за уровнем воды в стакане и блюдце. Объясните результат опыта.
Через некоторое время вы увидите, что уровень воды в стакане поднялся. Он стал выше уровня воды в блюдце (рисунок 10).
Рисунок 10. Подъем уровня воды в стакане
После того, как мы поставили горячий стакан с таким же воздухом внутри на блюдце с холодной водой, между всеми этими телами начался теплообмен. Это означает, что вода начала нагреваться, а воздух в стакане, наоборот, начал охлаждаться.
А что происходит с телами при их охлаждении или нагревании? Они соответственно сжимаются или расширяются. Так, через 15 минут теплый воздух охладился и сжался, а вода, наоборот, расширилась и заняла место в стакане.
На самом деле, здесь большое значение имеет давление, которое оказывают те или иные тела, включая и воздух вокруг нас. Об этом понятии вы узнаете на следующих уроках.
Жидкое агрегатное состояние
Отличительным свойством жидкости является их текучесть, вследствие чего они способны менять свою форму. Жидкость, налитая в сосуд, моментально принимает его форму и под воздействием гравитационной силы Земли располагается на его дне. Граница верхней поверхности жидкости при этом образует гладкую плоскость. Кинетическая энергия движения молекул воды превосходит их взаимное притяжение, которое не способно в свою очередь удержать их не месте. Молекула воды словно перекатывается от одной к другой создавая видимую нашим глазом текучесть.
Молекулы жидкости могут свободно двигаться как и молекулы газ. Однако «упакованы» они плотнее, что больше похоже на твердое вещество.
Жидкость, в отличие от твердых тел, не имеет кристаллической решетки.
Взаимное отталкивание молекул
Связь между частицами ощущается только на очень маленьком расстоянии. Как только оно начинает значительно превосходить собственные размеры молекул, то сила притяжения резко уменьшается.
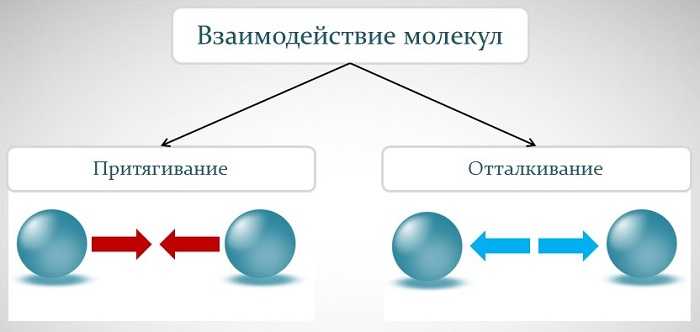
В связи с этим возникает вопрос о том, от чего возникает расстояние между ними. Если бы действовало только притяжение, то частицы находились бы вплотную друг к другу, не оставляя промежутков.
Дело в том, что существует также отталкивание. Молекулы устанавливаются на таком расстоянии, когда обе этих силы, направленные противоположно, уравновешиваются.
Можно провести опыт в классе и убедится в действии, которое производит отталкивание. Можно привести такой пример. Если смять резиновую игрушку и отпустить, то она начнёт расправляться до тех пор, пока не примет прежнее положение.
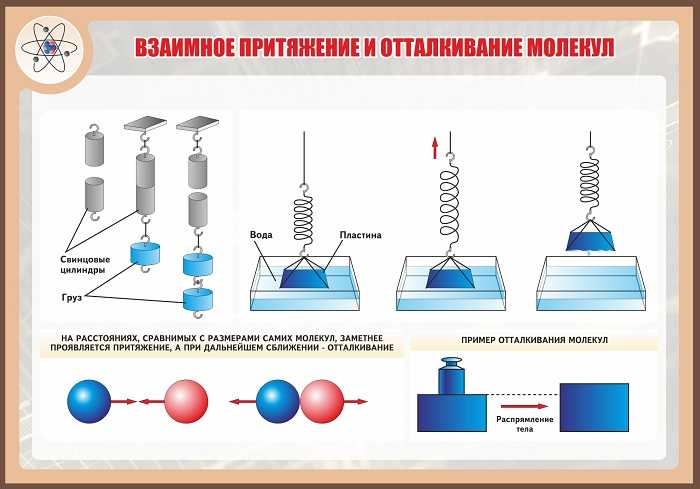
Если части сломанного предмета прислонить друг к другу, то притяжение не возникнет из-за того, что молекулы нельзя подвести на достаточно близкое расстояние, когда такая сила начинает действовать. Эту проблему обычно преодолевают двумя способами:
-
располагают между частями другие молекулы (например, клей);
-
может происходить диффузия, когда молекулы одного вещества проникают в другое;
-
нагревают их, увеличивая подвижность.
Притяжение может быть не только между предметами, состоящими из одного и того же вещества, но и между разными объектами и веществами. Например, если плоский кусок стекла разместить на поверхности воды, а потом поднять его. В этой ситуации заметно, что для этого придётся приложить определённую силу.

















![Как выглядит тепловое движение [1984 ландау л.д., китайгородский а.и. - физика для всех: молекулы]](http://mediaex.ru/wp-content/uploads/f/d/2/fd2e0815044f6be3fb6542a7e8cfdd8c.jpeg)