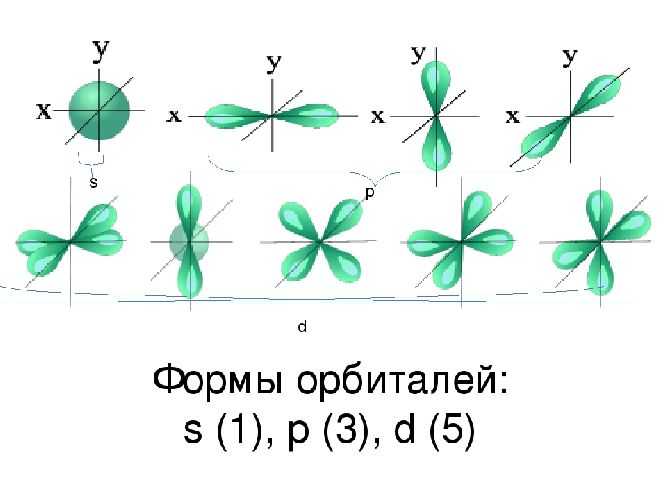
Получение бензола в промышленности
Из каменноугольной смолы: во время деструктивной перегонки угля (нагревание в отсутствие воздуха) он разлагается на газы и жидкости, наиболее важной из этих жидкостей является тяжелое черное вещество, известное как «каменноугольная смола». При фракционной перегонке каменноугольной смолы мы получить очень важное органическое соединение с экономической точки зрения, наиболее важным из которых является бензол (80-82 ° C)
Фракционная перегонка — это процесс, который используется для получения бензола из каменноугольной смолы.
Уголь (разрушительное distillatio н , нагрев при отсутствии воздуха) → каменноугольной смолы ( фракционной перегонки, 80-82 ° C) → Бензол
Из алифатических нефтепродуктов: из-за важности ароматического бензола в качестве исходного материала в химической промышленности его можно получить из алифатических нефтепродуктов двумя способами: каталитическим риформингом и полимеризацией этина. Из нормального гексана (каталитический риформинг): в этом методе нормальный гексан пропускается при высокой температуре на поверхность платины (pt) в качестве катализатора, этот метод называется методом каталитического риформинга
Каталитический риформинг — это процесс, который используется для преобразования нормального гексана. углеводород в ненасыщенный циклический углеводород
Из нормального гексана (каталитический риформинг): в этом методе нормальный гексан пропускается при высокой температуре на поверхность платины (pt) в качестве катализатора, этот метод называется методом каталитического риформинга. Каталитический риформинг — это процесс, который используется для преобразования нормального гексана. углеводород в ненасыщенный циклический углеводород.
С 6 Н 12 → С 6 Н 6 + 4Н 2
От полимеризации этина (ацетилена): пропуская пары этина в раскаленную докрасна никелевую трубку, ароматический бензол представляет собой соединение, получаемое в результате полимеризации этина путем пропускания паров этина в раскаленную докрасна никелевую трубку.
3C 2 H 2 (трубка из раскаленного никеля) → C 6 H 6
Из фенола: пропуская пары фенола на поверхность горячего цинкового порошка, который восстанавливает фенол до бензола.
С 6 Н 6 О + Zn → С 6 Н 6 + ZnO
Бензол — что это за органическое химическое соединение
В химии бензол относят к простейшим ароматическим углеводородам. Вещество является компонентом в составе бензина, нашло широкое применение в промышленной сфере, служит в качестве исходного сырья для выпуска лекарственных препаратов, пластмасс, синтетической резины, красящих материалов.
Несмотря на то что бензол содержится в сырой нефти, в промышленных масштабах проводят синтез данного соединения из других ее компонентов. Вещество обладает высокой степенью токсичности, является канцерогеном, контаминантом.
Первое описание смесей, содержащих бензол, было представлено немецким химиком Иоганном Глаубером в труде «Furni novi philosophici». Публикация вышла в 1651 году. В ее основе лежали результаты изучения перегонки каменноугольной смолы. Бензол был охарактеризован Майклом Фарадеем в качестве индивидуального вещества. Ученый выделил простейший ароматический углеводород в 1825 году из конденсата светильного газа, полученного в процессе коксования угля.
В 1833 году бензол был получен немецким физиком-химиком Эйльгардом Мичерлихом в результате сухой перегонки кальциевой соли бензойной кислоты. После данного эксперимента соединение получило название бензол. Спустя 27 лет ученые выяснили, что соотношение числа атомов углерода и атомов водорода в молекуле бензола идентично таковому у ацетилена. Была установлена общая эмпирическая формула бензола — CnHn.
Исследовал бензол и немецкий химик Фридрих Август Кекуле. В 1865 году ученый предложил циклическую структурную формулу соединения, а также сформулировал полное описание свойств бензола.
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.

Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
Читать также: Обзор лучших сварочных инверторов
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой
Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом

Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена во многом определены его формулой. То есть наличием атомов углерода и водорода связанных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов типа солей ртути, приводит к получению уксусного альдегида. Тройная связь атомов, содержащихся в молекуле ацетилена приводит к тому, что при сгорании она выделяет 14 000 ккал/куб. м. В процессе сгорания температура поднимается до 3000 °C.
Этот газ, при соблюдении определенных условий, может превращаться в бензол. Для этого необходимо разогреть его до 4000 °С и добавить графит.
Водород, содержащийся в молекулах показывает кислотные свойства. То есть они довольно легко отрываются от молекулы в виде протонов. Ацетилен в состоянии обесцвечивает воду содержащую бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В стандартных условиях ацетилен представляет собой бесцветный газ, который практически не растворяется в воде. Он начинает кипеть в -830 °С. При сжимании он начинает разлагаться с выделением большого количества энергии. Поэтому для его хранения применяют стальные баллоны способные хранить газ под высоким давлением.
Этот газ недопустимо выпускать в атмосферу. Его формула может отрицательно сказываться на окружающей среде.
Способы получения
В настоящее время применяется несколько методик получения бензола. Способы принципиально отличаются друг от друга:
- Коксование каменного угля. Данный метод был открыт первым и активно применялся для синтеза бензола до Второй мировой войны. В современной промышленности этим способом получают менее 10% соединений. Полученное из каменноугольной смолы вещество характеризуется большой концентрацией тиофена, что является причиной его непригодности для многих технологических процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Данный метод наиболее распространен в США. В промышленности Западной Европы, России, Японии этим способом получают 40-60% от всего объема бензола. Сопутствующими продуктами реакции являются толуол и ксилолы. В дальнейшем толуол используют для получения бензола методом гидродеалкилирования или смеси бензола и ксилолов путем диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. Примерно 50% от общего количества бензола получают данным способом. Сопутствующими продуктами при химической реакции являются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
- Получение бензола методом Реппе. В процессе тримеризации ацетилен пропускают при температуре в 400C над активированным углем. Реакция характеризуется хорошим выходом бензола и других ароматических углеводородов: 3C2H2→C6H6.
Бензол транспортируют по железной дороге в специальных вагонах-цистернах. Большая часть вырабатываемого соединения идет на синтез других продуктов:
- примерно 50% вещества используют для производства этилбензола (алкилирование бензола этиленом);
- около 25% бензола перерабатывают в кумол (алкилирование бензола пропиленом);
- ориентировочно 10-5 % вещества гидрируют для получения циклогексана;
- около 10% от всего объема полученных соединений поступает на выпуск нитробензола;
- из 2-3% бензола синтезируют линейные алкилбензолы;
- приблизительно 1% вещества тратят на получение хлорбензола.
В некоторых случаях бензол используют в производстве других соединений. Из-за высокой токсичности вещество редко применяют как растворитель. Бензол является составным компонентом бензина.
Способы получения бензола и его гомологов
Основным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля.
Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя.
Для получения бензола и его гомологов можно использовать несколько реакций.
Дегидрирование циклогексана:
Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
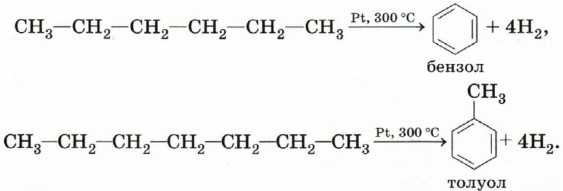
Тримеризация ацетилена:
Ввести углеводородный заместитель в ароматическое кольцо (провести алкилирование) можно также несколькими способами.
Синтез Вюрца—Фиттига. Это модификация уже известного нам способа получения алканов:
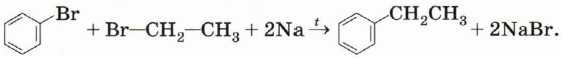
Алкилирование. Взаимодействие бензола и алкена в присутствии кислоты приведёт к образованию ароматического углеводорода:
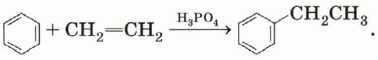
Другой способ — реакция бензола с галогенпроизводным в присутствии хлорида алюминия:
Применение бензола и его гомологов
Бензол применяется как растворитель и сырьё для получения многочисленных и очень важных ароматических соединений, которые используются для производства красителей (анилин), полимеров (стирол, фенол, анилин), лекарственных препаратов (рис. 32). Нитрованием толуола получают 2,4,6-тринитротолуол (тол, тротил) — мощное взрывчатое вещество.
При окислении толуола, как уже было показано выше, образуется бензойная кислота, которая также является полупродуктом для получения многих органических соединений, применяется как консервант (благодаря наличию большого количества бензойной кислоты долго не портятся некоторые ягоды — брусника, клюква).
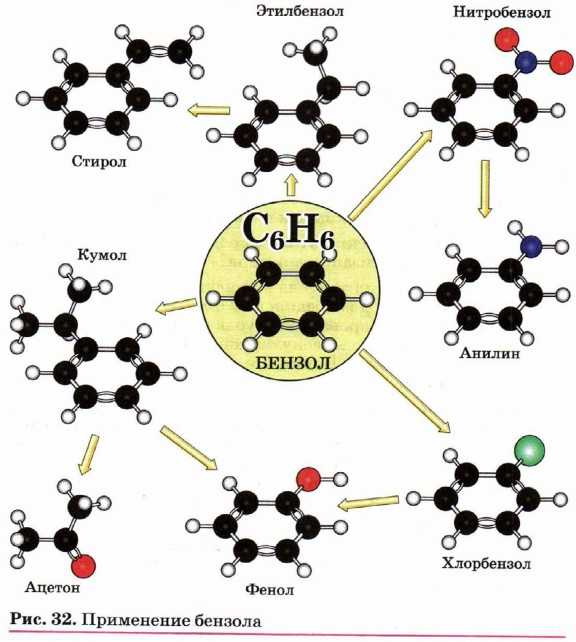
Продукт окисления 1,4-диметилбензола (пара-ксилола) — терефталевая кислота
применяется для получения полимерного материала полиэфирного волокна лавсана:

![]()
1. Напишите формулы возможных изомеров углеводорода состава С9Н12, относящихся к ароматическому ряду.
2. Какие ароматические углеводороды могут образоваться при дегидроциклизации н-октана?
3. При хлорировании толуола в присутствии хлорида железа (III) получено два соединения с молекулярной формулой С7Н7Сl. Хлорирование толуола на свету приводит также к соединению с молекулярной формулой С7Н7Сl. Что это за соединения? Напишите уравнения соответствующих реакций.
4. Соединение А состава С7Н8 нитруется азотной кислотой в присутствии серной кислоты с образованием смеси соединений Б и В, имеющих общую формулу C7H7NO2. Окисление соединения А перманганатом калия в кислой среде приводит к соединению Г формулы С7Н6O2. Назовите соединения А, Б, В и Г, напишите уравнения соответствующих реакций.
5. Сколько граммов бензола прореагировало с бромом в присутствии бромида железа (III), если выделилось 224 мл бромоводорода (н. у.)?
Ответ: 0,78 г С6Н6.
6. Сколько литров водорода (н. у.) могут присоединить в присутствии катализатора 100 г смеси, состоящей из 25% бензола, 15% толуола, 25% гексена и 35% гексана?
Ответ: 61,2 л Н2.
7. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот выход мононитропроизводного составил 70%. Сколько граммов продукта получено?
Ответ: 17,22 г C6H5NO2.
8. Углеводород состава С9Н8 обесцвечивает бромную воду, при окислении образует бензойную кислоту, с аммиачным раствором оксида серебра даёт осадок. Установите строение углеводорода, приведите уравнения соответствующих реакций.
9. Напишите уравнения реакций, с помощью которых можно получить стирол, используя только неорганические соединения.
10. Напишите уравнения реакций, при помощи которых можно осуществить указанные превращения. Укажите вещества X и Y и условия проведения синтезов:
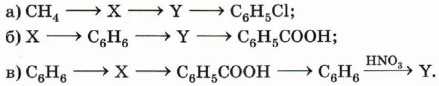
11. Какие два вещества вступили в реакцию и в каких условиях, если в результате образовались следующие продукты:
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
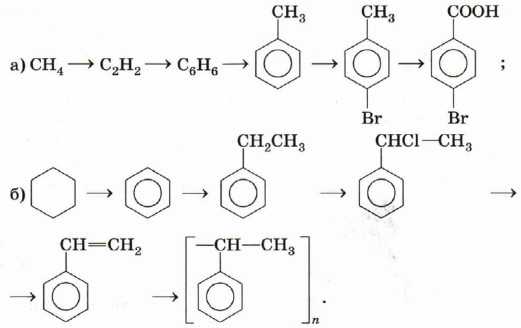
При необходимости укажите условия проведения реакций.
13
Найдите в сети Интернет видеозапись реакции горения бензола, обратите внимание на характер горения вещества. На горение какого из веществ — метана, этилена или ацетилена — наиболее похоже пламя бензола? Почему? Выдвиньте гипотезу и попытайтесь её обосновать
Примечания[ | ]
- ↑ 12Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics (англ.) //J. Chem. Educ. — American Chemical Society, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- ↑ 1234(Роспотребнадзор). № 275 // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2021. — С. 23. — 170 с. — (Санитарные правила).
- ↑ 123 https://www.cdc.gov/niosh/npg/npgd0049.html
- Furni novi philosophici, sive Descriptio artis distillatoriæ novæ per Joannem Rudolphum Glauberum. Amsterodam, 1651 // OpenLibrary.org
- Серия «100 великих», Дмитрий Самин, 100 великих научных открытий, Основы мироздания, Бензол
- Helmut Fiege, P.J. Garratt, Christ. J. Grundmann, Gundermann, Wolfgang Loeser, Peter Müller, Heidi Müller-Dolezal, Peter L. Pauson, Renate Stoltz, Hanna Söll, M. Zander Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes , Издание четвёртое, Georg Thieme Verlag, 2014, ISBN 3131799749, 9783131799746
- Reppe, W.; Schweckendiek, W. Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen (нем.) // Justus Liebig’s Annalen der Chemie (нем.)русск. : magazin. — 1948. — Bd. 560. — S. 104. — doi:10.1002/jlac.19485600104.
- Самойлова, Н. Российские химики полностью расшифровали механизм реакции получения бензола из ацетилена : / Наталия Самойлова // Элементы. — 2021. — 9 апреля.
- Kasper, Dennis L.et al. (2004)Harrison’s Principles of Internal Medicine , 16th ed., McGraw-Hill Professional, p. 618, ISBN 0071402357.
- Smith, Martyn T. Advances in understanding benzene health effects and susceptibility (англ.) // Ann Rev Pub Health : journal. — 2010. — Vol. 31. — P. 133—148. — doi:10.1146/annurev.publhealth.012809.103646.
- Розенцвит Г. Э. Клиника профессиональных нейротоксикозов. Л,, 1964, 18 с.
- Кушелев В. П., Орлов Г. Г., Сорокин Ю. Г. Охрана труда в нефтеперерабатывающей и нефтехимической промышленности. — М.: Химия, 1983. — С. 42. — 472 с.
- F. Nowell Jones. An Olfactometer Permitting Stimulus Specification in Molar Terms (англ.) //University of Illinois Press https://www.jstor.org/stable/1418083 The American Journal of Psychology. — Champaign, Illinois (USA), 1954. — March (vol. 67 (iss. 1). — P. 147—151. — ISSN 0002-9556. — doi:10.2307/1418083.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Химические свойства
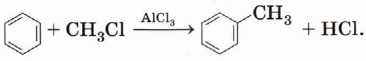
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол
-
- C6H6+H2C=CH2→AlCl3∗HClC6H5CH2CH3{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}C=CH_{2}{\xrightarrow{AlCl_{3}*HCl}}C_{6}H_{5}CH_{2}CH_{3}}}}
-
- C6H6+CH2=CH−CH3→AlCl3∗HClC6H5CH(CH3)2{\displaystyle {\mathsf {C_{6}H_{6}+CH_{2}=CH-CH_{3}{\xrightarrow{AlCl_{3}*HCl}}C_{6}H_{5}CH(CH_{3})_{2}}}}
Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
-
- C6H6+Cl2→FeCl3C6H5Cl+HCl{\displaystyle {\mathsf {C_{6}H_{6}+Cl_{2}{\xrightarrow{FeCl_{3}}}C_{6}H_{5}Cl+HCl}}}
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
-
- C6H6+3Cl2→T,hνC6H6Cl6{\displaystyle {\mathsf {C_{6}H_{6}+3Cl_{2}{\xrightarrow{T,h\nu }}C_{6}H_{6}Cl_{6}}}}
При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
-
- C6H6+6Br2→H2SO4∗SO3C6Br6+6HBr{\displaystyle {\mathsf {C_{6}H_{6}+6Br_{2}{\xrightarrow{H_{2}SO_{4}*SO_{3}}}C_{6}Br_{6}+6HBr}}}
Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
-
- C6H6+(CH3CO)2O→AlCl3C6H5COCH3+CH3COOH{\displaystyle {\mathsf {C_{6}H_{6}+(CH_{3}CO)_{2}O{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COCH_{3}+CH_{3}COOH}}}
-
- C6H6+C6H5COCl→AlCl3C6H5COC6H5+HCl{\displaystyle {\mathsf {C_{6}H_{6}+C_{6}H_{5}COCl{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COC_{6}H_{5}+HCl}}}
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С.
В третьей реакции образуется бензофенон (дифенилкетон).
Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
-
- C6H6+CO+HCl→AlCl3C6H5COH+HCl{\displaystyle {\mathsf {C_{6}H_{6}+CO+HCl{\xrightarrow{AlCl_{3}}}C_{6}H_{5}COH+HCl}}}
Реакции сульфирования и нитрования (электрофильное замещение):
-
- C6H6+HNO3→H2SO4C6H5NO2+H2O{\displaystyle {\mathsf {C_{6}H_{6}+HNO_{3}{\xrightarrow{H_{2}SO_{4}}}C_{6}H_{5}NO_{2}+H_{2}O}}}
-
- C6H6+H2SO4→C6H5SO3H+H2O{\displaystyle {\mathsf {C_{6}H_{6}+H_{2}SO_{4}\rightarrow C_{6}H_{5}SO_{3}H+H_{2}O}}}
Восстановление бензола водородом (каталитическое гидрирование):
-
- C6H6+3H2→NiPd,Pt;tC6H12{\displaystyle {\mathsf {C_{6}H_{6}+3H_{2}{\xrightarrow{Ni/Pd,Pt;t}}C_{6}H_{12}}}}
Реакции окисления
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем (содержит до 92% углерода в молекуле):
-
- 2C6H6+15O2→12CO2↑+6H2O{\displaystyle {\mathsf {2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}\uparrow +6H_{2}O}}}
Получение
В лаборатории
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
Читать также: Как вытащить болт без шляпки
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья – метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы .
Получение пиролизом
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000-3000°С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600°С. Расход электроэнергии составляет около 13000 кВт*ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50%.
Иное название – Вульф-процесс. Сначала разогревают насадку печи путем сжигания метана при 1350-1400°С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным как считалось на стадии проектирования.
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600°С. Выход ацетилена составляет 30-32%. Метод имеет преимущества – непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000°С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600°С. Образуется ацетилен. Метод характеризуется большей безопасностью и надежностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрен в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000-7000 кВт*ч) и высоких выходах ацетилена (87% в аргоновой плазме и 73% в водородной).
Карбидный метод
Этот способ известен с 19 века, но не потерял своего значения и до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500-3000°С:
Известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9%. Основным недостатком процесса является высокий расход электроэнергии: 10000-11000 кВт*ч на 1 тонну ацетилена.
Бензол как наркотик
Это вещество не относится к наркотическим средствам, так как не имеет совместимости с опиоидными рецепторами нервной системы человека. А также бензол не является прекурсором, так как нет таких химических реакций, посредством которых он может превратиться в вещество, способное воздействовать на опиатные рецепторы.
Тем не менее при вдыхании паров бензола у человека может возникать острое токсическое опьянение, сопровождающееся зрительными и слуховыми галлюцинациями, эйфорией. В наркологии это состояние носит название токсикомании, обусловленной вдыханием испарений летучих органических жидкостей. Как и при других видах наркомании, в этом случае существует опасность передозировки с возможностью летального исхода, а также возникновение физической и психической зависимости.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
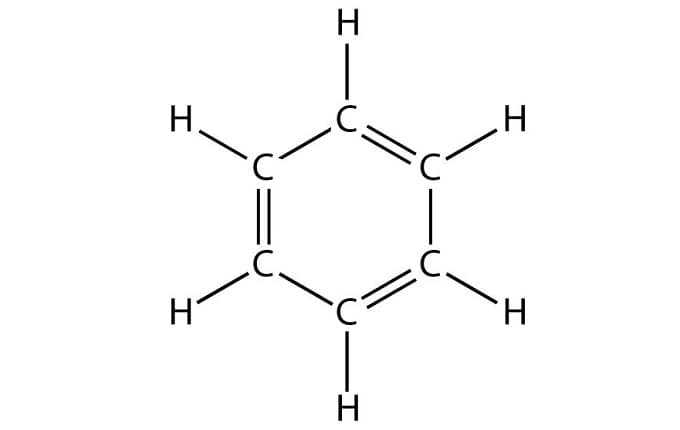
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
Данный углеводород имеет следующие физические свойства:
-
вещество представляет собой жидкость, имеющую не совсем приятный запах;
-
температура плавления бензола составляет 5,50C;
-
температура кипения — 800C;
-
общая плотность вещества — 0,879 г/см3;
-
молярная масса 78,1 г/моль;
-
без проблем реагирует с органическими растворителями;
-
при попадании воздуха образует взрывоопасное соединение;
-
в процессе горения на свету видны следы копчения;
-
растворим в воде, нагретой до 250C.
Биологическое действие и токсикология
Бензол — один из наиболее распространенных ксенобиотиков антропогенного происхождения. Вещество является сильно ядовитым. Минимальная летальная доза при пероральном приеме равна 15 мл, в среднем данный показатель соответствует 50-70 мл. Если вдыхать пары бензола непродолжительное время, то немедленного отравления не произойдет. Большая концентрация данного соединения приводит к тошноте, головокружению, может стать причиной смерти. В распространенных случаях на первых этапах отравление бензолом проявляется в виде эйфории.
Пары вещества способны проникать через неповрежденную кожу. Бензол в жидком виде вызывает сильное кожное раздражение. Если человек подвергался воздействию соединения в малых дозах, но в течение продолжительного времени, вред для здоровья может быть серьезным. Бензол представляет собой канцероген сильного действия. Согласно исследованиям контакт с веществом может быть связан с развитием таких заболеваний, как:
- апластическая анемия;
- острые лейкозы (миелоидный, лимфобластный);
- хронический миелоидный лейкоз;
- миелодиспластический синдром;
- заболевания костного мозга.
Трансформация бензола в человеческом организме может протекать разными способами. В первом случае наблюдается гидроксилирование молекулы бензола микросомальной системой окисления при участии цитохрома P450. Исходя из механизма реакции, бензол окисляется сначала до высокореакционного эпоксида, который далее преобразуется в фенол. При этом генерируются свободные радикалы (активные формы кислорода) по причине высокой активации Р450 по реакции.
Биотрансформация бензола, механизм I. Цифрами обозначены: 1 бензол, 2 бензолоксид, 3 эпоксибензол, 4 фенол, 5 пирокатехин, 6 гидрохинон.
Бензол представляет собой промутаген. Вещество приобретает мутагенные свойства по итогам биотрансформации. При этом формируются соединения с высокой реакционной способностью, например, эпоксид бензола. По причине высокого углового напряжения эпоксидного цикла связи -С-О-С- разрываются. Молекула становится электрофилом, который легко взаимодействует с нуклеофильными центрами азотистых оснований молекул нуклеиновых кислот, в особенности ДНК.
Химическое соединение обладает одурманивающим действием. Бензол может развивать у человека наркотическую зависимость. В случае острых отравлений веществом пострадавший быстро теряет сознание и может умереть за несколько минут. Оправившись после тяжелого отравления бензолом, люди могут столкнуться с такими патологиями, как:
- плевриты;
- катары верхних дыхательных путей;
- заболевания роговицы и сетчатки;
- поражения печени;
- сердечные расстройства.
Хроническое отравление бензолом проявляется в виде:
- головных болей;
- сильной утомляемости;
- одышки;
- головокружения;
- слабости;
- нервозности;
- сонливости или бессонницы;
- расстройства пищеварения;
- тошноты, рвоты;
- отсутствия аппетита;
- учащенного мочеиспускания;
- кровотечений из слизистой оболочки рта и носа.
- повышение сухожильных рефлексов;
- двусторонний клонус;
- положительный симптом Бабинского;
- расстройство глубокой чувствительности;
- псевдотабетические расстройства с парестезиями, атаксией, параплегией и двигательными нарушениями.
Типичными при отравлении бензолом являются изменения крови, которые могут привести к апластической анемии. Следствия взаимодействия с веществом проявляются и прогрессируют в течение многих месяцев. Соединение представляет собой эффективный солюбилизатор биологических мембран. Бензол обладает способностью быстро растворять неполярные группы липидов, в том числе холестерина, который является составным компонентом мембран. Предельно допустимой считается концентрация бензола в 5 мгm3.
Применение
Перевозка бензола железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Значительную часть получаемого бензола используют для синтеза других продуктов:
- около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом);
- около 25 % бензола превращают в кумол (алкилирование бензола пропиленом);
- приблизительно 10—15 % бензола гидрируют в циклогексан;
- около 10 % бензола расходуют на производство нитробензола;
- 2—3 % бензола превращают в линейные алкилбензолы;
- приблизительно 1 % бензола используется для синтеза хлорбензола.
В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавлялиrude в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Бензол (C 6 H 6 )
Ароматический бензол отличается от бензола, используемого в автомобилях (бензин), который представляет собой смесь алифатических углеводородов (гептан и октан) и используется в качестве топлива. Хотя свойства и реакции бензола были изучены, определенной формулы бензола еще нет, что соответствует всем этим свойствам.
Определение структурной формулы бензола заняло несколько лет. Он вступает в реакцию путем добавления и замещения, длина связи между атомами углерода является промежуточной между длиной одинарной и двойной связи. много времени.
В 1931 году Кекуле предложил новую идею о связи между атомами углерода в молекуле бензола. Он сказал, что атомы углерода образуют кольцо, в котором происходит обмен одинарными и двойными связями, так что все связи между атомами углерода остаются одинаковыми по длине, образуя гексагональную правильную форму, в которой атомы углерода находятся под каждым углом.
Кекуле открыл гексагональную циклическую форму, в которой обмениваются одинарные и двойные связи. Кольцо указывает на то, что 6 электронов делокализованы на определенных атомах углерода, Арил-радикал (Ar) — это радикал, образующийся при удалении одного атома водорода из ароматического соединения (его символ является Ar). Когда мы удаляем атом водорода из бензола, образующийся радикал называется фенильным радикалом (C 6 H 5 -).