Почему кровь использовали в ритуалах
Еще в древности люди предполагали, что эта красная жидкость жизненно важна. Охотники видели, что вытекающая кровь раненого животного, уносила с собой жизненные силы и приводила к смерти. В сражениях человек также видел, что при потере крови неизбежно приходит смерть.
Жизнь и кровь тесно взаимосвязаны между собой — это правильное заключение вначале приводило к самым фантастическим предположениям о ее роли. Древние люди считали, что кровь несла с собой особую “жизненную силу”, которая проникала в организм с дыханием и оживляла его. С ней было связано множество мистических и религиозных обрядов и ритуалов.
- Древние люди, чтобы отвести от себя злых духов, задабривали их, принося кровь им в жертву.
- Ею окроплялась земля для получения богатого урожая, ею увлажняли зерно.
- Для продления жизни или укрепления сил пили кровь животных или (как скифские воины) пораженных в бою врагов.
- Питье красного вина считалось вкушением крови самого божества. Обряд вкушения вина при причастии у христиан и сейчас символ вкушения плоти и крови бога.
- Договора, братание, торжественные клятвы многие древние народы скрепляли между собой смешиванием крови друг друга из надрезов на коже.
Красный цвет в древности, а многие племена и сейчас наделяют магической силой. Если когда-то в Древнем Египте для ограждения от болезней и «порчи» натирали тело кровью, то позднее египтяне заменили этот обряд окраской тела в красный цвет.
Кислород всемогущий
По мнению людей религиозных, вездесущим, всемогущим и в то же время невидимым может быть только бог. В действительности же все эти три эпитета вполне можно отнести к химическому элементу с атомным номером 8 – кислороду. Если бы растения в процессе фотосинтеза не превращали воду и углекислый газ в органические соединения, и этот процесс не сопровождался высвобождением связанного кислорода, то, исчерпав довольно быстро запасы атмосферного кислорода, весь животный мир, включая человечество, вскоре задохнулся бы.
Кислород — вездесущ: из него в значительной степени состоят не только воздух, вода и земля, но и мы с вами, наши еда, питье, одежда; в подавляющем большинстве окружающих нас веществ есть кислород. Могущество кислорода проявляется уже в том, что мы им дышим, а ведь дыхание это синоним жизни. И еще кислород можно считать всемогущим потому, что могучая стихия огня, как правило, сильно зависит от нашего кандидата в вездесущие и всемогущие.
Что касается третьего эпитета — «невидимый», то здесь, вероятно, нет нужды в доказательствах. При обычных условиях элементарный кислород не только бесцветен и потому невидим, но и не воспринимаем, не ощутим никакими органами чувств. Правда, недостаток, а тем более отсутствие кислорода мы ощутили бы моментально…
Применение кислорода
Помимо того, что все живые существам в природе, за исключением немногих микроорганизмов, при дыхании потребляют кислород, он широко применяется во многих отраслях промышленности: металлургической, химической, машиностроении, авиации, ракетостроении и даже в медицине.

В химической промышленности его применяет:
- при получении ацетилена из природного газа (метана);
- при производстве кислот (азотной, серной);
- для газификации твердого топлива;
- для производства аммиака, формальдегида и метанола.
В металлургии его используют:
- при получении цветных металлов из руд;
- при выплавке чугуна в доменных печах;
- при выплавке стали в мартеновских и электрических печах;
- кислородно-конверторной выплавке стали.
В медицинских целях больным, у которых нарушена нормальная деятельность органов дыхания или кровообращения, искусственно увеличивают содержание O2 в воздухе или дают дышать непродолжительное время чистым O2. Медицинский кислород, выпускаемый ГОСТ 5583, особенно тщательно очищают от всех примесей.
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки. В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Элемент в окружающей среде
Земная кора состоит в основном из кремниево-кислородных минералов, и многие другие элементы присутствуют в виде их оксидов. Газообразный кислород составляет пятую часть атмосферы. О2 в атмосфере Земли образуется в результате фотосинтеза растений, он накапливался в течение длительного времени, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.

Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений. Вода, H2O и кремнезём, SiO2, основной компонент песка, являются одними из наиболее распространённых двойных кислородных соединений. Среди соединений, которые содержат более двух элементов, наиболее распространёнными являются силикаты, которые образуют большинство пород и почв. Другими соединениями, которые в изобилии встречаются в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (боксит) и различные оксиды железа, которые используются в качестве источника металла.
Элемент встречается во всех видах минералов. Некоторые общие примеры включают оксиды, карбонаты, нитраты, сульфаты и фосфаты. Оксиды — это химические соединения, которые содержат кислород и ещё один элемент. Карбонаты — это соединения, которые содержат кислород, углерод и ещё один элемент. В качестве примера можно привести карбонат натрия или соду, кальцинированную соду или солевую соду (Na2CO3), которая часто встречается в моющих и чистящих средствах.
Нитраты, сульфаты и фосфаты также содержат кислород. Другими элементами в этих соединениях являются азот, сера или фосфор плюс ещё один элемент. Примерами этих соединений являются нитрат калия или селитра (KNO3), сульфат магния или соли Эпсома (MgSO4) и фосфат кальция (Ca3 (PO 4)2).
«Окислительный» элемент
Кислород — бесцветный (в толстом слое — голубой) газ без вкуса и запаха. Он немного тяжелее воздуха и малорастворим в воде. При охлаждении до -183°С кислород превращается в подвижную жидкость голубого цвета, а при -219°С — замерзает.
Как и положено элементу, занимающему место в правом верхнем углу таблицы Менделеева, кислород — один из самых активных элементов-неметаллов и обладает ярко выраженными окислительными свойствами. Если можно так выразиться, окислительнее кислорода — только один элемент, фтор. Именно поэтому баки с жидким кислородом — необходимая принадлежность большинства жидкостных ракетных двигателей. Получено соединение кислорода даже с таким химически пассивным газом, как ксенон.
Для развития активной реакции кислорода с большинством простых и сложных веществ нужно нагревание — чтобы преодолеть потенциальный барьер, препятствующий химическому процессу. С помощью катализаторов, снижающих энергию активации, процессы могут идти и без подогрева, в частности, соединение кислорода с водородом.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива, включая порох, для горения которых не нужен кислород воздуха: в процессе горения таких веществ кислород выделяется из них самих.
Процессы медленного окисления различных веществ при обычной температуре имеют для жизни не меньшее значение, чем горение — для энергетики.
Медленное окисление веществ пищи в нашем организме — «энергетическая база» жизни. Заметим попутно, что наш организм не слишком экономно использует вдыхаемый кислород: в выдыхаемом воздухе кислорода примерно 16%. Тепло преющего сена — результат медленного окисления органических веществ растительного происхождения. Медленное окисление навоза и перегноя согревает парники.
Изотопы кислорода
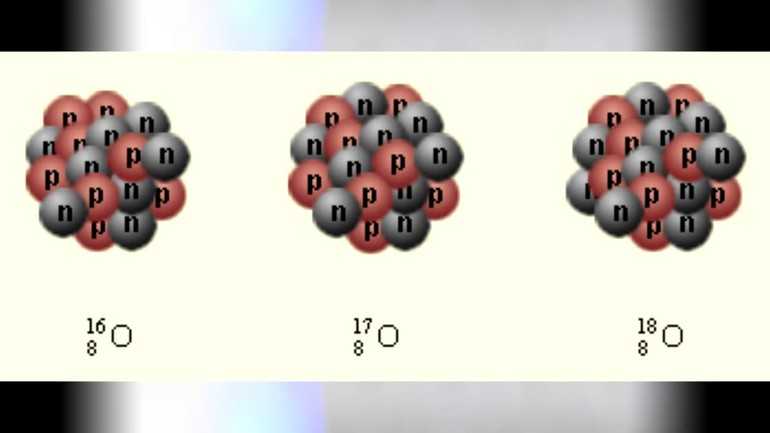
Есть три естественных изотопа О2: кислород-16, кислород-17 и кислород-18. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Известно также пять радиоактивных изотопов элемента. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
История открытия кислорода

Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природеКислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих архей 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3-2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворенным в океанах железом и формировал залежи джеспилита. 3-2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворенного и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад, содержание кислорода колебалось от 15% до 30% по объему. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35% по объему, который, возможно, способствовал большому размеру насекомых и земноводных в это время. Деятельность человека, в том числе при сжигании 7000000000 тонн ископаемого топлива ежегодно, очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Источник
История открытия
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Применение: «море энергии»
Кислород применяется в лечебной практике, причем не только при легочных и сердечных заболеваниях, когда затруднено дыхание. Подкожное введение кислорода оказалось эффективным средством лечения таких тяжелых заболеваний, как гангрена, тромбофлебит, слоновость, трофические язвы.
Не менее важен он и для промышленности. Обогащение воздуха кислородом делает эффективнее, быстрее, экономичнее многие технологические процессы, в основе которых — окисление. А на таких процессах пока держится почти вся тепловая энергетика. Превращение чугуна в сталь тоже невозможно без кислорода. Именно кислород «изымает» из чугуна избыток углерода. Одновременно улучшается и качество стали. Нужен кислород и в цветной металлургии. Жидкий кислород служит окислителем ракетного топлива.
При сжигании водорода в токе кислорода образуется весьма обыкновенное вещество — Н2O. Конечно, ради получения этого вещества не следовало бы заниматься сжиганием водорода (который, кстати, часто именно из воды получают). Цель этого процесса иная, она будет ясна, если ту же реакцию записать полностью, учитывая не только химические продукты, но и энергию, выделяющуюся в ходе реакции: Н2+0,5O2=H2O+68317 калорий.
Почти семьдесят больших калорий на грамм-молекулу! Так можно получить не только, «море воды», но и «море энергии». Для этого и получают воду в реактивных двигателях, работающих на водороде и кислороде.
Та же реакция используется для сварки и резки металлов. Правда, в этой области водород можно заменить ацетиленом. Кстати, ацетилен все в больших масштабах получают именно с помощью кислорода, в процессах термоокислительного крекинга: 6СН4 + 4O2 = С2Н2 + 8Н2 + ЗСО + СO2 + ЗН2O.
Это только один пример использования кислорода в химической промышленности. Кислород нужен для производства многих веществ (достаточно вспомнить об азотной кислоте), для газификации углей, нефти, мазута…
Любое пористое горючее вещество, например, опилки, будучи пропитанными голубоватой холодной жидкостью — жидким кислородом, становится взрывчатым веществом. Такие вещества называются оксиликвитами и в случае необходимости могут заменить динамит при разработке рудных месторождений.
Ежегодное мировое производство (и потребление) кислорода измеряется миллионами тонн. Не считая кислорода, которым мы дышим.
Медицинский кислород
Обычно мед. К. применяют в смеси с воздухом в концентрации 20—80% . Применяемая по специальным показаниям для ингаляции смесь К. (95%) с углекислым газом (5%) носит название карбоген.
Выпускают мед. К. в стальных цельнотянутых баллонах, окрашенных в синий цвет. Хранят в прохладном месте. Арматура, прокладки, трубопроводы, контактирующие со сжатым К., не должны иметь следов жиров и масел, т. к. быстрое окисление жиров и масел, протекающее экзотермически, может повести к возгоранию и взрыву. В аптеках К. отпускают в специальных кислородных подушках.
См. также Кислородная терапия, Кислородно-дыхательная аппаратура.
Библиография Жиронкин А. Г. Кислород, Физиологическое и токсическое действие, Л., 1972, библиогр.; Машковский М. Д. Лекарственные средства, ч. 2, с. 71, М., 1977; P e м и Г. Курс неорганической химии, пер. с нем., т. 1, М., 1972;Чугаев Л. А. Открытие кислорода и теория горения в связи с философскими учениями древнего мира, Пг., 1919; Matthews С. М. E. а. о. Radioactive gases, в кн.: Radioactive pharmaceuticals, ed. by A. Andrews a. o., p. 567, Oak Ridge, 1966, bibliogr.; Oxygen transport to tissue- II, ed. by J. Grote a. D. Reneau, N. Y., 1976.
В. П. Мишин; В. В. Бочкарев (рад.), В. В. Чурюканов (фарм.).
История открытия кислорода
Открытие кислорода приписывают Джозефу Пристли (Joseph Priestley). У него была лаборатория, оборудованная приборами для собирания газов. Он испытывал его физиологическое действие на себе и на мышах. Пристли установил, что после вдыхания газа некоторое время ощущается приятная легкость. Мыши в герметически закрытой банке с воздухом задыхаются быстрей, чем в банке с O2. Поскольку Пристли был приверженцем флогистонной теории он так и не узнал, что оказалось у него в руках. Он только описал этот газ, даже не догадываясь, что он описал. А вот лавры открытия кислорода принадлежат Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier), который и дал ему имя.
Лавуазье, поставил свой знаменитый опыт, продолжавшийся 12 дней. Он нагревал ртуть в реторте. При кипении образовывалась ее красная окись. Когда реторту охладили, оказалось, что воздуха в ней убыло почти на 1/6 его объема, а остаток ртути весил меньше, чем перед нагревом. Но когда разложили окись ртути сильным прокаливанием, все вернулось: и недостача ртути, и «исчезнувший» кислород.
Впоследствии Лавуазье установил, что этот газ входит в состав азотной, серной, фосфорной кислот. Он ошибочно полагал, что O2 обязательно входит в состав кислот, и поэтому назвал его «оксигениум», что значит «рождающий кислоты». Теперь хорошо известны кислоты, лишенные «оксигениума» (например: соляная, сероводородная, синильная и др.).
Что такое кровь? Состав и функции
Кровь — «жидкая ткань» – необходимая для организма, непрерывно циркулирующая в его сосудах.
Основная ее функция — поддержание обмена веществ и главное — снабжение кислородом всех клеток. Вместе с нервной системой она поддерживает взаимодействие между собой всех частей организма и таким образом участвует в формировании его целостности.
Крови в теле человека содержится около 8% от веса тела. У взрослых людей весом 60—70 кг крови 5—5,5 литра.
Кровь очень сложна по составу. Она содержит воду, белки, дыхательный пигмент, небелковые азотистые вещества, углеводы, жиры и продукты их превращения, а также газы: азот, кислород, углекислый газ.
При центрифугировании или отстаивании кровь (к которой предварительно прибавлены противосвертывающие вещества), разделяется на два слоя: на жидкую часть крови — плазму и массу клеток — «форменных» элементов. У здоровых людей плазма и форменные элементы соотносятся по объему как 55 к 45 процентам.
- В плазме 90% воды. В ней находятся растворенные минеральные соли и органические соединения — белки, сахар, жиры, а также продукты обмена веществ и гормоны. Именно плазмой переносятся питательные вещества по клеткам. Всасываясь из кишечника, они попадают сначала в печень, где подвергаются дальнейшей обработке, а затем доставляются с кровью всем тканям и органам тела.
- Белки, помимо питательного значения, выполняют большую роль в поддержании водносолевого равновесия (альбумин) и в защитных реакциях (гаммаглобулины — носители антител).
- Гормоны, вырабатываемые железами внутренней секреции, осуществляют связь между отдаленными частями организма и взаимодействие их между собой.
К клеточным элементам крови, которые можно увидеть только под микроскопом, относятся эритроциты, называемые красными кровяными тельцами, лейкоциты, называемые белыми кровяными тельцами, и кровяные пластинки, или тромбоциты.
В человеке около 5 литров крови, но через каждый участок тела кровеносными сосудами переносится до 200 000 литров крови и лимфы за сутки!
В организме насчитывается 25 триллионов изолированных друг от друга эритроцитов (что в 10 тысяч раз больше населения нашей планеты), имеющих поверхность около 3 тыс.кв.м (что в 1,5 тысячи раз превышает поверхность нашего тела), около 1,5 триллиона, тромбоцитов, 35 миллиардов лейкоцитов, 3 секстиллиона белковых мицелл с поверхностью в 2 тыс. кв.м.