Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
-
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
-
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
-
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
-
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.

Как строится молекула воды
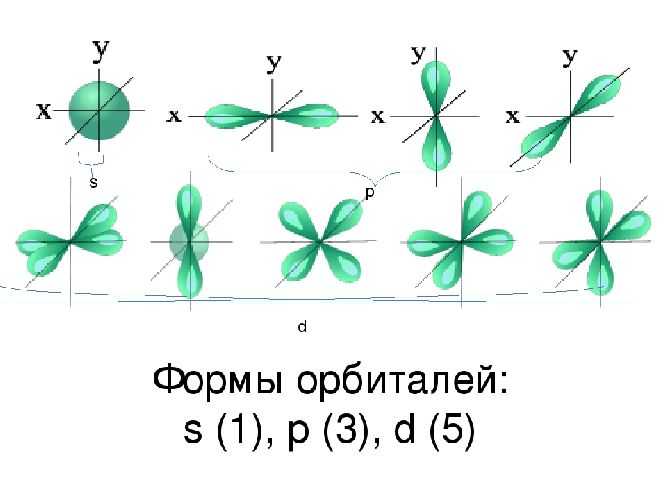
Вспомним, что вероятностное нахождение электрона по отношению к ядру определяется электронным облаком, т. е. совокупностью всех точек пространства, через которые может пробежать электрон. Это воображаемое облако называют орбиталью. Установлено: на одной орбитали не может находиться одновременно более двух электронов.
Единственный электрон атома водорода (1 s1) имеет орбиталь в виде сферы. Такая форма орбитали соответствует минимально возможному уровню энергии атома.
В атоме кислорода все гораздо сложнее. Атом кислорода имеет два слоя электронов. Внутренний (слой К.) укомплектован двумя s-электронами, вращающимися по сферической орбитали (условное обозначение этих электронов 1 s2, где 1 — номер слоя, s — энергетическое состояние — орбиталь, 2 — количество электронов на орбитали).
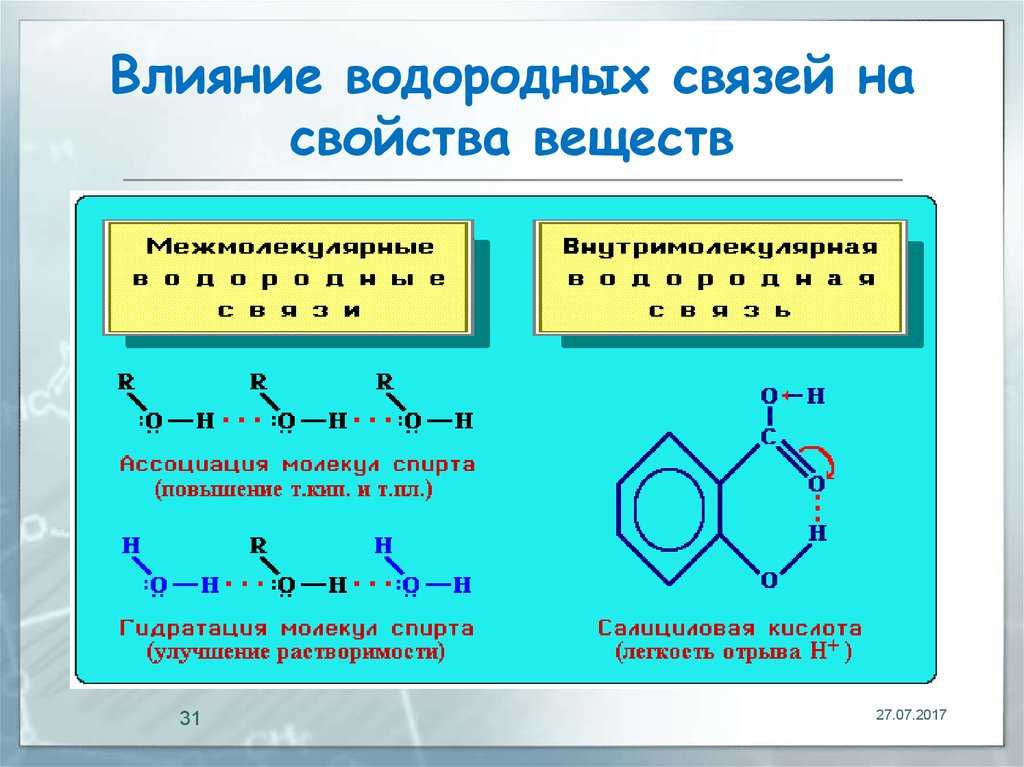
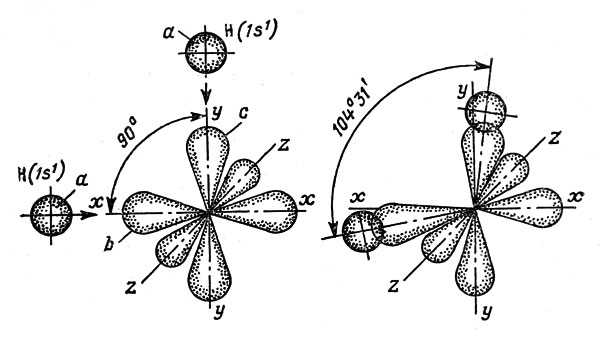 Рис. 10. Схема образования молекулы Н2О. Сферические электронные облака атомов водорода захватываются р-орбиталями вис атома кислорода. Получившие дополнительный отрицательный заряд орбитали вис отталкиваются на угол 104°31′
Рис. 10. Схема образования молекулы Н2О. Сферические электронные облака атомов водорода захватываются р-орбиталями вис атома кислорода. Получившие дополнительный отрицательный заряд орбитали вис отталкиваются на угол 104°31′
Внешний слой h имеет шесть электронов (их условное обозначение 2 s2p4, где 2 — номер слоя, s и р — орбитали, индексы 2 и 4 — соответственно количество электронов на орбиталях). В этом слое, как видно из условного обозначения, два s-электрона имеют одну и ту же сферическую орбиталь. Четыре р-электрона вынуждены расположиться на трех взаимно перпендикулярных орбиталях, имеющих в плане формы восьмерок. Восьмерки пересекаются в центре атома, как показано на рис. 10
Обратите внимание: 4 р-электрона на трех орбиталях. Здесь ключ к пониманию всех событий
Орбиталь, вытянутая вдоль оси г, служит пристанищем для двух электронов. Она укомплектована, и ворота ее на прочном запоре. На орбиталях же х и у по одному электрону и, значит, по одному изготовленному «капкану».
Итак, действующие лица охарактеризованы. Начинается действие.
Вот атом водорода оказался в опасной близости от атома кислорода, и единственный его электрон тотчас же будет захвачен непарной (недоукомплектованной) р-орбиталью. Поскольку у кислорода две непарные орбитали, он способен пленить два атома водорода. При атом сферическое облако водородного s-электрона належится на яйцеобразную ветвь р-орбитали (см. рис. 10).
Между атомами Н и О возникает связь, которая получила название ковалентной. Итогом этой связи и будет возведение весьма своеобразного архитектурного сооружения, известного как Н2О. Своеобразие же образовавшейся молекулы состоит в следующем.
Во-первых, перекрытие электронных облаков приведет к уплотнению области перекрытия и, значит, к росту отрицательного заряда в этой части пространства.
Расположись атомы водорода по обе стороны от ядра атома кислорода под углом 180°, и возникшие уплотнения зарядов никак не отразились бы на электрическом равновесии образовавшейся системы, т.е. центры положительных и отрицательных зарядов по-прежнему находились бы в одной точке — в центре атома кислорода. Но р-орбитали, захватившие водородные электроны, расположены под углом 90°, и поэтому уплотнения в них вызовут смещение центра тяжести отрицательного заряда относительно центра тяжести положительного заряда. Образовавшаяся молекула коды стала одновременно маленьким микромагнитом или, как принято говорить в молекулярной физике, диполе м, способным ориентироваться в магнитном поле.
Во-вторых, ветви р-орбиталей, получившие дополнительные отрицательные заряды, получат и дополнительную силу взаимного отталкивания. Они подальше отодвинутся друг от друга, и угол между ними вместо 90° станет 104°31. Увеличение угла еще более усугубит несимметричность распределения зарядов. В связи с этим дипольный момент молекулы достигнет такой величины, какой не имеют молекулы никаких других веществ на Земле.
И, наконец, в-третьих, сгущение сферического облака s-электрона водородного атома в месте наложения его на р-орбиталь атома кислорода приведет к разрежению этого облака с диаметрально противоположной стороны. Протон водорода, до того равномерно прикрытый сферическим электронным облаком, после «пленения» атомом кислорода окажется оголенным с внешней стороны. Однако ему представляется возможность «прикрыть свою наготу» за счет электронного облака соседней молекулы Н2О. И он сделает это, вцепившись в «одежду» (облако) чужого атома кислорода с силой, которая значительно превзойдет силу, удерживающую его собственный электрон. Эта сила связи с «чужим» атомом кислорода и будет представлять собой так называемую водородную связь.
§ 37. Закон полного тока
На рис. 80 показан проводник с током I, пронизывающий поверхность, ограниченную замкнутым контуром в виде окружности. Пусть центр окружности лежит на оси проводника. В пространстве, окружающем проводник с током, возникает магнитное поле. Так как отдельные точки контура находятся от проводника на равных расстояниях, то напряженность поля, созданная током в каждой точке контура, будет также одинаковой. Направление вектора напряженности поля H зависит от направления тока в проводнике и определяется по «правилу буравчика». Вектор H располагается по касательной к окружности контура.
Рис. 80. К закону полного тока
Путем опытов и расчетов установлено, что произведение напряженности поля H в точках контура на длину этого контура l равно току I, пронизывающему поверхность, ограниченную данным контуром.
Таким образом,
H ⋅ l = I.
В общем случае поверхность могут пронизывать несколько токов. Тогда определяют так называемый полный ток, т. е. находят алгебраическую сумму токов (∑I). Для этого случая можно записать:
H ⋅ l = ∑I.
Это выражение носит название закона полного тока. Закон полного тока является основным законом при расчете магнитных цепей и дает возможность в некоторых случаях легко определить напряженность поля.
Например, применив закон полного тока для определения напряженности магнитного поля в то на стоянии r от бесконечно длинного прямолинейного проводника с током (рис. 80), имеем следующее: полный ток равен току в проводнике ∑I = I; контур, проведенный на расстоянии r от проводника, совпадает с магнитной линией; длина контура l будет l = 2πr, поэтому H ⋅ 2πl = I, откуда H = I/2πr.
Переходя к магнитной индукции, будем иметь B = μaI/2πr, т. е. мы получили то же выражение для магнитной индукции, которое было приведено выше Для такого же случая. Применим закон полного тока для определения напряженности поля по оси катушки, равномерно намотанной на кольцо (рис. 81). Контуром здесь является ось катушки (она же ось кольца). Площадь контура пронизывает полный ток, равный произведению тока I на число витков ω катушки, т. е. ∑I = Iω. Обозначив длину оси катушки через l, запишем закон полного тока:
H ⋅ l = Iω,
откуда
H = Iω/l,
или, переходя к магнитной индукции, будем иметь
В = μаI⋅ω/l.
Рис. 81. К определению напряженности поля катушки, намотанной на кольцо
Если сечение кольцевой катушки обозначить S, то магнитный поток, проходящий внутри катушки, будет
Φ = B ⋅ S = μaI⋅ω/l S.
Разрезав кольцо и выпрямив катушку, мы получим соленоид. Для соленоида бесконечно большой длины формулы для напряжённости поля H по оси соленоида, магнитной индукции В и магнитного потока Φ те же, что и для кольцевой катушки. Однако на практике, имея дело с соленоидами ограниченной длины, для определения H, В и Φ пользуются теми же формулами.
Энергия — образование — водородная связь
Энергия образования водородной связи приблизительно на порядок выше, чем энергия обычного межмолекулярного взаимодействия, но при этом она все еще значительно ниже энергии химической связи.
Энергия образования водородной связи обычно не превышает 5 — 7 ккал / моль, в то время как средняя энергия ковалентнои связи колеблется в пределах 80 — 110 ккал / моль. Расстояние между двумя атомами кислорода в двух ассоциированных молекулах спирта ( или воды), равно 2 7 А среднее расстояние между молекулами неассоциированных веществ в жидком состоянии равно 3 4 А.
Энергия образования водородной связи обычно не превышает 20 — 30 кДж / моль, в то время как средняя энергия ковалентной связи колеблется в пределах 335 — 460 кДж / моль. Расстояние между двумя атомами кислорода в двух ассоциированных молекулах спирта ( или воды) равно 0 27 нм, среднее расстояние между молекулами неассоциированных веществ в жидком состоянии равно 0 34 нм.
Энергия образования водородной связи обычно не превышает 20 — 30 кДж / моль, в то время как средняя энергия ковалентной связи колеблется в пределах 330 — 460 кДж / моль. Расстояние между двумя атомами кислорода в двух ассоциированных молекулах спирта ( или воды) равно 0 27 нм, среднее расстояние между молекулами неассоциированных веществ в жидком состоянии равно 0 34 нм.
Энергия образования водородной связи приблизительно на порядок выше, чем энергия обычного межмолекулярного взаимодействия, но при этом она все еще значительно нише энергии химической связи.
Энергия образования водородной связи обычно не превышает 5 — 7 ккал / моль, в то время как средняя энергия ковалентной связи колеблется в пределах 80 — 110 ккал / моль. Расстояние между двумя атомами кислорода в двух ассоциированных молекулах спирта ( или воды), равно 2 7 А среднее расстояние между молекулами не-ассоциир Ованных веществ в жидком состоянии равно 3 4 А.
Увеличение константы диссоциации обусловливается боль-шеи энергией образования водородной связи в анионе салициловой кислоты, чем в неднссоциированной молекуле. Таким образом, водородная связь больше стабилизирует конечное состояние, чем исходное.
ИК-спектроскопия представляет богатый материал для изучения типа — и энергии образования водородных связей.
Последнее уравнение отличается от предыдущего наличием в числителе К ест Эта величина суммирует энергию образования водородной связи ( или связей) и энергию деформации связи протона с диссоциирующей молекулой, например деформацию ОН-связи в молекулах кислородных кислот.
Стрейтвизер отметил, что энергия взаимодействия карбанионов с катионом цезия в циклогексиламине сравнима с энергией образования водородной связи между карбанионом и протонными растворителями.
Поскольку растворение терпенофенолов происходит в гидро-ксилсодержащих растворителях как в условиях газо-жидкостной хроматографии, так и при диссоциации, то можно предположить, что существенный вклад в величины Д /, и А / 7 РЬОН вносит энергия образования водородных связей.
|
Зависимость формы хромато-графических пиков от вида изотерм адсорбции. Концентрация компонента. |
Могут быть определены термодинамические характеристики адсорбции и растворения, а именно: константы Генри, изменения внутренней энергии, энтропии и теплоемкости при адсорбции, энтальпии и энтропии при растворении; коэффициенты активности вещества в адсорбированном и растворенном состоянии; энергия образования водородной связи, получение изотерм адсорбции и растворения.
С помощью газохроматографических измерений при этом могут быть определены термодинамические характеристики адсорбции и растворения, а именно: константы Генри, изменение внутренней энергии, энтропии и даже теплоемкости при адсорбции, изменение энтальпии и энтропии при растворении, коэффиценты активности вещества в адсорбированном и растворенном состоянии, энергия образования водородной связи, получены изотермы адсорбции и растворения.
Поскольку растворение терпенофенолов происходит в гидро-ксилсодержащих растворителях как в условиях газо-жидкостной хроматографии, так и при диссоциации, то можно предположить, что существенный вклад в величины AF. AF РЮН вносит энергия образования водородных связей.
Процесс образования
Каков способ образования. Образуются водородные связи между электроотрицательными атомами, один из которых имеет свободную электронную пару.
Самым убедительным признаком в.с. является дистанция между атомом Н и вторым атомом. Все дело в том, что дистанция между атомами меньше, чем сумма двух атомарных радиусов. Не смотря на часто встречающуюся асимметрию (когда в , дистанция превышает расстояние ) все равно сумма радиусов атомов больше, чем расстояние между ними.
Да, асимметрия в в.с. встречается часто, однако существуют и симметричные конструкции, например HF. Угол между первым и вторым атомом в системе приближен к 180 градусам. Вспоминая фтороводороды HF, следует заметить, что соединение с фтором одно из самых крепких. HF представляет собой ион симметричного типа . В нем энергия водородных соединений составляет порядка 150 килоджоулей в одном моле. Ковалентная связь фтороводорода приблизительно такая же. В воде Н2О в.с. значительно меньше около 20 килоджоулей на моль.
Соединение частиц через водород найдено в большом количестве различных соединений. Химическая связь часто возникает между фтором, азотом и кислородом, так как последние являются самыми электроотрицательными элементами. Редко обнаруживается между хлором, серой и прочими элементами, не являющимися металлами.
Важно! Азот и кислород основа жизни, эти элементы содержатся в особо высокой концентрации в углеводах, белках и нуклеиновой кислоте. Если бы между этими веществами не было прочного контакта через атом Н, жизнь на Земле была бы невозможна
Межмолекулярная водородная связь разновидность образования крепкой структуры, связывающей через атом Н одну молекулу с другой. Ярким примером является муравьиная кислота. Она представляет собой молекулу, состоящую из двух или более простых молекул (димер).
Внутримолекулярная ВС разновидность, при которой атом Н является связующим звеном в рамках одной молекулы.
То же самое относится к фтороводороду, который находится в газообразном состоянии. Он содержит такие полимерные структуры, которые могут состоять из четырех простых молекул НF, объединенных друг с другом через водород.
Примеры водородной межмолекулярной конструкции искать не приходится: растворимость глюкозы, фруктозы, сахарозы в водном растворе объясняются именно при помощи водорода и его соединительным свойствам. Молекулярные структуры живых организмов (молекула ДНК, например) содержат миллионы сложных конструкций, связанных водородом.
Значение для органических соединений
Многие органические вещества не могут растворяться в воде. Но если это происходит, то процесс не обходится без активного участия H-связей. Кислород и азот, главные доноры протонов, часто играют роли акцепторов. Органические соединения, содержащие O и N, легко растворяются в воде: здесь кислород и азот выступают в качестве атомов-акцепторов, а атомом-донором является кислород из молекул воды. Возникающие H-связи перемещают органическое вещество в раствор, «растаскивая» его на молекулы.

Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород
Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.

Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.
Функция соединений
Насколько важна социальная роль данных связей. Рассмотрим несколько веществ, которые существуют благодаря водородному соединению. Мы будем сравнивать эти молекулы с водой. Чтобы наши размышления были честными, мы будем выбирать для сравнения исключительно неметаллы. Эти вещества называются халькогеноводородами.
Например, теллур. Водородное соединение H2Te кипит при температуре -2 градуса. Что касается, селена, то H2Se кипит при температуре -42 градуса, а серный халькогеноводород H2S кипит при -60 градусах. Поразительно то, что вода кипит при +100 градусах.
Внимание! Если бы не было в.с., а кислород не обладал настолько цепкими качествами, при существующем климате на Земле не существовало бы воды в жидком состоянии. Такая высокая температура кипения непосредственное следствие водородной связи
Сцепление атомов кислорода с водородом показано на следующем изображении.
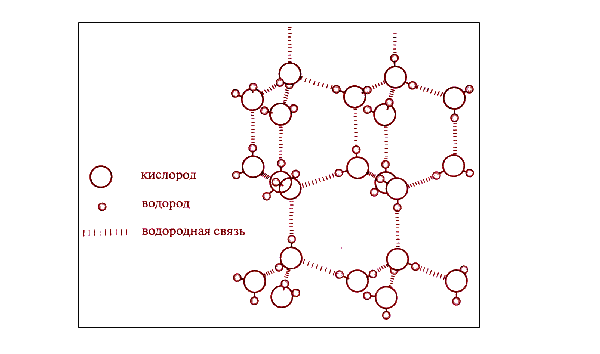 Водородная связь
Водородная связь
Но на этом удивительные свойства воды не заканчиваются. Следует также помнить о ее плавлении. И снова водородная связь именно из-за нее при плавлении плотность начинает расти. При таянии льда, каждое десятое водородное соединение разрушается, из-за чего молекулы воды приближаются друг к другу.
Типы и свойства водородной связи.
Водородная связь. Самоподготовка к ЕГЭ и ЦТ по химии
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
-
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
-
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
-
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
-
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
-
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Химические связи – определение, возникновение
Теорию отдельно выдвинули Гильберт Ньютон Льюис и Вальтер Коссель в 1916 году. Для описания соединения двух атомов используется термин «химическая связь». В образовании участвуют электроны, которые расположены на внешних энергетических уровнях, а потому наименее связанные с ядром – это валентные электроны. При соединении образуется три вида частиц:
- молекула – небольшого размера электронейтральная частица вещества с характерными для него химическими свойствами;
- ионы – заряженные частицы, атомы и группы связанных атомов с обилием (анионы) или дефицитом (катионы) электронов;
- свободный радикал – частица с ненасыщенной (свободной) валентностью.
Возникновение химической связи между атомами ведёт к образованию частиц: молекул, ионов и свободных радикалов. При этом уменьшается полная энергия системы – объединение атомов в частицу протекает энергетически выгодно. Образование связи на примере водородной молекулы (Рис. 1):
Рис.1. Образование молекулы водорода
- Пребывание двух мелких частиц на дальнем друг от друга промежутке – энергия взаимосвязи приближается к нулю (взаимосвязи нет).
- Сближение атомов на отдаление, соизмеримое с размером электронного пространства – вступают силы притяжения и отталкивания.
- Начало действия силы притяжения между электронной оболочкой одного атома и ядром другого атома, конкурирующие силы отталкивания между ядрами и между электронами.
- Силы притяжения преобладают над силами отталкивания – сближаются атомы, а потенциальная энергия снижается до возникновения стабильной молекулы при r = r.
- Дальнейшее сближение – энергия системы стремительно повышается за счёт преобладания сил отталкивания.
Энергетический минимум идентичен устойчивому состоянию системы – в этой ситуации из пары обособленных водородных частиц получается молекула H2. Во время реакции производится 436 кДж/моль.




![§ 37. закон полного тока [1970 кузнецов м.и. - основы электротехники]](http://mediaex.ru/wp-content/uploads/3/c/2/3c2c08c50a23bed8bee7407ab6672939.jpeg)






















![§ 37. закон полного тока [1970 кузнецов м.и. - основы электротехники]](http://mediaex.ru/wp-content/uploads/0/e/f/0ef5a1da670cb4ebedd205e143f7bb00.jpeg)