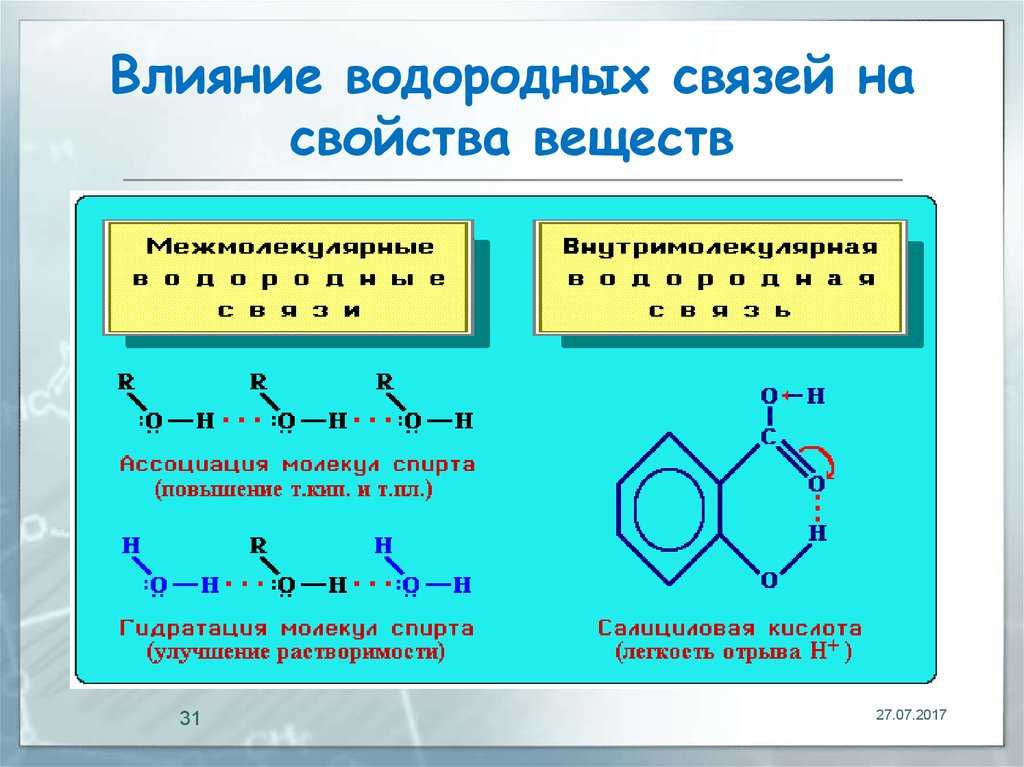
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Источник
Синтез и обработка [ править ]
LiH получают путем обработки металлического лития газообразным водородом :
- 2 Li + H 2 → 2 LiH
Эта реакция особенно быстро протекает при температурах выше 600 ° C. Добавление 0,001–0,003% углерода или / и повышение температуры и / или давления увеличивает выход до 98% при 2-часовом времени пребывания. : 147 Однако реакция протекает уже при температуре 29 ° C. Выход составляет 60% при 99 ° C и 85% при 125 ° C, и скорость существенно зависит от состояния поверхности LiH. : 5
Менее распространенные способы синтеза LiH включают термическое разложение алюмогидрида лития (200 ° C), боргидрида лития (300 ° C), н-бутиллития (150 ° C) или этиллития (120 ° C), а также несколько реакций с участием соединения лития с низкой стабильностью и доступным содержанием водорода. : 144–145
В результате химических реакций LiH образуется в виде комкованного порошка, который можно прессовать в гранулы без связующего. Более сложные формы можно получить путем литья из расплава. : 160 сл. Затем крупные монокристаллы (длиной около 80 мм и диаметром 16 мм) могут быть выращены из расплавленного порошка LiH в атмосфере водорода по методу Бриджмена – Стокбаргера . Часто они имеют голубоватый цвет из-за наличия коллоидного лития. Этот цвет можно удалить путем постростового отжига при более низких температурах (~ 550 ° C) и более низких температурных градиентах. : 154 Основными примесями в этих кристаллах являются Na (20-200 частей на миллион, частей на миллион), O (10-100 частей на миллион), Mg (0,5-6 частей на миллион), Fe (0,5-2 частей на миллион) и Cu (0,5 частей на миллион). -2 промилле). :155
Растрескивание литого LiH после обработки фрезой . Масштаб в дюймах.
Объемные детали из LiH методом холодного прессования можно легко обрабатывать с использованием стандартных методов и инструментов с точностью до микрометра . Однако литой LiH хрупкий и легко трескается во время обработки. : 171
Более энергоэффективным способом получения порошка гидрида лития является измельчение металлического лития в шаровой мельнице при высоком давлении водорода. Проблемой этого метода является холодная сварка металлического лития из-за его высокой пластичности. Добавляя небольшое количество порошка гидрида лития, можно избежать холодной сварки.
Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
Водород

Водород — самый распространенный элемент Вселенной.
1H 1s1
Изотопы:
11Н — протий — 99.985 %
12Н — дейтерий (Д) — 0.015 %,
13Н — тритий (Т) — радиоакт.
Аr 1,008
ЭО 2,1
На Земле атомы Н находятся в составе молекул Н2O, углеводородов СХНУ и других органических веществ.
Из каждых 100 атомов, распространенных на Земле, 16 — атомы водорода. В ПСЭ водород занимает уникальное положение — его располагают в двух главных подгруппах (I и VII групп).
По электронной конфигурации он формально относится к семейству s-элементов и имеет сходство со щел. Me:
— степень окисления +1 (в большинстве соединений);
— восстановительные свойства (Н° -1e- → Н+).
В соединениях с металлами (гидридах МеНх) водород имеет степень окисления -1 и проявляет свойства солеобразующего аниона Н1 (подобно галогенам). Кроме того, в свободном состоянии водород представляет собой газ, состоящий из двухатомных молекул Н2, что коренным образом отличает его от щел. Me и сближает с Hal2.
Физические свойства молекулярного
При об. Т Н2 — очень легкий бесцв. газ, без запаха, плохо растворимый в воде. Хорошо растворяется в твердых и расплавленных металлах, особенно Pt, Pd, Ni.
Способы получения
Промышленное производство
Основными видами сырья для промышленного производства Н2 являются газообразные, жидкие и твердые горючие ископаемые, а также вода.
а) Конверсия метана с водяным паром:
CH4 + H2O = СО + ЗН2
б) Газификация твердого топлива:
C + H2O = СО + Н2
(уголь) «водяной газ»
в) Электролитическое разложение воды в присутствии щелочей:
2Н2O = 2Н2 + O2
Лабораторные способы получения
а) Взаимодействие активных металлов с разбавленными растворами HCl или H2SO4, например:
Zn + 2HCl = ZnCl2 + H2
б) Взаимодействие щел. и щел.-зем. металлов с водой, например:
Са + 2Н2O = Са(ОН)2 + Н2
в) Взаимодействие Al, Zn, Si с водными растворами щелочей:
2Al + 2NaOH + 6Н2O = 2Na + ЗН2
Si + 2NaOH + Н2O = Na2SiO3 + 2Н2
г) Электролиз разбавленных растворов хлоридов щел. металлов, например:
2NaCl + 2Н2O = Н2 + Cl2 + 2NaOH
д) Действие воды на гидриды металлов:
СаН2 + 2Н2O = 2H2 + Са(ОН)2
Характеристика гидридов металлов МеНх
Гидриды щел. и щел.-зем. Me — кристаллические ионные соединения, в расплавленном состоянии проводят электрический ток. Обладают высокой химической активностью, сильные восстановители. Взаимодействуют бурно с 02 воздуха, разлагают воду, восстанавливают металлы из оксидов, реагируют даже с азотом.Примеры реакций:
CaH2 + O2 = CaO + H2O
При электролизе расплавов гидридов МеНх водород выделяется на аноде!
лития гидрид
- Бурно реагирует с водой с образованием гидроксида лития и водорода.
LiH + H2O → LiOH + H2 - Бурно реагирует с сухим фтороводородом с образованием фторида лития и водорода.
- Реагирует с сухим хлороводородом с образованием хлорида лития и водорода, раскаляясь до красного каления.
- При 400 С реагирует с гидроксидом лития с образованием оксида лития и водорода.
- При обычной температуре реагирует с углекислым газом в присутствии воды с образованием формиата лития.
- С диоксидом серы образует тиосульфат лития и воду.
- Выше 50 С с диоксидом серы образует сульфид лития и гидроксид лития.
- С гидразином образует гидразид лития.
- Реагирует с тетрахлоридом кремния с образованием силана.
- При хранении на дневном свете, а особенно при действии ультрафиолета, изменяет цвет, становится голубым за счет частичного разложения с выделением лития в тонко распыленном состоянии.
- Выше 700 С разлагается на литий и водород. Давление диссоциации достигает атмосферного при 850 С.
- Реагирует с жидким аммиаком с образованием амида лития.
- Реагирует с кислородом только при температуре красного каления.
- При нагревании с азотом образует нитрид лития и аммиак.
- При 440-460 С активно реагирует с аммиаком с образованием амида лития и бурным выделением водорода.
- При длительном нагревании при температуре красного каления реагирует с серой, углеродом, кремнием, фосфором.
- Реагирует с хлоридом алюминия в эфире с образованием алюмогидрида лития.
- При высокой температуре бурно реагирует с диоксидом кремния. Аппаратура из стекла, кварца и фарфора разъедается образующимся при высокой температуре металлическим литием.
Реакции, в которых вещество не участвует:
- На холоду не реагирует с кислородом.
- При обычной температуре заметно не реагирует с хлором.
- Ниже 320 С не реагирует с газообразным аммиаком.
Дополнительная информация:
При хранении на дневном свете сначала розовеет, затем сереет и, наконец, становится голубым. Под действием ультрафиолетового света он тоже становится голубым, по-видимому, из-за частичного разложения и выделения коллоидного лития.
Источники информации:
- Жигач А.Ф., Стасиневич Д.С. Химия гидридов. — Л.: Химия, 1969. — С. 52-57
- Кулифеев В.К., Миклушевский В.В., Ватулин И.И. Литий. — М.: Мисис, 2006. — С. 24-27
- Остроушко Ю.И., Бучихин П.И. и др. Литий, его химия и технология. — М.: ИГУИАЭ, 1960. — С. 40-42
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 76
- Химическая энциклопедия. — Т. 2. — М.: Советская энциклопедия, 1990. — С. 607
- Шпильрайн Э.Э., Якимович К.А. Гидрид лития. Физико-химические и теплофизические свойства. — М.: Издательство стандартов, 1972
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).
Водород. Физические и химические свойства, получение
Водород H — самый распространённый элемент во Вселенной (около 75 % по массе), на Земле — девятый по распространенности. Наиболее важным природным соединением водорода является вода.Водород занимает первое место в периодической системе (Z = 1).
Он имеет простейшее строение атома: ядро атома – 1 протон, окружено электронным облаком, состоящим из 1 электрона.В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон).
В природе встречаются изотопы водорода: 1Н — протий (ядро состоит из одного протона), 2Н — дейтерий (D — ядро состоит из одного протона и одного нейтрона), 3Н — тритий (Т — ядро состоит из одного протона и двух нейтронов).
Простое вещество водород
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.Физические свойства. Водород — бесцветный нетоксичный газ без запаха и вкуса. Молекула водорода не полярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде малы.
Это проявляется в низких температурах кипения (-252,6 0С) и плавления (-259,2 0С).
Водород легче воздуха, D (по воздуху) = 0,069; незначительно растворяется в воде (в 100 объемах H2O растворяется 2 объема H2).
Поэтому водород при его получении в лаборатории можно собирать методами вытеснения воздуха или воды.
Получение водорода
В лаборатории
5. Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H2O → 2H2+О2
Промышленное получение водорода
1. Конверсия метана с водяным паром, Ni 800 °С (самый дешевый):
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
В сумме:
CH4 + 2 H2O → 4 H2 + CO2
2. Пары воды через раскаленный кокс при 1000оС:
С + H2O → CO + H2
CO +H2O → CO2 + H2
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
Химические свойства водорода
- В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1.
- Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов Н:Н или Н2
- Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж: Н2 = 2Н, ∆H° = 436 кДж/моль
- Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
- Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
1) С галогенами образует галогеноводороды:
Н2 + Cl2 → 2НСl.При этом с фтором — взрывается, с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
2) С кислородом:
2Н2 + О2 → 2Н2О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом.
3) При нагревании энергично реагирует с серой (значительно труднее с селеном и теллуром):
Н2 + S → H2S (сероводород),
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН2 + N2 → 2NН3
5) С углеродом при высоких температурах:
2Н2 + С → СН4 (метан)
6) С щелочными и щелочноземельными металлами образует гидриды (водород – окислитель):
Н2 + 2Li → 2LiHв гидридах металлов ион водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na+H— построен подобно хлориду Na+Cl—
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
CuO + H2 → Cu + H2O
Fe3O4 + 4H2 → 3Fe + 4Н2О
![]() с оксидом углерода (II):
с оксидом углерода (II):
CO + 2H2 → CH3OH
Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН3ОН и другие. 9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2
9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2.
Безопасность
LiH бурно реагирует с водой с образованием газообразного водорода и LiOH, который является едким веществом. Следовательно, пыль LiH может взорваться во влажном или даже сухом воздухе из-за статического электричества. При концентрации в воздухе 5–55 мг / м 3 пыль вызывает сильное раздражение слизистых оболочек и кожи и может вызвать аллергическую реакцию. Из-за раздражения LiH обычно отторгается, а не накапливается организмом.
Некоторые соли лития, которые могут образовываться в реакциях LiH, токсичны. Пожар LiH нельзя тушить с помощью двуокиси углерода, четыреххлористого углерода или водных огнетушителей; его следует задушить, накрыв металлическим предметом или графитовой или доломитовой пудрой. Менее подходит песок, так как он может взорваться при смешивании с горящим LiH, особенно если он не высохнет. LiH обычно транспортируется в масле в контейнерах из керамики, определенных пластиков или стали, а также в атмосфере сухого аргона или гелия. Можно использовать азот, но не при повышенных температурах, так как он вступает в реакцию с литием. LiH обычно содержит металлический литий, который вызывает коррозию стальных или кремнеземных контейнеров при повышенных температурах.
Физико-химические свойства гидридов
С точки зрения физических и химических свойств можно сказать, что характеристики каждого гидрида зависят от типа связи, которая осуществляется.
Например, когда гидридный анион связан с электрофильным центром (обычно это ненасыщенный атом углерода), образующееся соединение ведет себя как восстановитель, применение которого очень широко распространено в химическом синтезе..
Напротив, в сочетании с такими элементами, как щелочные металлы, эти молекулы реагируют со слабой кислотой (кислотой Бренстеда) и ведут себя как сильные основания, выделяя газообразный водород. Эти гидриды очень полезны в органическом синтезе.
Затем наблюдается, что природа гидридов очень разнообразна, способна образовывать дискретные молекулы, твердые вещества ионного типа, полимеры и многие другие вещества..
По этой причине они могут быть использованы в качестве осушителей, растворителей, катализаторов или промежуточных соединений в каталитических реакциях. У них также есть многократное использование в лабораториях или отраслях промышленности для различных целей.
Водород: характеристика, получение
Ключевые слова конспекта: характеристика элемента водород, физические свойства водорода, получение водорода.
Водород — первый, самый легкий элемент Периодической системы элементов. Массовая доля водорода в земной коре менее 1%.
Степень окисления водорода +1 — в составе воды, кислот, оснований, кислых солей. Степень окисления -1 встречается редко, в гидридах щелочных и щелочноземельных металлов: NaH, СаН2.
Изотопы водорода различаются массовыми числами: протий 1Н, дейтерий 2Н (D), тритий 3Н (Т).
Практически весь водород в природе находится в виде соединений. Это — вода Н2О, природный газ метан СН4, углеводороды вида СаНb, например газ пропан С3Н8 и компонент нефти октан C8H18, соляная кислота НСl в нашем желудке. Водород в виде воды и органических соединений — важнейший элемент растительных и животных организмов, например в составе сахара С12Н22О11.
Физические свойства водорода Н2. Газ без цвета, вкуса и запаха, значительно легче воздуха, плотность 0,09 г/л — это самый легкий газ, температура сжижения -253°С, в воде практически нерастворим (в 100 г воды при н.у. растворяется 2,15 мл Н2).
Получение водорода. В лаборатории водород получают при взаимодействии соляной кислоты НСl или разбавленной серной кислоты H2SO4(p-p) с цинком Zn:
Другой способ — разложение воды электрическим током:
![]()
В промышленности взаимодействие метана (и родственных ему углеводородов) с кислородом в присутствии паров воды называют конверсией. Так, из метана СН4 взаимодействием с кислородом в присутствии избытка паров воды получают водород:
2СН4 + O2 + 2Н2O = 6Н2 + 2СO2.
Для отделения углекислого газа образовавшуюся смесь газов под давлением пропускают через холодную воду. Углекислый газ в воде растворяется, а водород нет.
Иногда конверсию метана проводят при недостатке водяного пара:
CH4 + Н2O = CO +3H2.
Образующуюся смесь оксида углерода(II) с водородом {синтез-газ) используют в органическом синтезе.
Разложение воды электрическим током из-за дорогой стоимости электричества в больших масштабах невыгодно.
Также водород получают при взаимодействии водяного пара с раскаленным углем:
С + Н2O = СО + Н2.
Образующуюся смесь называют водяным газом.
В промышленности используют водород, выделяющийся в реакциях разложения при нагревании каменного угля или нефти без доступа воздуха.
Конспект урока по химии «Водород: характеристика, получение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Synthese und Verarbeitung
LiH wird durch Behandlung hergestellt Lithium Metall mit Wasserstoff Gas:
- 2 Li + H.2 → 2 LiH
Diese Reaktion ist bei Temperaturen über 600 ° C besonders schnell. Die Zugabe von 0,001–0,003% Kohlenstoff oder / und die Erhöhung der Temperatur oder / und des Drucks erhöhen die Ausbeute bei einer Verweilzeit von 2 Stunden auf bis zu 98%.:147 Die Reaktion läuft jedoch bei Temperaturen von nur 29 ° C ab. Die Ausbeute beträgt 60% bei 99 ° C und 85% bei 125 ° C, und die Rate hängt wesentlich vom Oberflächenzustand von LiH ab.:5
Weniger gebräuchliche Wege der LiH-Synthese umfassen die thermische Zersetzung von Lithiumaluminiumhydrid (200 ° C), Lithiumborhydrid (300 ° C), n-Butyllithium (150 ° C) oder Ethyllithium (120 ° C) sowie mehrere Reaktionen mit Lithiumverbindungen von geringer Stabilität und verfügbarem Wasserstoffgehalt.:144–145
Chemische Reaktionen ergeben LiH in Form eines konzentrierten Pulvers, das ohne Bindemittel zu Pellets gepresst werden kann. Komplexere Formen können durch Gießen aus der Schmelze hergestellt werden.:160 ff. Große Einkristalle (etwa 80 mm lang und 16 mm im Durchmesser) können dann aus geschmolzenem LiH-Pulver in Wasserstoffatmosphäre gezüchtet werden Bridgman-Stockbarger-Technik. Sie haben oft eine bläuliche Farbe aufgrund des Vorhandenseins von kolloidalem Li. Diese Farbe kann durch Tempern nach dem Wachstum bei niedrigeren Temperaturen (~ 550 ° C) und niedrigeren Wärmegradienten entfernt werden.:154 Hauptverunreinigungen in diesen Kristallen sind Na (20–200 ppm), O (10–100 ppm), Mg (0,5–6 ppm), Fe (0,5–2 ppm) und Cu (0,5–2 ppm).:155
Rissbildung im gegossenen LiH nach Bearbeitung mit a Fliegenschneider. Maßstab ist in Zoll.
Kaltgepresste LiH-Massenteile können einfach mit Standardtechniken und -werkzeugen bearbeitet werden Mikrometer Präzision. Gegossenes LiH ist jedoch spröde und reißt während der Verarbeitung leicht.:171
Ein energieeffizienterer Weg zur Bildung von Lithiumhydridpulver ist das Kugelmahlen von Lithiummetall unter hohem Wasserstoffdruck. Ein Problem bei diesem Verfahren ist das Kaltschweißen von Lithiummetall aufgrund der hohen Duktilität. Durch Zugabe kleiner Mengen Lithiumhydridpulver kann das Kaltschweißen vermieden werden.
Интерметаллические соединения
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.

У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
Другие свойства
Гидрид лития намного более устойчив, чем гидриды других щелочных металлов, и его можно плавить без разложения.
На него не действует кислород, если он нагревается до температуры ниже красного. На него также не влияет хлор Cl.2 и соляная кислота HCl.
Контакт LiH с теплом и влажностью вызывает экзотермическую реакцию (выделяет тепло) и выделение водорода H2 и гидроксид лития LiOH.
Он может образовывать мелкую пыль, которая может взорваться при контакте с пламенем, теплом или окисляющими материалами. Он не должен контактировать с закисью азота или жидким кислородом, так как может взорваться или воспламениться.
Он темнеет на свету.
Характеристики
Гидрид лития представляет собой ионный и диамагнитный проводник , электрическая проводимость которого постепенно увеличивается с 2 × 10-5 Ом -1 см -1 до 443 ° C при 0,18 Ом -1 см -1 при 754 ° C , без разрыва при температуре плавления : 36 . Его диэлектрическая проницаемость уменьшается с 13,0 (статическая, низкая частота) до 3,6 ( видимый спектр ) : 35 .
Это довольно мягкий материал с твердостью 3,5 по шкале Мооса : 42 . Его ползучесть при сжатии быстро увеличивается от менее 1% при 350 ° C до более 100% при 475 ° C , что означает, что он не может обеспечить механическую поддержку при высокой температуре : 39 .
Теплопроводность литии Гидрида уменьшается с температурой и зависит от морфологии материала: при 50 ° С это 0,125 Вт / (см К) для кристаллов и 0,069 5 Вт / (см K) для кристаллов. Уплотненные материалы, но в то 500 ° C 0,036 Вт / (см · К) для кристаллов и 0,043 · 2 Вт / (см · К) для уплотненных материалов : 60 . Коэффициент теплового расширения составляет 4,2 × 10 −5 K −1 при температуре окружающей среды : 49 .
Получение водорода и его применение
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:


- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
Нахождение в природе, изучение его свойств
Звездная температура позволяет существовать водороду в виде плазмы. Это примерно 6000оС. Однако пространство между звездами заполнено отдельными молекулами, атомами и ионами, которые зачастую образовывают молекулярные скопления различных размеров и форм — облака. Плотность вещества при этом не является постоянной величиной, как и его температура.
В коре Земли водород считается десятым по распространенности элементом. Его массовая доля равна 1%. В то же время по числу атомов он достигает 17%. Это второе место после кислорода, доля которого равна 52%. Отсюда и значительная роль водорода в природе, особенно в химических превращениях.
Все органические вещества включают в свой состав водород. Велика его доля в живых клетках (по количеству атомов его удельный вес достигает 63%).
В составе воды водород имеет большое значение в протекании геохимических процессов. Так, вулканические газы вызывают истечение определенных количестве водорода вдоль разломов (причина — рифтогенез). По этой же причине часто обнаруживают водород в районе угольных месторождений.
Натуральные минералы могут содержать Н2 в виде ионов аммония, гидроксил-ионов и воды.
Причина появления молекул Н2 в атмосфере — разложение формальдегида — участника окисления метана и прочих органических соединений. Кроме того, причина его образования — неполное сгорание топлива и биомассы, фиксация азота некоторыми микроорганизмами, содержащимися в воздухе.
Молекулы водорода легкие, поэтому имеют высокую тепловую скорость. При попадании в верхние слои атмосферы такие молекулы часто улетают в космос, при этом их потери могут достигать 3 кг каждую секунду.



















![Литий гидридсодержание а также физические свойства [ править ]](http://mediaex.ru/wp-content/uploads/8/4/8/848443479d76b05a6a231427b16d8b4d.jpeg)