Содержание серы в различных соединениях
Чистая сера – слишком дорогой продукт для использования в качестве удобрения в больших количествах. Но в районах расположения месторождений серы с недостаточным процентом элемента для использования в промышленности серные породы служат удобрением.
В основном для устранения серной недостаточности используются серосодержащие удобрения:
- Простой суперфосфат (20 % P2O5, 13 % S). С ним на поля поступает преобладающее количество серы. В связи с тем, что потребность в фосфоре и сере приблизительно одинакова, при внесении данного удобрения удовлетворяется и потребность в сере.
- Сульфат аммония (21 % N, 24 % S) – второе место по снабжению почвы серой.
- Сернокислый калий (48 % K2O, 17,6 % S) и калимагнезия (28 % K2O, 18,3 % S) – калийные, бесхлорные удобрения. Применяются в ограниченном количестве и поэтому играют небольшую роль в обеспечении почв серой.
- Гипс (18,6 % S) хорошо доступен растениям. Представляет собой быстродействующую нейтральную сернокислую соль кальция.
- Фосфогипс (22 % S) – отходы химических заводов, выпускающих двойной суперфосфат. Подобен гипсу по составу, но включает в себя примеси фосфора и других элементов. Служит серосодержащим удобрением местного значения. Его недостаток – влажность 30–35 %.
- Сульфат магния содержит 28–30 % серы. Данное удобрение используется в закрытом грунте.
- Полисульфид аммония – темная, красно-бурая, до черного цвета жидкость. Содержит около 20 % азота и 40 % серы.
- Тиосульфат аммония – жидкость красноватого цвета, содержит 12 % азота и 26 % серы.
- Навоз – содержит серу в количестве до 1 кг SO3 в 1 т или от 0,6 до 0,15 %.
В каких продуктах содержится сера
Суточная потребность в сере – 0,5–1,2 г, при сбалансированном меню, наличии в рационе достаточного количества белковых продуктов необходимое количество можно получать ежедневно из пищи. Больше всего её содержится в продуктах животного происхождения, в небольших количествах его можно встретить в растительной пище.
Таблица продуктов с высоким содержанием серы
| Продукт | Содержание серы (мг) |
| Мясо кролика, курицы, индейки | 180–240 |
| Щука, окунь, сардина, горбуша, камбала | 190–210 |
| Соя | 240–250 |
| Зелёный горох | 180–190 |
| Сырой фундук, миндаль | 170–190 |
| Яйца куриные | 170–180 |
| Яйца перепелиные | 120–130 |
| Сгущённое молоко | 70–75 |
| Перловая, пшеничная, овсяная крупа | 70–100 |
| Репчатый лук | 60–70 |
| Рис, манка | 60–70 |
| Молоко | 30–35 |
| Капуста, картофель | 30–40 |
| Помидоры, баклажаны | 12–15 |
| Малина, земляника, крыжовник | 12–18 |
| Дыня, цитрусовые плоды | 10–12 |
Строение атома и свойства серы
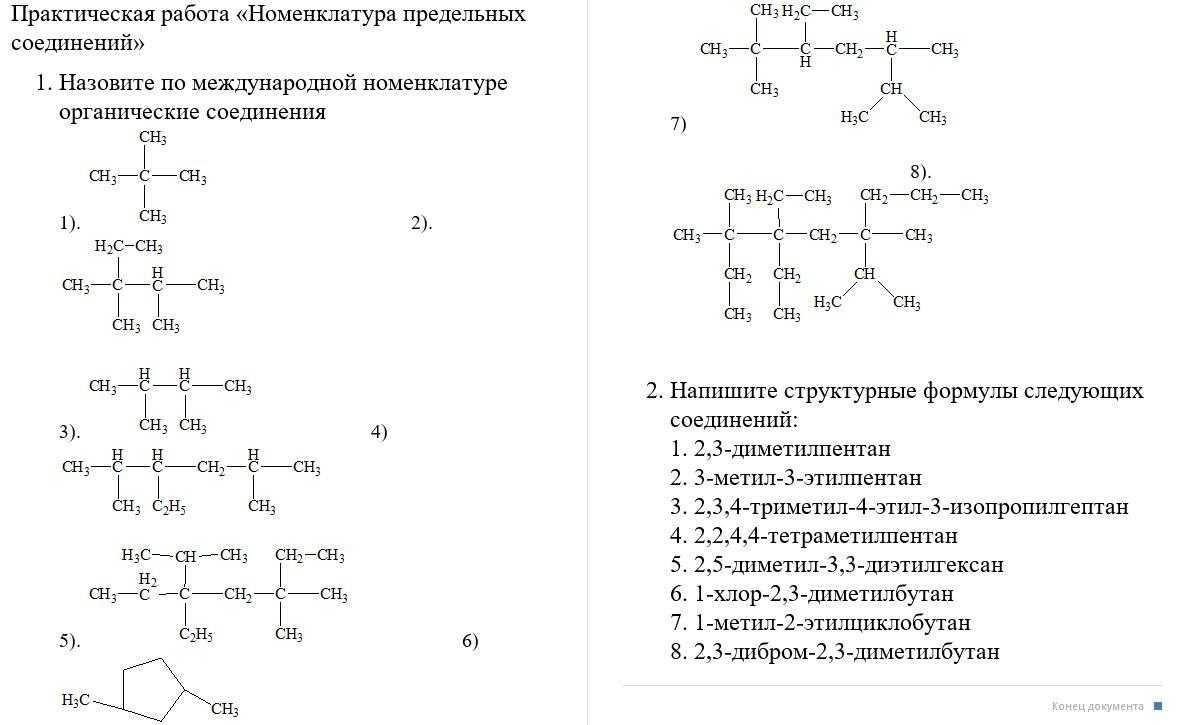
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
![]()
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
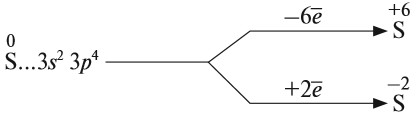
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
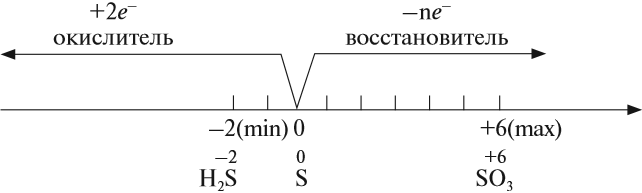
Иногда эти свойства проявляются в одной реакции:
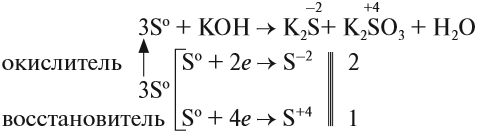
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Применение серы в сельском хозяйстве и в горнохимической отрасли
Серу и ее соединения широко применяют в сельскохозяйственной промышленности. Она используется в качестве удобрений, так как это вещество очень полезно для роста и развития растений, сера увеличивает способность поглощения фосфора. Она применяется как ядохимикат для защиты от грызунов, насекомых и других вредителей. Ею опрыскивают урожай, чтобы избежать появления плесени и грибка. А оксидом серы окуривают многие зернохранилища, тем самым обеспечивают защиту от вредителей, живущих в амбарах.
Лидер среди потребления серы — горнохимическая промышленность. Для получения серной кислоты, которая широко применяется в химической отрасли, идет около половины всех добытых запасов вещества. Сера и серная кислота используются при изготовлении спичек, резины, каучука, пороха и других взрывчатых веществ. А очищенное вещество применяется для светящихся красок и составов. С помощью серы также производят сероуглерод, который очень хорошо растворяет жиры и жировые соединения. Сера нужна и для вискозного производства.
Соединения серы востребованы в нефтехимической отрасли. Они необходимы для процесса получения машинных масел, различных смазок для агрегатов, которые работают в условиях сверхвысокого давления, жидкостей для охлаждения металлов при их обработке.
Радиоактивный изотоп серы применяют, чтобы досконально изучить процесс эмульсионной полимеризации неопрена, для разработки аналитических способов раздела высших полимеров. Изотоп серы используют для исследования свойств полимеров, изучают диффузные свойства пластификаторов. Изотопом облучают полиамидное полотно, этим самым ему придают антистатичные и гидрофильные свойства.
Сера — важнейшее вещество в жизни человека. Она необходима практически во всех сферах деятельности человечества.
СВОЙСТВА

Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Инструкция по применению серы
Перед применением серосодержащих препаратов следует обязательно проконсультироваться со специалистом. Только врач сможет подобрать оптимальные и безопасные дозировки препарата.
Серная мазь
Средство для наружного применения обладает дезинфицирующими, противопаразитарными, антисептическими, противомикробными свойствами. Мазь назначают в составе комплексной терапии при лечении лишая, псориаза, себорея, устранения грибковых инфекций, чесотки, демодекоза.
Порошок серы для внутреннего применения
Очищенная сера в виде порошка помогает при энтеробиозе, ожирении, проблемах с кроветворением, можно использовать и осаждённый продукт, но он часто провоцирует развитие метеоризма.
Как принимать лекарство:
- Для лечения запущенных кожных и грибковых заболеваний подходит только очищенная медицинская сера, её нужно принимать по 0,5–1 г в три приёма во время еды. Продолжительность терапии – 3–4 недели.
- При энтеробиозе. Доза для взрослых составляет 1 г, для детей – старше 6 лет – 0,5 г, до 5 лет –0,25 г. Лекарство нужно принимать трижды в сутки на протяжении 5 дней. После чего нужно сделать четырёхдневный перерыв, ставить каждый вечер очистительные клизмы с содой. Для полного избавления от паразитов потребуется 3–5 курсов.
- В качестве отхаркивающего, общеукрепляющего средства – по 0,25 г вместе с утренним приёмом пищи.
Пивные дрожжи с серой
В аптеке можно приобрести витаминные пищевые добавки на основе дрожжей и серы – Эвисент, АМТ, Биотерра, они содержит все необходимые элементы для улучшения состояния волос, ногтей, для омоложения кожи лица, поддержания здоровья.
Показания к применению:
- проявления нехватки витаминов группы B;
- период восстановления после оперативных вмешательств и длительной болезни;
- истощение организма, увлечение строгими диетами;
- патологии эндокринного характера – сахарный диабет, нарушений в работе щитовидной железы, ожирение, гормональный дисбаланс;
- болезни пищеварительной системы, ухудшение свёртываемости крови;
- нервное, физическое, умственное переутомление;
- для профилактики сердечно-сосудистых болезней;
- дерматологические заболевания – угри, акне, фурункулёз.
Таблетки следует принимать по 6–15 шт. ежедневно в 3 приёма на протяжении 2–3 месяцев, после чего необходимо сделать перерыв на полгода.
Препараты на основе серы противопоказаны при беременности и лактации, не используют их и для лечения детей младше трёх лет.
Жевательная сера
Натуральная альтернатива жевательным резинкам, полностью состоит из смолистых соединений лиственницы, обладает антимикробным действием. Жевательная сера возвращает зубной эмали естественный цвет, предотвращает развитие кариеса, пародонтоза, пародонтита, воспалительных процессов в ротовой полости, помогает справиться с зубной болью, незаменима при стоматите, ангине. Специалисты рекомендуют жевать серу дважды в сутки по 30 минут.
Лиственничная жвачка помогает бросить курить, избежать переедания.
Сера в народной медицине
Сера помогает избавиться от колик, предотвратить появление грыжи у детей – порошок на кончике ножа нужно добавлять в молоко или другую еду. Предварительно обязательно следует проконсультироваться с хирургом или педиатром.
- Порошок очищенной серы принимают по 1 г трижды в день при дерматологических проблемах. Для лечения диатеза у детей можно приготовить мазь из равного количества серы и жирной сметаны, смазывать поражённые участки 1–2 раза в сутки после водных процедур. Смесь можно использовать даже для новорождённых после предварительной консультации с педиатром.
- Рецепт универсальной болтушки для устранения воспалительных процессов на лице – соединить 50 мл борной кислоты с этиловым спиртом, добавить 7 г медицинской серы, 1 таблетку ацетилсалициловой кислоты. Взболтать, перелить в ёмкость из тёмного стекла, хранить в холодильнике, протирать воспалённые участки утром и вечером.
Где и как добывают Серу

Такой химический элемент как сера может быть найден в природе либо в относительно чистом виде, либо в виде соединений. До 19 века для получения серы использовался так называемый «Сицилийский процесс». Его суть заключается в том, что серную руду, добытую на глубине, помещали на постамент с отверстием внизу и закидывали ее камнями. Камни нагревали до момента пока сера не начинала плавиться и стекать в отверстие. Плавиться серная руда начинала при температуре около 115°C. Этот процесс был не самым эффективным. Часть серы в ходе процесса сгорала, да и сера получалась не самая чистая. Процесс улучшался четыре раза пока не разработали новый метод.
На смену «Сицилийскому методу» пришел «метод Фраша», который действовал до конца XX века. Он заключается в том, что в месторождении серы сверлятся три скважины. В одну из крайних скважин подаются пары воды с большой температурой. Это делается для того, чтобы сера расплавилась и начала перетекать в среднюю скважину. В другую боковую скважину подается нагретый воздух под огромным давлением. Это действие заставляет расплавленую серу подниматься в центральной скважине на поверхность. Там дело остается за малым – собрать серу. Такой метод позволяет получать довольно чистую серу. Чистота добытой серы обычно составляла от 99.7% до 99.8%, что впринципе достаточно. Этим методом некоторые страны получали даже миллионы тонн очищеной серы в год.
На сегодняшний день серу отделяют при добыче нефти, природного газа и связанных с ними ископаемых ресурсов. При добыче этих полезных ресурсов сероводород выделяется как побочный продукт. Его собирают и с помощью гидродесульфурации очищают до элементарной серы. Этот процесс носит название «Процесс Клауса». Ежегодно таким способом добывается 69 млн. тонн серы. Лидерами по производству серы является Китай, США, Канада и Россия.
Читайте: Кремний как химический элемент таблицы Менделеева
Серная руда
Нельзя сказать о том, что свободное состояние серы в природе является частым явлением. Самородная сера встречается довольно редко. Зачастую она является одной из составляющих некоторых руд. Серной рудой называется порода, в состав которой входит самородная сера. Серные вкрапления в породах могут образовываться вместе с сопутствующими породами или позже них. Время их образования влияет на направление поисковых и разведочных работ. Специалисты выделяют несколько теорий образования серы в рудах.
- Теория сингенеза. Согласно данной теории сера и вмещающие породы были образованы одновременно. Местом их формирования были мелководные бассейны. Сульфаты, содержащиеся в воде, с помощью особых бактерий были восстановлены до сероводорода. Далее происходило его поднятие вверх до окислительной зоны, в которой сероводород окислялся до элементарной серы. Она опускалась на дно, оседая в иле, который через время превращался в руду.
- Теория эпигенеза, которая утверждает, что образование вкраплений серы происходило позже основных пород. В соответствии с данной теорией считается, что происходило проникновение подземных вод в толщи пород, в результате чего воды обогащалась сульфатами. Далее данные воды соприкасались с месторождениями нефти или газа, что приводило к восстановлению ионов сульфатов с помощью углеводородов до сероводорода, который, поднимаясь к поверхности и окисляясь, выделял самородную серу в пустотах и трещинах пород.
- Теория метасоматоза. Данная теория является одной из подвидов теории эпигенеза. В настоящее время она все чаще находит подтверждения. Ее суть заключается в превращении гипса (CaSO 4 -H 2 O) и ангидрита (CaSO 4) в серу и кальцит (СаСО 3-). Теорию предложили два ученых Миропольский и Кротов еще в первой половине двадцатого века. Спустя несколько лет было найдено месторождение Мишрак, которое подтверждало образование серы именно таким путем. Однако, до настоящего времени остается неясным сам процесс превращения гипса в серу и кальцит. В связи с этим, теория метасоматоза не является единственно правильной. Кроме этого, сегодня на планете есть озера, имеющие сингенетические отложения серы, однако, в иле не обнаружены гипс или ангидрит. К таким озерам относится Серное озеро, расположенное вблизи Серноводска.
Таким образом, однозначной теории происхождения серных вкраплений в рудах не существует. Образование вещества во многом зависит от условий и явлений, протекающих в земных недрах.
Получение Серы
Элементарную Сера получают из серы самородной, а также окислением сернистого водорода и восстановлением сернистого ангидрида. Источник сернистого водорода для производства Серы — коксовые, природные газы, газы крекинга нефти. Разработаны многочисленные методы переработки H2S; наибольшее значение имеют следующие:
1) H2S извлекают из газов раствором моногидротиоарсената натрия:
Na2HAsS2O2 + H2S = Na2HAsS3O + Н2О.
Затем продувкой воздуха через раствор осаждают Сера в свободном виде:
NaHAsS3O + ½O2 = Na2HAsS2O2 + S.
2) H2S выделяют из газов в концентрированном виде. Затем его основные масса окисляется кислородом воздуха до Серы и частично до SO2. После охлаждения H2S и образовавшиеся газы (SO2, N2, CO2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция:
2H2S + SO2 = 3S + 2Н2О.
В основе получения Сера из SO2 лежит реакция восстановления его углем или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд.
Процесс добычи серы
Вещество в основном добывают в месторождениях, где есть богатые руды, в которых содержится более 25 %, и бедные, в которых присутствует до 12 % элемента. Существуют такие виды месторождений:
- стратиформный — здесь находятся сульфатно-карбонатные толщи руды;
- солянокупольный — это пластовые залежи сульфатных и карбонатных пород;
- вулканогенный — серная руда в этом случае может быть линзовидной и пластообразной формы.
Месторождения серы найдены в Туркмении, Италии, ЮАР, Японии, США — на просторах Луизианы и Техаса, на территории России, а именно в Поволжском регионе и на Урале.

Добыча серы может происходить такими способами:
- Открытым.
- Подземного плавления.
- Разделения руды с использованием центрифуг.
Метод подземного плавления, или Фраша, состоит в том, что плавка вещества перегретой водой около 180 °С происходит сразу же под землей. Этот вариант пригоден при глубоких залежах руды. Затем, после плавления, жидкую серу выкачивают наружу через специальную скважину.
Скважинный метод был впервые применен в США. На их территории обнаружили большие залежи серной руды, но не могли никак к ним подобраться. И ученый-химик Герман Фраш изобрел способ, как плавить руду под землей и выкачивать в последующем с помощью скважин.
Разделение руды с помощью центрифуги основан на разделении двух гетерогенных систем с помощью центробежных сил. Это очень затратный способ. Он дает серу с примесями, и после этого требуется процесс ее дополнительной очистки. Поэтому такой метод очень редко применяется.
Также в отдельных случаях применяются такие методы добычи:
- термический;
- пароводяной;
- фильтрационный;
- экстрационный.
Но независимо от того, как происходит получение серы, правила техники безопасности нужно строго соблюдать. В процессе добычи происходит выделение ядовитого и взрывоопасного газа — сероводорода.
Открытый метод
Открытый метод является наиболее часто используемым. Он состоит в том, что, в начале применяя шагающие экскаваторы, снимают большой пласт грунта с породой. Затем при помощи взрывов руда дробится. Эти мелкие кусочки и поступают для очистки на обогатительные фабрики. После они отправляют на производство, где руду выплавляют и получают чистую серу.

Химические свойства серы
Сера является типичным активным неметаллом.
В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
- окислителем сера является в реакциях с простыми веществами-восстановителями, имеющими меньшую электроотрицательность, чем сера — это водород, металлы, некоторые неметаллы:
S+2e- → S-2
- восстановителем сера является в реакциях с кислородом, галогенами, кислотами-окислителями
S-2e- → S+2 S-4e- → S+4 S-6e- → S+6
Реакции, в которых сера является окислителем:
- с металлами сера реагирует при нагревании с образованием сульфидов:
Fe+S = Fe+2S-2 2Na+S = Na2+1S-2
- с водородом:
S+H2 = H2+1S-2;
- с фосфором:
3S+2P = P2+3S3-2
- с углеродом:
C+2S = C+4S2-2
Реакции, в которых сера является восстановителем:
- с кислородом:
S + O2 = S+4O2-2
- с хлором:
S + Cl2 = S+2Cl2-1
- с фтором:
S + 3F2 = S+6F6-1
Взаимодействие серы со сложными веществами:
- реагирует, как восстановитель с кислотами-окислителями при нагревании:
S + 2H2S+6O4 = 3S+4O2↑ + 2H2O S + 2HN+5O3 = H2S+6O4 + 2N+3O↑ S + 6HN+5O3 = H2S+6O4 + 6N+4O2↑ + 2H2O
- в реакциях диспропорционирования с растворами щелочей при нагревании сера выступает и окислителем, и восстановителем:
3S + 6NaOH = 2Na2S-2 + Na2S+4O3 + 3H2O
Получение [ править | править код ]
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
При добыче руды открытым способом экскаваторами снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Серу из природного сернистого газа получают методом Клауса. Для этого используются так называемые серные ямы, где происходит дегазация серы, на выходе получают модифицированную серу — продукт, широко использующийся в производстве асфальта. Технологические установки для получения серы обычно включают в себя ямы недегазированной серы, ямы дегазации, ямы хранения дегазированной серы, а также налив жидкой серы и склад комовой серы. Стены ямы обычно делают из кирпича, дно заливают бетоном, а сверху закрывают яму алюминиевой крышей. Так как сера — это весьма агрессивная среда, ямы периодически приходится полностью реконструировать.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
Ввиду высокой потребности Красной Армии в боеприпасах Постановлением Президиума ВСНХ от 19 декабря 1930 решено «включить строительство серных предприятий в число ударных первоочередных строек». В 1930—1931 годах были разведаны и запущены в производство 2 месторождения в Средней Азии — Каракумский завод самородной серы (3 тысячи тонн в год) и серный рудник Шорсу. Богатый (25 % каменной серы в руде) рудник Шорсу начал разрабатываться шахтным способом, а затем открытым. После ввода в строй этих рудников, в 1932 году был построен Калатинский завод газовой серы (4 тысячи тонн в год), а также несколько заводов в РСФСР. Основанный в 1939 году в Оренбургской области Медногорский медно-серный комбинат (ММСК) до 1986 года был крупнейшим производителем серы в СССР: в середине 1950-х годов он выпускал до 250—280 тысяч тонн в год, что составляло 80 % серы, производившейся в стране.
— До пятидесятого года стране приходилось импортировать много серы из-за границы. Теперь нужда в импорте серы отпала, — говорил директор завода Александр Адольфович Бурба. — Но завод продолжает расширяться. Начали строить цех производства серной кислоты.
Физические и химические свойства
Сера (Sulfur), S – элемент главной подгруппы VI группы периодической системы Менделеева. Атомный номер – 16, атомная масса – 3,07.
Сера при обычных условиях – хрупкие кристаллы желтого цвета.
- Плотность – 2,07 г/см3,
- Температура плавления – +112,8 °С,
- Температура кипения – +444,6 °С.
Сера нерастворима в воде, однако хорошо растворяется в сероуглероде и бензоле. При испарении данных жидкостей можно получить ромбическую серу, кристаллы которой имеют форму октаэдров со срезанными углами или ребрами.
Встречается также моноклинная модификация серы с температурой плавления + 119,3 °С и плотностью 1,96 г/см3. Она устойчива только при температуре выше +96 °С. При более низкой температуре превращается в ромбическую серу.
Различия в свойствах кристаллических модификаций вызваны неодинаковой структурой кристаллов.
Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
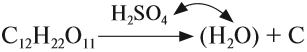
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
![]()
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
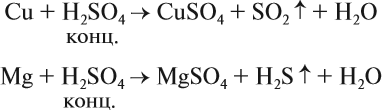
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
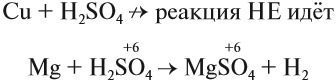
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.