Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO3 + 2NaOH = Na2SO4 + H2O
Кислотные оксиды, которым соответствуют многоосновные кислоты, с щелочами могут образовывать как нормальные, так и кислые соли:
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + NaOH = NaHCO3
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 4KOH = 2K2HPO4 + H2O
P2O5 + 2KOH + H2O = 2KH2PO4
«Привередливые» оксиды CO2 и SO2, активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только основные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH)2 + CO2 = (ZnOH)2CO3 + H2O (в растворе)
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH)3, Cr(OH)3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO2 =to=> Na2SiO3 + H2O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
BeO + 2NaOH + H2O = Na2[Be(OH)4] — тетрагидроксобериллат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] — тетрагидроксоалюминат натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO2x—, где x = 2 в случае амфотерного оксида типа Me+2O и x = 1 для амфотерного оксида вида Me2+2O3:
ZnO + 2NaOH =to=> Na2ZnO2 + H2O
BeO + 2NaOH =to=> Na2BeO2 + H2O
Al2O3 + 2NaOH =to=> 2NaAlO2 + H2O
Cr2O3 + 2NaOH =to=> 2NaCrO2 + H2O
Fe2O3 + 2NaOH =to=> 2NaFeO2 + H2O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na2[Zn(OH)4] =to=> Na2ZnO2 + 2H2O
Na[Al(OH)4] =to=> NaAlO2 + 2H2O
Оксиды. Классификация, свойства, получение, применение
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
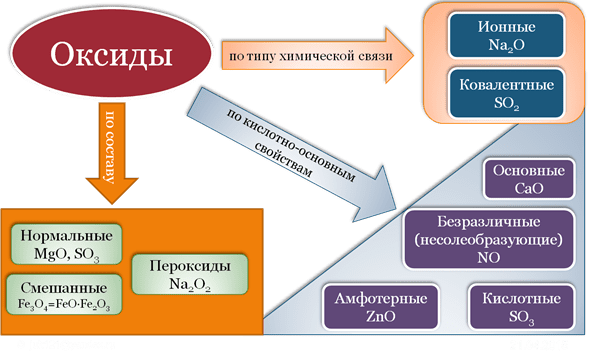
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты.
Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований :Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Химические свойства
Основные реакции оксидов азота с простыми и сложными веществами приведены в таблице.
|
Оксиды |
Реакции |
Уравнения |
|
N2O |
При нагревании разлагается. Окисляет неметаллы. Проявляет свойства восстановителя с сильными окислителями. Реагирует с аммиаком и его производными. Не образует солей. Не реагирует с водой, щелочами, кислотами |
– 2N2O → 2N2 + O2; – 2N2O + C → 2N2 + CO2; – 5N2O + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O; – 2NH3 + N2O → NH4N3 + H2O; – 2NaNH2 + N2O → NaN3 + NaOH + NH3 |
|
NO |
Окисляется до диоксида азота на воздухе при нормальных условиях. Взаимодействует с галогенами. В присутствии сильного восстановителя проявляет окислительные свойства. Не образует соли, плохо растворим в воде |
– 2NO + O2 → 2NO2; – 2NO + Cl2 → 2NOCl; – 2SO2 + 2NO → 2SO3 + N2 |
|
N2O3 |
Разлагается при нагревании. Реагирует с водой с образованием азотистой кислоты. Растворим в щелочах |
– N2O3 → NO + NO2; – N2O3 + H2O → 2HNO2; – N2O3 + 2KOH → 2KNO2 + H2O |
|
NO2 |
Реагирует с неметаллами, металлами, галогенами, водой. Окисляет оксиды серы. Растворяется в щелочах |
– 10NO2 + 8P → 4P2O5 + 5N2; – 4NO2 + Zn → Zn(NO3)2 + 2NO; – 2NO2 + 2Cl2 → NOCl + NO2Cl + Cl2O; – 2NO2 + H2O → HNO3 + HNO2; – NO2 + SO2 → SO3 + NO; – 2NO2 + 2KOH → KNO3 + KNO2 + H2O |
|
N2O5 |
Быстро разлагается с взрывом. Растворяется в воде, щелочах |
– 2N2O5 → 4NO2 + O2; – N2O5 + H2O 2HNO3; – N2O5 + 2NaOH → 2NaNO3 + H2O |
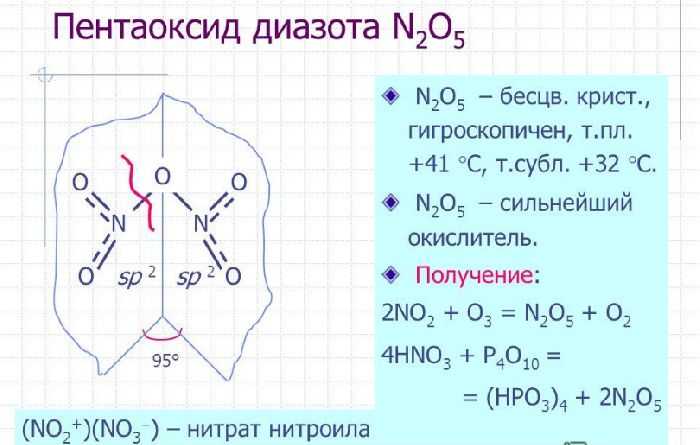 Рис. 3. Пентаоксид диазота или оксид азота (V).
Рис. 3. Пентаоксид диазота или оксид азота (V).
Оксиды используются для получения азотной кислоты. N2O используется в качестве наркоза.
Что мы узнали?
Из темы урока узнали, что азот может образовывать пять стабильных оксидов, проявляя переменную валентность I, II, III, IV, V. Только один оксид (NO) можно получить непосредственным взаимодействием азота и кислорода при нагревании или под воздействием электричества. Остальные оксиды выделяются из солей аммония и азотной кислоты. Большинство оксидов – токсичные газы, способные сжижаться. Оксиды реагируют с металлами, неметаллами, щелочами, оксидами.
-
/10
Вопрос 1 из 10
Общее описание
Азот – это бесцветный двухатомный газ (N2). Атомы в молекуле азота удерживает прочная тройная связь, что обуславливает инертность элемента. Азот реагирует с другими элементами и соединениями под действием внешних факторов – высокой температуры, электричества, катализаторов.
Рис. 1. Строение молекулы азота.
Оксиды образуются из солей аммония и азотной кислоты. Формулы оксидов азота и краткая характеристика соединений приведены в таблице.
|
Название |
Формула |
Получение |
Особенности |
|
Оксид диазота или оксид азота (I) – «веселящий газ» |
N2O |
– Нагревание нитрата аммония (опасность взрыва): NH4NO3 → N2O + 2H2O; – нагревание аминосульфоновой кислоты с разбавленной азотной кислотой: NH2SO2OH + HNO3 → N2O + H2SO4 + H2O |
Бесцветный газ со сладковатым привкусом. Не горит, токсичен. Растворим в воде, серной кислота, спирте |
|
Монооксид или оксид азота (II) |
NO |
Единственный оксид, получаемый непосредственным взаимодействием кислорода и азота при температуре 1200°С или при электрических разрядах: N2 + O2 → 2NO |
Бесцветный ядовитый газ. На воздухе окисляется, приобретая коричневый цвет. Трудно сжижается. В жидком виде имеет голубой цвет |
|
Триоксид диазота или оксид азота (III) |
N2O3 |
При взаимодействии разбавленной азотной кислоты и твёрдого оксида мышьяка с последующим охлаждением: – 2HNO3 + As2O3 → NO2 + NO + 2HAsO3; – NO2 + NO → N2O3 |
При нормальных условиях – синяя жидкость. Может приобретать газообразное и твёрдое состояния. Сильно токсичен, вызывает ожоги кожи |
|
Диоксид или оксид азота (IV) |
NO2 |
– При взаимодействии азотной кислоты и меди: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O; – при разложении нитрата свинца: 2Pb(NO3)2 → 2PbO + 4NO2 + O2 |
Ядовитый газ бурого цвета с острым запахом. Легко сжижается при температуре ниже +21°С, превращаясь в желтоватую жидкость |
|
Пентаоксид диазота или оксид азота (V) |
N2O5 |
– Дегидратация азотной кислоты в присутствии оксида фосфора: 2HNO3 + P2O5 → 2HPO3 + N2O5; – взаимодействие хлора и нитрата серебра: 4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2; – реакция оксида азота (IV) и озона: 2NO2 + O3 → N2O5 + O2 |
Бесцветное твёрдое кристаллическое соединение, крайне неустойчивое при нормальных условиях. Приобретает стабильную форму при температуре ниже +10°C |
 Рис. 2. Диоксид или оксид азота (IV).
Рис. 2. Диоксид или оксид азота (IV).
Помимо пяти стабильных оксидов азота известны ещё пять нестабильных соединений – NON3, NO2N3, N(NO2)3, нитратный радикал NO3 и димер, состоящий из двух простых молекул, диоксида азота (N2O4).
Оксид азота N2O5(V)
Строение молекулы:
Связи N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
- Аммиак
- Азотная кислота
Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Источник статьи: http://fb.ru/article/409697/vyisshie-oksidyi-klassifikatsiya-formulyi-i-ih-svoystva
Оксиды

Оксиды — соединения двух элементов, один из которых кислород в степени окисления -2.
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N20, NO.
Солеобразующие оксиды:
Основные. Оксиды, гидраты которых являются основаниями. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na2O — оксид натрия, СаО — оксид кальция, CuO — оксид меди (II), СоО — оксид кобальта (II), Bi2O3 — оксид висмута (III), Mn2O3 — оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl2O3 — оксид алюминия, Cr2O3 — оксид хрома (III), SnO2 — оксид олова (IV), МnO2 — оксид марганца (IV), ZnO — оксид цинка, ВеО — оксид бериллия.
Кислотные. Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов.
Примеры: Р2О3 — оксид фосфора (III), СO2 — оксид углерода (IV), N2O5 — оксид азота (V), SO3 — оксид серы (VI), Cl2O7 — оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7.
Примеры: Sb2O5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn2O7 — оксид марганца (VII).
Изменение характера оксидов при увеличении степени окисления металла
| Изменение характера оксидов при увеличении с. о. металла | Cr+2O (осн.) | Cr+32O 3(амф.) | Cr+6O 3(кисл.) |
| Mn+2O (осн.) | Mn+4O2 (амф.) | Mn+6O3 (кисл.) | |
| Mn+32O3 (осн.) | Mn+72O 7 (кисл.) |
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета — твердые вещества. Оксид серы (VI) SO3 — бесцветная летучая жидкость, а оксид углерода (IV) СО2 — бесцветный газ при обычных условиях.
Агрегатное состояние
Твердые:
CaO, СuО, Li2O и др. основные оксиды; ZnO, Аl2O3, Сr2O3 и др. амфотерные оксиды; SiO2, Р2O5, СrO3 и др. кислотные оксиды.
Жидкие:
SO3, Cl2O7, Мn2O7 и др..
Газообразные:
CO2, SO2, N2O, NO, NO2 и др..
Растворимость в воде
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
в) SiO2
Химические свойства
1. Кислотно-основные свойства
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:
Пример:
(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO2).
Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:
2. Окислительно — восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. — окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C+2O + O2 = 2C+4O2
2S+4O2 + O2 = 2S+6O3
2N+2O + O2 = 2N+4O2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C+2O + FeO = Fe + 2C+4O2
C+2O + H2O = H2 + 2C+4O2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
C+4O2 + C = 2C+2O
2S+6O3 + H2S = 4S+4O2 + H2O
C+4O2 + Mg = C0 + 2MgO
Cr+32O3 + 2Al = 2Cr0 + 2Al2O3
Cu+2O + H2 = Cu0 + H2O
Использование оксидов малоактивных металлов дпя окисления органических веществ.
Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
Способы получения
1. Взаимодействие простых веществ — металлов и неметаллов — с кислородом:
4Li + O2 = 2Li2O;
2Cu + O2 = 2CuO;
S + O2 = SO2
4P + 5O2 = 2P2O5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
H2SiO3 = SiO2 + H2O
3. Разложение некоторых солей:
4. Окисление сложных веществ кислородом:
CH4 + 2O2 = CO2 + H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
4NH3 + 5O2 = 4NO + 6H2O
5.Восстановление кислот-окислителей металлами и неметаллами:
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .

Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
- Основный оксид + сильная кислота → соль + вода: CuO + H2SO4 → CuSO4 + H2O
- Сильноосновный оксид + вода → гидроксид: CaO + H2O → Ca(OH)2
- Сильноосновный оксид + кислотный оксид → соль: CaO + Mn2O7 → Ca(MnO4)2
- Основный оксид + водород → металл + вода: CuO + H2 → Cu + H2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды – оксиды неметаллов и металлов в степени окисления +5 – +7. Могут реагировать с водой, щелочами, основными оксидами, амфотерными оксидами. Элемент кислотного оксида входит в состав аниона образующейся соли. Mn2O7, CrO3, SO3, N2O5.
- Кислотный оксид + вода → кислота: SO3 + H2O → H2SO4. Некоторые оксиды, к примеру SiO2, не могут вступать в реакцию с водой, поэтому их кислоты получают не прямым путём.
- Кислотный оксид + основный оксид → соль: CO2 + CaO → CaCO3
- Кислотный оксид + основание → соль + вода: SO2 + 2NaOH → Na2SO3 + H2O. Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей: Ca(OH)2 + CO2 → CaCO3 ↓ + H2O, CaCO3 + H2O + CO2 → Ca(HCO3)2
- Нелетучий оксид + соль 1 → соль 2 + летучий оксид: SiO2 + Na2CO3 → Na2SiO3 + CO2
- Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1: 2P2O5 + 4HClO4 → 4HPO3 + 2Cl2O7
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
- Na2O – оксид динатрия;
- CO – монооксид углерода;
- СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
Источник статьи: http://www.calc.ru/Formula-Oksidov.html
Оксид азота NO(II)
Молекула имеет вид:
·N=O
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
- Бесцветный газ, без запаха.
- Малорастворим в воде.
- Легко окисляется на воздухе с образованием диоксида азота:2NO+O2=2NO2.
- Взаимодействует с другими окислителями (CrO3,Cl2, KMnO4).
- Реагирует с активными металлами, водородом:K+NO=KNO2NO+2H2=N2+2H2O
NO(II) содержится в выхлопных газах автомобилей с двигателями внутреннего сгорания — проходя через каталитический конвертор, состоящий из нагретых до высокой температуры керамических ячеек, оксиды азота восстанавливаются, а СО окисляется:2NO+2CO → N2+2CO2
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре: N2+O2=2NO.
В промышленных целях NO(II) получают каталитическим окислением аммиака (в роли катализатора используется платина):4N-3H3+5O2 → 4N+2O-2+6H2O
Монооксид азота используют для получения азотной кислоты.
Лабораторный опыт №2. Моделирование построения Периодической системы Д. И. Менделеева.
Смоделируйте построение Периодической системы Д. И. Менделеева. Для этого подготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20-й. На каждой карточке укажите следующие сведения об элементе: химический символ, название, относительную атомную массу, формулу высшего оксида, гидроксида (в скобках укажите их характер – основный, кислотный или амфотерный), формулу летучего водородного соединения (для неметаллов).
Перемешайте карточки, а затем расположите их в ряд по возрастанию относительных атомных масс элементов. Сходные элементы с 1-го по 18-й расположите друг под другом: водород над литием и калий под натрием, соответственно, кальций под магнием, гелий под неоном. Сформулируйте выявленную вами закономерность в виде закона
Обратите внимание на несоответствие относительных атомных масс аргона и калия их расположению по общности свойств элементов. Объясните причину этого явления
| Химический символ | Название | Относительная атомная масса | Формула высшего оксида | Формула высшего гидроксида | Формула летучего водородного соединения |
|---|---|---|---|---|---|
| H | Водород | 1 | H2O | H2O | |
| He | Гелий | 4 | |||
| Li | Литий | 7 | Li2O(основный) | LiOH(основный) | |
| Be | Бериллий | 9 | BeO(амфотерный) | Be(OH)2(амфотерный) | |
| B | Бор | 11 | B2O3(кислотный) | H3BO3(кислотный) | BH3 |
| C | Углерод | 12 | CO2(кислотный) | H2CO3(кислотный) | CH4 |
| N | Азот | 14 | N2O5(кислотный) | HNO3(кислотный) | NH3 |
| O | Кислород | 16 | H2O | ||
| F | Фтор | 19 | HF | ||
| Ne | Неон | 20 | |||
| Na | Натрий | 23 | Na2O(основный) | NaOH(основный) | |
| Mg | Магний | 24 | MgO(основный) | Mg(OH)2(основный) | |
| Al | Алюминий | 27 | Al2O3(амфотерный) | Al(OH)3(амфотерный) | |
| Si | Кремний | 28 | SiO2(кислотный) | H2SiO3(кислотный) | SiH4 |
| P | Фосфор | 31 | P2O5(кислотный) | H3PO4(кислотный) | PH3 |
| S | Сера | 32 | SO3(кислотный) | H2SO4(кислотный) | H2S |
| Cl | Хлор | 35.5 | Cl2O7(кислотный) | HClO4(кислотный) | HCl |
| Ar | Аргон | 40 | |||
| K | Калий | 39 | K2O(основный) | KOH(основный) | |
| Ca | Кальций | 40 | CaO(основный) | Ca(OH)2(основный) |
Объяснение несоответствия относительных атомных масс аргона и калия.
Относительные атомные массы химических элементов это средние значения атомных масс изотопов элемента с учетом их долей содержания в природе.
Содержание в природе изотопа 39 K значительно больше, чем изотопа 40 K, поэтому среднее значение относительной атомной массы калия приближается к 39.
Содержание в природе изотопа 40 Ar значительно больше, чем изотопа 39 Ar, поэтому среднее значение относительной атомной массы аргона приближается к 40.
Калий является щелочным металлом, а аргон – инертным газом, поэтому аргон был расположен перед калием, т. е. в VIIIА группе, а калий – в IА группе.
Источник статьи: http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/lab/2.html
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.

Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
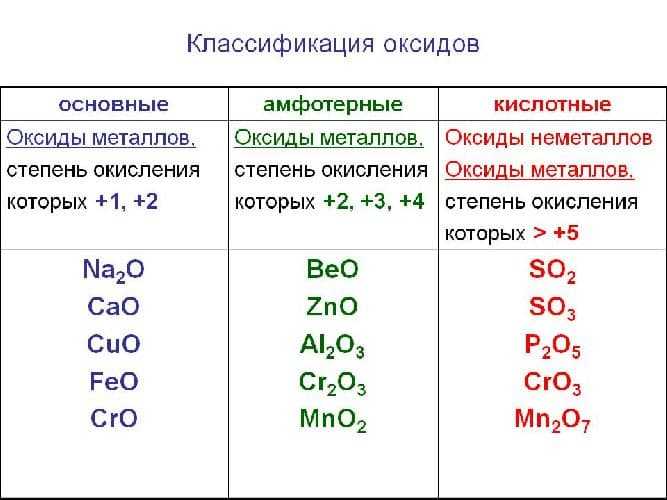
Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного
Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO)