1. Физические свойства
Полярность связи S-H значительно ниже, чем полярность связи O-H, в результате водородные связи между молекулами тиолов значительно слабее, чем у спиртов, и вследствие этого их температура кипения ниже, чем у соответствующих спиртов.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тиолы малорастворимы в воде, но хорошо растворяются в этаноле, эфире и других органических растворителях.
Низшие алифатические тиолы являются жидкостями с отвратительным запахом, причём их запах чувствуется в чрезвычайно низких концентрациях — 10−7−10−8 моль/л. Это свойство используется для одорирования бытового газа — добавка меркаптанов к газу позволяет обнаруживать утечки газа в помещениях.
Фенол
Фенол – это простейшее соединение класса фенолы, которое характеризуется непосредственно связью функциональной группы –ОН с бензольным кольцом. У атома кислорода есть неподеленная электронная пара, с помощью которой она проявляет положительный мезомерный эффект.
Физические свойства фенолов
Фенолы – это кристаллические вещества. Имеют плохую растворимость в холодной и хорошую в горячей воде и водных растворах щелочей. Обладают специфическим запахом. Характерна высокая температура плавления и кипения из-за способности создавать водородные связи.
Химические свойства фенолов
Электронная плотность на кислороде фенола уменьшается, а в ядре – увеличивается, вследствие строения соединения. Полярность связи О-Н увеличивается и возможны реакции замещения атома водорода под действием щелочей.
I. Кислотные свойства
Кислотные свойства фенолов выше, чем у спиртов. Но в отличии от них, фенолы – это слабые кислоты.
- Пропускание углекислого газа через соли фенола
C6H5-ONa + CO2 + H2O → C6H5-OH + NaHCO3
- Образование сложных эфиров
C6H5-OH + CH3-COCl → C6H5-O-CO-CH3 + HCl
II. Реакция галогенирования
Функциональная группа –ОН – заместитель первого рода, поэтому она обогащается бензольное кольцо электронной плотностью. Это значит, что заместители пойдут в орто- и параположения, относительно группы –ОН.
III. Реакция нитрования
При взаимодействии фенола с азотной кислотой образуется смесь из орто- и паранитрофенолов.
А при взаимодействии фенола с нитрующей смесью образуется 2,4,6 –тринитрофенола – это опасное взрывчатое вещество.
IV. Реакция присоединения
Фенолы – это ненасыщенные соединения, поэтому для них характерны реакции присоединения.
V. Качественные реакции
Качественной реакцией на фенолы служит взаимодействие его с кислотами Льюиса. В результате образуется комплекс фиолетового цвета.
Фенолы нашли широкое применение в получении фенилформальдегидных смол, синтетических волокон, красителей и лекарств. Пикриновая кислота – это опасное взрывчатое средство.
Смотри также:
- Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
- Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
- Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
2. Синтез
2.1. Алифатические тиолы
Старейшим методом получения тиолов является алкилирование гидросульфидов щелочных металлов с первичными и вторичными алкилгалогенидами, в качестве алкилирующих агентов также могут выступать алкилсульфаты или алкилсульфонаты. Реакция идёт по механизму бимолекулярного нуклеофильного замещения SN2 и проводится обычно в спиртовых растворах, поскольку тиолят-ионы также являются сильными нуклеофилами, побочной реакцией является их дальнейшее алкилирование до сульфидов, снижающее выход тиолов; для повышения выхода необходимо использовать большой избыток гидросульфида:
- RX + SH− RSH + X−
- RSH + SH− RS− + H2S
- RS− + RX R2S + X−
- (X = Cl, Br, I, ROSO3, RSO3)
Более удобным методом синтеза тиолов является алкилирование тиомочевины с образованием алкилтиурониевых солей и их последующим щелочным гидролизом:
Преимуществом этого метода являются легкая очистка перекристаллизацией тиурониевых солей и достаточно высокие общие выходы тиолов.
Своего рода вариацией этого метода, позволяющего получить тиолы без побочного образования сульфидов, является алкилирование с последующим гидролизом ксантогенатов:
- C2H5CS2K + RX C2H5CSSR
- C2H5CSSR + H2O RSH + C2H5 OH + CSO
или тиоацетатов:
- CH3COSK + RX CH3COSR + KX
- CH3COSR + H2O RSH + CH3COOH
В условиях кислотного катализа сероводород может присоединяться к алкенам с образованием тиолов:
- (CH3)2C=CH2 + H2S (CH3)3CSH
Модификацией этого метода является присоединение тиоуксусной кислоты к алкенам с дальнейшим гидролизом образовавшегося алкилтиоцетата:
- RCH=CH2 + CH3COSH RCH2CH2SOCCH3
- RCH2CH2SOCCH3 + OH− RCH2CH2SH + CH3COO−
2.2. Ароматические тиолы
Ароматические тиолы могут быть синтезированы восстановлением производных ароматических сульфокислот, так, например, тиофенол синтезируется восстановлением бензолсульфохлорида цинком в кислой среде:
- C6H5SO2Cl + C6H5SH
Ароматические тиолы также могут быть синтезированы взаимодействием арилдиазониевых солей с гидросульфидами:
- ArN2+ + HS− ArSH
2.3. Общие методы
Общим методом синтеза алифатических и ароматических тиолов является взаимодействие реактивов Гриньяра с серой:
- RMgX + S8 RSMgX
- RSMgX + H2O RSH
Тиильные радикалы
Свободные радикалы производные от меркаптанов, называемые тиильные радикалы, обычно используются для объяснения реакций в органическая химия и биохимия. У них есть формула RS• где R представляет собой органический заместитель, такой как алкил или арил. Они возникают или могут быть сгенерированы рядом маршрутов, но основным методом является абстрагирование H-атома от тиолов. Другой метод предполагает гомолиз органических дисульфидов. В биологии тиильные радикалы ответственны за образование дезоксирибонуклеиновых кислот, строительных блоков для ДНК. Это преобразование катализируется рибонуклеотидредуктаза (см. рисунок). Промежуточные продукты тиила также образуются путем окисления глутатион, антиоксидант в биологии. Тиильные радикалы (сероцентрированные) могут превращаться в углеродные радикалы через водород обмен атомами равновесие. Формирование углерод -центрированные радикалы могут привести к повреждению белков из-за образования C -C связи или фрагментация основной цепи.
Из-за слабости связи S-H тиолы могут функционировать как мусорщики из свободные радикалы.
Биологическое значение
Каталитический цикл рибонуклеотидредуктазы , демонстрирующий роль тиильных радикалов в создании генетического механизма жизни.
Цистеин и цистин
Как функциональная группа аминокислоты цистеина , тиоловая группа играет очень важную роль в биологии. Когда тиоловые группы двух остатков цистеина (как в мономерах или составляющих единицах) сближаются друг с другом в ходе сворачивания белка , реакция окисления может генерировать цистиновую единицу с дисульфидной связью (-S-S-). Дисульфидные связи могут вносить вклад в третичную структуру белка, если цистеины являются частью одной и той же пептидной цепи, или вносить вклад в четвертичную структуру многоэлементных белков, образуя довольно прочные ковалентные связи между различными пептидными цепями. Физическое проявление цистеин-цистинового равновесия обеспечивается технологиями выпрямления волос .
Сульфгидрильные группы в активном центре в качестве фермента могут образовывать нековалентные связи с ферментом субстратом , а также, способствуя ковалентную каталитическую активность в каталитических триадах . Остатки цистеина в активном центре являются функциональной единицей в каталитических триадах цистеиновой протеазы . Остатки цистеина могут также реагировать с ионами тяжелых металлов (Zn 2+ , Cd 2+ , Pb 2+ , Hg 2+ , Ag + ) из-за высокого сродства между мягким сульфидом и мягким металлом (см. Твердые и мягкие кислоты и основания ). Это может деформировать и инактивировать белок и является одним из механизмов отравления тяжелыми металлами .
Лекарства, содержащие тиоловые группы
6-Меркаптопурин (противоопухолевые)
Каптоприл (гипотензивные)
D-пеницилламин (противоартритные) Ауротиолат
натрия (противоартритные)
Кофакторы
Многие кофакторы (вспомогательные молекулы на небелковой основе) содержат тиолы. Биосинтез и деградация жирных кислот и родственные углеводороды с длинной цепью проводятся на леске , что анкеры растущей цепи через тиоэфир , полученный из тиольных коэнзим А . Биосинтез из метана , основной углеводород , на Земле, возникает из — за реакции , опосредованной кофермента М , 2-меркаптоэтил сульфокислоты. Тиолаты, сопряженные основания, полученные из тиолов, образуют прочные комплексы со многими ионами металлов, особенно с теми, которые классифицируются как мягкие. Стабильность тиолатов металлов сопоставима со стабильностью соответствующих сульфидных минералов.
В скунсах
Защитный спрей скунсов состоит в основном из низкомолекулярных тиолов и производных с неприятным запахом, которые защищают скунса от хищников. Совы могут охотиться на скунсов, так как у них отсутствует обоняние.
Физические свойства
Запах
Многие тиолы имеют резкий запах, напоминающий запах чеснока . Запах тиолов, особенно низкомолекулярных, часто бывает сильным и отталкивающим. Спрей от скунсов состоит в основном из низкомолекулярных тиолов и производных. Эти соединения обнаруживаются человеческим носом в концентрациях всего 10 частей на миллиард. Человеческий пот содержит ( R ) / ( S ) -3-метил-3-меркапто-1-ол (MSH), обнаруживаемый в концентрации 2 частей на миллиард и имеющий фруктовый, похожий на лук запах. (Метилтио) метантиол (MeSCH 2 SH; MTMT) представляет собой летучий тиол с сильным запахом, который также обнаруживается на уровне частей на миллиард и обнаруживается в моче самцов мышей . Лоуренс К. Кац и его сотрудники показали, что MTMT функционирует как полуохимическое соединение , активируя определенные обонятельные сенсорные нейроны мыши, привлекая самок мышей . Было показано, что медь требуется для специфического обонятельного рецептора мыши, MOR244-3, который очень чувствителен к MTMT, а также к различным другим тиолам и родственным соединениям. Был идентифицирован человеческий обонятельный рецептор OR2T11 , который в присутствии меди очень чувствителен к одорантам газа (см. Ниже) этантиолу и трет- бутилмеркаптану, а также другим тиолам с низкой молекулярной массой, включая аллилмеркаптан, обнаруженный у человека. чесночное дыхание и сильно пахнущий циклический сульфид тиетан .
Тиолы также несут ответственность за класс винных дефектов, вызванных непреднамеренной реакцией между серой и дрожжами, а также «вонючим» запахом пива, подвергшегося воздействию ультрафиолета.
Не все тиолы имеют неприятный запах. Например, фуран-2-илметантиол способствует аромату обжаренного кофе , тогда как меркаптан грейпфрута , монотерпеноид тиол, отвечает за характерный запах грейпфрута . Эффект последнего соединения присутствует только при низких концентрациях. Чистый меркаптан имеет неприятный запах.
Распределители природного газа были обязаны добавлять тиолы, первоначально этантиол , в природный газ (который, естественно, не имеет запаха) после смертоносного взрыва в Нью-Лондонской школе в Нью-Лондоне, штат Техас , в 1937 году. Многие газораспределители использовали одорированный газ до этого события. Большинство газовых одорантов, используемых в настоящее время, содержат смеси меркаптанов и сульфидов, с трет- бутилмеркаптаном в качестве основного компонента запаха в природном газе и этантиолом в сжиженном нефтяном газе (СНГ, пропан). В ситуациях, когда тиолы используются в коммерческой промышленности, например, в танкерах для перевозки сжиженного нефтяного газа и в системах обработки сыпучих материалов, для уничтожения запаха используется окислительный катализатор . Катализатор окисления на основе меди нейтрализует летучие тиолы и превращает их в инертные продукты.
Точки кипения и растворимость
Тиолы слабо связаны водородными связями как с молекулами воды, так и между собой. Следовательно, они имеют более низкие температуры кипения и менее растворимы в воде и других чем спирты с аналогичной молекулярной массой. По этой же причине тиолы и соответствующие изомеры сульфидных функциональных групп имеют схожие характеристики растворимости и температуры кипения, в то время как то же самое нельзя сказать о спиртах и их соответствующих изомерных простых эфирах.
Склеивание
Связь S-H в тиолах слабая по сравнению со связью O-H в спиртах. Для CH 3 X − H энтальпии связи равны365,07 ± 2,1 ккал / моль для X = S и440,2 ± 3,0 ккал / моль для X = O. Отрыв атома водорода от тиола дает тиильный радикал с формулой RS • , где R = алкил или арил.
Химические свойства
Кислотность
Тиолы являются слабыми кислотами, образуя с гидроксидами щелочных (b) и щелочноземельных металлов (b) растворимые в воде тиоляты (b) (меркаптиды), с солями тяжёлых металлов — нерастворимые меркаптиды. Являются значительно более сильными кислотами, чем соответствующие кислородные спирты (b) .
Константа диссоциации (b) |
|
|---|---|
н-C3H7SH |
|
трет-C4H9SH |
Тиолят-анионы высоконуклеофильны, и многие реакции замещения водорода группы -SH протекают через промежуточное образование тиолятов.
Так, тиолы алкилируются под действием алкилгалогенидов:
- RS−+R1Hal→RSR1+Hal−{\displaystyle {\mathsf {RS^{-}+R^{1}Hal\rightarrow RSR^{1}+Hal^{-}}}}
Тиолы в присутствии оснований (пиридина (b) , третичных аминов) ацилируются с образованием S-ацилпроизводных:
- RSH+R1C(O)Hal→R1C(O)SR+HX{\displaystyle {\mathsf {RSH+R^{1}C(O)Hal\rightarrow R^{1}C(O)SR+HX}}}
Нитрозирование (b) тиолов азотистой кислотой (b) или нитрозилхлоридом (b) ведёт к неустойчивым окрашенным нитрозилтиолам (тионитритам):
- RSH+HNO2→RSNO+H2O{\displaystyle {\mathsf {RSH+HNO_{2}\rightarrow RSNO+H_{2}O}}}
Эта реакция используется как качественная реакция на тиолы.
Присоединение
Тиолы вступают в реакции присоединения (b) к ацетиленовым, этиленовым и алленовым углеводородам. Реакция может протекать по нуклеофильному, электрофильному либо радикальному механизму.
Окисление
Тиолы окисляются самым широким спектром окислителей (кислород, пероксиды, оксиды азота, галогены и др.). Мягкие окислители (йод, алифатические сульфоксиды (b) , активированный диоксид марганца и т. п.) реагируют с тиолами с образованием дисульфидов (b) :
- 2RSH→ORSSR{\displaystyle {\mathsf {2RSH{\xrightarrow{}}RSSR}}}
которые, в свою очередь, при реакции с хлором образуют тиохлориды:
- RSSR+Cl2→2RSCl{\displaystyle {\mathsf {RSSR+Cl_{2}\rightarrow 2RSCl}}}
При действии более жёстких окислителей (например, перманганата) сначала образуются сульфиновые (b) кислоты и далее — сульфокислоты (b) :
- RSH→ORSO2H→ORSO3H{\displaystyle {\mathsf {RSH{\xrightarrow{}}RSO_{2}H{\xrightarrow{}}RSO_{3}H}}}
В случае окисления тетраацетатом свинца (CH3COO)4Pb в присутствии спиртов окисление идёт с образованием сульфинатов — соответствующих эфиров сульфиновых кислот:
- RSH+CH3OH→ORSO2OCH3{\displaystyle {\mathsf {RSH+CH_{3}OH{\xrightarrow{}}RSO_{2}OCH_{3}}}}
В присутствии воды тиолы окисляются хлором до соответствующих сульфонилхлоридов:
Подготовка
В промышленности метантиол получают реакцией сероводорода с метанолом . Этот метод используется для промышленного синтеза метантиола :
- СН 3 ОН + Н 2 S → СН 3 SH + Н 2 О
Такие реакции проводятся в присутствии кислотных катализаторов. Другой основной путь получения тиолов включает добавление сероводорода к алкенам . Такие реакции обычно проводят в присутствии кислотного катализатора или УФ-света. Также использовалось замещение галогенидов с использованием подходящего органического галогенида и сероводорода натрия.
Другой метод включает алкилирование гидросульфида натрия .
- RX + NaSH → RSH + NaX (X = Cl, Br, I)
Этот метод используется для производства тиогликолевой кислоты из хлоруксусной кислоты .
Лабораторные методы
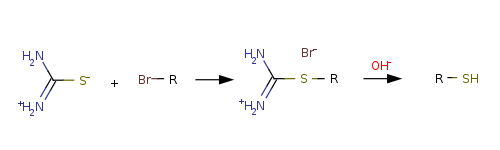
В общем, на типичном лабораторный масштабе, прямая реакция галогеналкана с гидросульфидом натрия в эффективном за счет конкурирующего формирования сульфидов. Вместо этого алкилгалогениды превращаются в тиолы посредством S- алкилирования тиомочевины . Этот многоэтапный процесс с одним резервуаром протекает через посредство изотиоурониевой соли , которая гидролизуется на отдельной стадии:
- CH 3 CH 2 Br + SC (NH 2 ) 2 → [CH 3 CH 2 SC (NH 2 ) 2 ] Br
- [CH 3 CH 2 SC (NH 2 ) 2 ] Br + NaOH → CH 3 CH 2 SH + OC (NH 2 ) 2 + NaBr
Путь тиомочевины хорошо работает с первичными галогенидами, особенно активированными. Вторичные и третичные тиолы получить труднее. Вторичные тиолы можно получить из кетона через соответствующие дитиокетали . Родственный двухстадийный процесс включает алкилирование тиосульфата с образованием тиосульфоната (« соль Бунте ») с последующим гидролизом. Метод иллюстрируется одним синтезом тиогликолевой кислоты :
- ClCH 2 CO 2 H + Na 2 S 2 O 3 → Na [O 3 S 2 CH 2 CO 2 H] + NaCl
- Na [O 3 S 2 CH 2 CO 2 H] + H 2 O → HSCH 2 CO 2 H + NaHSO 4
Литийорганические соединения и реактивы Гриньяра реагируют с серой с образованием тиолатов, которые легко гидролизуются:
- RLi + S → RSLi
- RSLi + HCl → RSH + LiCl
Фенолы можно превратить в тиофенолы путем перегруппировки их О- арилдиалкилтиокарбаматов.
Тиолы получают восстановительным деалкилированием сульфидов, особенно бензилпроизводных и тиоацеталей.
Тиофенолы получают S -арилированием или заменой уходящей группы диазония на сульфгидрильный анион (SH — ):
- ArN+ 2+ SH — → ArSH + N 2
Химическая реактивность
Тиолы похожи на спирты , в которых кислород гидроксильной группы -ОН заменен атомом серы , поэтому их также называют тиоспиртом . Кислород и сера имеют схожие химические свойства, потому что они принадлежат к одной группе (одному столбцу) периодической таблицы . Тиолы образуют тиоэфиры , тиоацетали и тиоэфиры , в которых один или несколько атомов кислорода заменены атомом серы.
Многие тиолы представляют собой бесцветные жидкости с запахом, похожим на запах чеснока . Запах довольно сильный и отталкивающий: тиолы прочно связываются с белками кожи. Это свойство частично отвечает за стойкий запах, производимый скунсом, когда он излучает дурно пахнущую жидкость. Этилмеркаптан ( этантиол ) или тетрагидротиофен добавляют в природный газ (который обычно не имеет запаха) для обнаружения утечек.
Тиолы обладают восстанавливающими свойствами. Они разрушаются окислителями, такими как перекись водорода , гипохлориты , хлор и металлы с высокой степенью окисления. Продукты окисления тиола варьируются от серы до диоксида и триоксида серы .
Тиолы реагируют, в частности, с ионами ртути в соответствии с:
- ЧАСграмм2++2р-SЧАС → ЧАСграмм(S-р)2+2ЧАС+{\ Displaystyle \ mathrm {Hg} ^ {2 +} + 2 \ mathrm {R-SH} \ \ rightarrow \ \ mathrm {Hg (SR)} _ {2} +2 \ mathrm {H} ^ {+}}
Это свойство принесло им название «меркаптан», то есть «улавливающий ртуть».
Использует
Природный газ является взрывным и потенциально удушающим . Он не имеет запаха, который может обнаружить человек. Для того, чтобы включить как можно быстрее отказаться от отслеживания внутреннего утечки газа (от газовой сети или в бутылках), с середины XX — го века, мы добавим еще один газ, очень ароматную низкую дозу (как только прибывает на территории Франции). Долгое время использовался меркаптан (из-за очень сильного запаха тухлой капусты ). Он был заброшен, потому что он был слишком агрессивным для газовых труб. Он заменен тетрагидротиофеном (THT), циклическим соединением серы .
Примеры тиолов
- Метантиол — CH3SH
- Этантиол — С2ЧАС5SH
- 1-пропантиол — С3ЧАС7SH [п-пропилмеркаптан]
- 2-пропантиол — CH3CH (SH) CH3
- Аллил меркаптан — CH2= CHCH2SH
- Бутантиол — С4ЧАС9SH [п-бутилмеркаптан]
- терт-Бутилмеркаптан — (CH3)3CSH [т-бутилмеркаптан]
- Пентантиолы — С5ЧАС11SH
- Тиофенол — С6ЧАС5SH
- Димеркаптоянтарная кислота
- Тиоуксусная кислота
- Коэнзим А
- Глутатион
- Металлотионеин
- Цистеин
- 2-меркаптоэтанол
- Дитиотреитол /дитиоэритрит (ан эпимерный пара)
- 2-меркаптоиндол
- Грейпфрутовый меркаптан
- Фуран-2-илметантиол
- 3-меркаптопропан-1,2-диол
- 3-меркапто-1-пропансульфоновая кислота
- 1-гексадекантиол
- Пентахлорбензолтиол
Тиол
Фотоприсоединение тиолов к двойной связи углерод — углерод дает продукты, стереохимия которых зависит от структуры алке-на.
Окисление тиолов системой Ti111 — Н О2 или солями CeTV приводит к последовательному возникновению тиильных, сульфиниль-ных и сульфонильных радикалов , из которых и образуются конечные продукты реакции. С наибольшей легкостью тиолы окисляются до дисульфидов. При окислении тетранитрометаном помимо дисульфида образуется также сульфиновая кислота.
Взаимодействие тиолов и их ионов с сульфенилгалогенидамн приводит к дисульфидам ( см. разд. В аналогичные реакции, приводящие к образованию связи S — S, вступают и другие S-нуклеофилы, в том числе тиокарбоновые и дитиокарбоновые кислоты, днтиокарбаминовые кислоты, ксантогенаты, а также такие соединения, как тиомочевина, тиокарбоксамиды.
Окисление тиолов резко отличается от окисления спиртов. В зависимости от природы окислителя продуктами окисления ТИОЛОЕ являются дисульфиды R-S-S-R, сульфииовые RSC H или сульфоновые RSOsH кислоты.
Для тиолов не чужды и аналогичные со спиртами свойства положим, реакция тарификации с образованием тиоэфирок.
Окисление тиола установлено также при облучении инсулина. Облучение при рН 3 приводит к образованию геля. Дисульфидные связи также могут быть восстановлены при облучении; подобно тому как цистин и цистамин могут быть восстановлены в тиольную форму ( стр
Однако всегда важно принимать во внимание, что изменения, затрагивающие связи S-S и S — Н — могут быть как следствием денатурации, так и первичными последствиями облучения.
Действие тиолов ( а также и других соединений серы) в полиэтилене синергически усиливается содержащейся в полимере сажей. Таким путем достигается сочетание светозащитного действия сажи с повышенной эффективностью серусодержащей составляющей при термоокислительном старении.
Тиоацетали тиолов, меркаптоалканолэфиров и особенно эфиров меркапто-карбоновых кислот, например бензальдегидтиоацеталь нонилового эфира тио-гликолевой кислоты и бензофенонтиоацеталь октилового эфира тиоглйколевой кислоты , применяются для стабилизации ПВХ.
Кроме тиолов, эту реакцию дают также тиокислоты RCOSH. Если R — первичный или вторичный алкил, возникает красная окраска, если R — третичный алкил или арил — окраска вначале зеленая, а затем красная.
|
Температура кипения тиолов и спиртов. |
Растворимость тиолов в воде низкая. Например, при нормальной температуре в 100 мл воды растворяется 1 5 г метантиола. Степень ассоциации тиолов за счет водородной связи, определявшаяся по химическому сдвигу бдн в ЯМР-спектрах , оказалась крайне незначительной.
Присоединение тиолов к сопряженным диенам протекает значительно сложнее.
Распад тиолов или дисульфидов в растворе на радикалы всегда является обратимой реакцией, поэтому только на основании продуктов реакции трудно установить, какое количество тиильно-го радикала образуется.
Присоединение тиолов к непредельным соединениям может также протекать по ионному механизму.
Реакции тиолов с карбонильными соединениями металлов обычно происходят при более мягких условиях по сравнению с реакциями дисульфидов. В качестве растворителей чаще всего используют углеводороды и сами тиолы.
Биологическая роль
Тиолы играют важную роль в поддержании окислительно — восстановительное состояния из клеток ( гомеостаза ) и в деятельности значительной части ферментов , катализирующих окислительно — восстановительные реакции .
Редокс гомеостаз обеспечивается , в частности , с помощью глутатиона , A трипептид , содержащего тиол, который постоянно поддерживается в восстановленном состоянии с помощью глутатионредуктазы, фермент , поставляемого с NADPH по пентозам маршрута фосфата . Восстановленный глутатион обеспечивает клеточную детоксикацию тяжелых металлов, таких как ртуть (после реакции, представленной в ), восстановление пероксидов ( глутатионпероксидаза ), восстановление дисульфидных мостиков между клеточными белками и детоксикацию ароматических органических соединений ( глутатион S -трансфераза ).
Цистеина ( аминокислота , несущая тиол) присутствует в активном центре ряда ферментов и часто играет активную роль в реакциях переноса электрона. Так обстоит дело, например, с тиоредоксинами . Тиоловые группы цистеинов также часто участвуют в связывании кофакторов металлов в ферментах ( Zn , Ni ), а также в связывании кластеров железо-сера , часто участвующих в реакциях переноса электронов.
Применение
За счёт сильного неприятного запаха тиолы, в частности, этантиол (b) , используются для добавления в природные газы, не имеющие запаха, для обнаружения утечки по запаху. Согласно правилам Ростехнадзора (b) , запах этантиола в одорированном природном газе должен ощущаться обонянием человека при концентрации природного газа в воздухе не более 20 % об. от нижнего предела взрываемости (b) .
За счёт лёгкого гомолитического разрыва S-H связи с образованием малоактивных тиильных радикалов (b) тиолы используются как ингибиторы (b) радикальных цепных реакций (b) , в частности, процессов автоокисления (b) и радикальной полимеризации (b) :
- ROO⋅+R′SH → ROOH+R′S⋅{\displaystyle {\mathsf {ROO\cdot +R’SH\ \rightarrow \ ROOH+R’S\cdot }}}
- ∼MM⋅+R′SH → ∼MMH+R′S⋅{\displaystyle {\mathsf {\sim MM\cdot +R’SH\ \rightarrow \ \sim MMH+R’S\cdot }}}