Вобэнзим и Флогензим
Вобэнзим состоит из смеси ферментов (100 мг панкреатина, 60 мг папаина, 45 мг бромелаина, 10 мг липазы, 24 мг трипсина, 1 мг химотрипсина, 50 мг рутина)
Этот препарат обладает иммуномодулирующим, фибринолитическим и вторичным анальгезирующим действием, что важно при лечении воспалений и отеков. . Вобэнзим положительно влияет на течение воспалительного процесса, ограничивает возникновение патологических аутоиммунных и иммунокомплексных процессов
Препарат ускоряет расщепление токсичных метаболитов и некротических тканей, что приводит к более быстрому заживлению гематом и снятию отеков. Кроме того, он разрушает патологические иммунные комплексы (ИК) и ускоряет их выведение, нормализует вязкость крови и улучшает микроциркуляцию, что приводит к лучшему снабжению тканей организма питательными веществами и кислородом.
Вобэнзим положительно влияет на течение воспалительного процесса, ограничивает возникновение патологических аутоиммунных и иммунокомплексных процессов. Препарат ускоряет расщепление токсичных метаболитов и некротических тканей, что приводит к более быстрому заживлению гематом и снятию отеков. Кроме того, он разрушает патологические иммунные комплексы (ИК) и ускоряет их выведение, нормализует вязкость крови и улучшает микроциркуляцию, что приводит к лучшему снабжению тканей организма питательными веществами и кислородом.
Флогензим – это комбинация различных ферментов и флавоноидов с противовоспалительными и иммунными свойствами. Смесь ингредиентов в продукте, а также отдельные ферменты бромелаин, трипсин и рутозид уменьшают отек, вызванный травмой.
Ферменты в лекарстве вызывают протеолиз макромолекул во внеклеточной жидкости и распад медиаторов воспаления (таких, как гистамин). Кроме того, поражения в месте протеазы разрушают накопленный фибрин и другие вещества, разрушают микротромбы, что приводит к улучшению микроциркуляции, уменьшению отека и способствует регенерации поврежденных тканей.
Ферментный препарат принимают внутрь, рекомендуется проглотить таблетку, не разжевывая, за 0,5-1 час до еды, запивая стаканом воды.
В биохимии
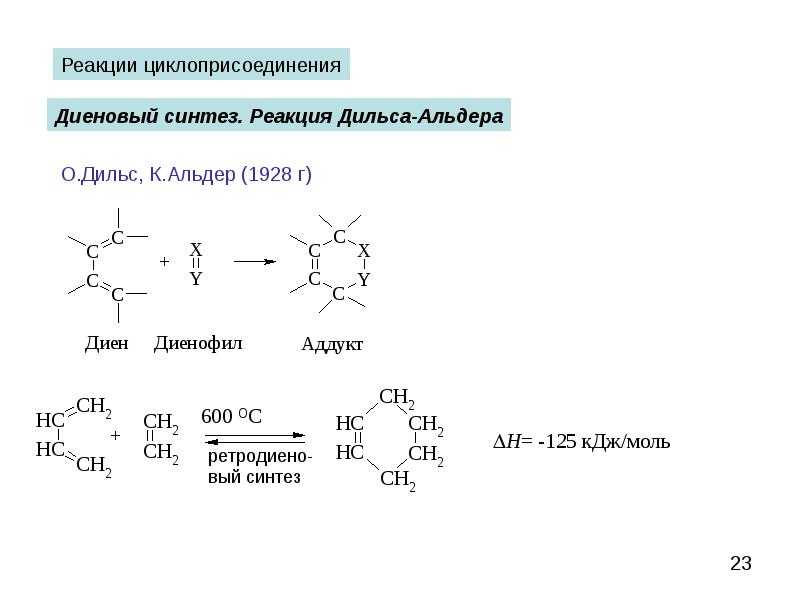
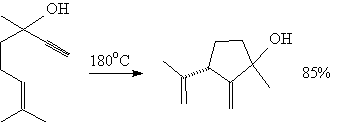
Реакции -циклоприсоединения встречаются во вторичном метаболизме (b) разнообразных организмов. Протекающие в живой природе реакции Дильса — Альдера относятся к процессам биосинтеза (b) поликетидов (b) , изопреноидов (b) , фенилпропаноидов (b) , а также алкалоидов (b) и других продуктов смешанного биосинтеза. Катализирующие эти реакции ферменты — дильсальдеразы — представляют собой белки (b) или РНК (b) . Возможность ферментативного (b) катализа для реакций этого типа представляется весьма интригующим аспектом, так как высокое сходство структуры переходного состояния и продукта реакции (аддукта (b) ) предполагает конкурентное ингибирование (b) последним специфического фермента, катализирующего реакцию. И действительно, полученные моноклональные антитела (b) , проявляющие высокоспецифичную дильсальдеразную активность, как и ожидалось, ингибируются продуктом реакции. Катализ же рибозимами низкоспецифичен, необходимой частью активного рибозима является координированный ион переходного металла (b) , поэтому считается, что катализ рибонуклеиновой кислотой подобен катализу кислотой Льюиса. Предполагается, что изучение биосинтетических реакций Дильса — Альдера может привести к открытию новых механизмов ферментативного катализа. Возможно, вступающие в реакцию диеновый компонент и диенофил дестабилизируются деформациями кручения (b) , что способствует понижению энергии активации (b) и эффективному протеканию реакции в физиологических условиях (b) .
Стереоселективная реакция Дильса — Альдера
Первые исследования стереоселективных вариантов реакции Дильса — Альдера были основаны на использовании хиральных (b) диенофилов, в частности, сложных эфиров (b) непредельных карбоновых кислот (b) с хиральными спиртами (b) . При этом было обнаружено, что на стереоселективность (b) реакции сильно влияют условия её проведения. Например, реакция между бутадиеном и (–)-диметилфумаратом при нагревании протекала с низкой стереоселективностью, а использование катализатора AlCl3 приводило к получению продукта с оптической чистотой (b) 72—76%.
Продуктивным подходом в данной области оказалось использование оксазолидиновой методологии Эванса, в рамках которой в качестве диенофилов выступали α,β-ненасыщенные N-ацилоксазолидиноны. Согласно предложенной модели, данные реагенты образуют хелаты (b) с кислотой Льюиса ((C2H5)2AlCl), в которых одна из сторон пространственно блокируется заместителем в оксазолидиноне, что и определяет стереоселективность реакции. Кроме того, получаемые продукты можно разлагать с регенерацией оксазолидиноновых фрагментов. Этот и подобные подходы, в которых диены и диенофилы содержали удаляемые вспомогательные хиральные группы, были использованы в синтезе многих природных соединений.
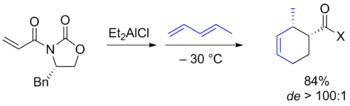 Стереоселективная реакция Дильса — Альдера с использованием хиральных оксазолидинонов
Стереоселективная реакция Дильса — Альдера с использованием хиральных оксазолидинонов
Основные понятия ретросинтетического анализа (продолжение)
Таблица 1. Мощные реакции.
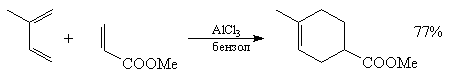
2. Реакция Дильса-Альдера с хинонами
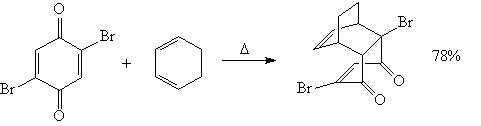
3. Гетеро-реакция Дильса-Альдера
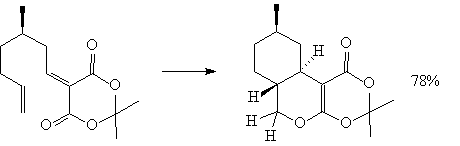
4. Аннелирование по Робинсону
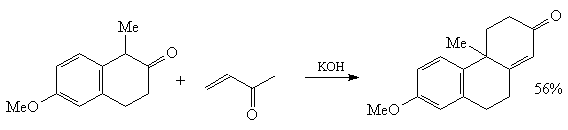
5. Парциальное восстановление по Берчу
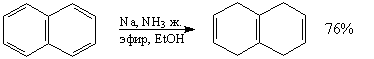
6. Катионная -циклизация
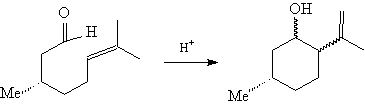
7. Внутримолекулярная радикальная -циклизация
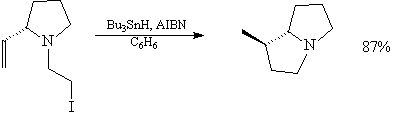
8. Альдольная конденсация
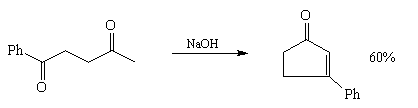
9. Ацилоиновая конденсация, приводящая к
карбоциклам
10. Внутримолекулярное нуклеофильное замещение,
приводящее к циклизации
11. Внутримолекулярное ацилирование по
Фриделю-Крафтсу
12. Катионные перегруппировки
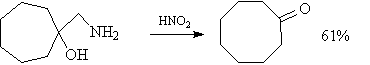
13. Конденсация Манниха
14. Еновая реакция
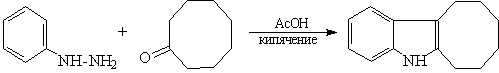
15. Синтез индолов по Фишеру
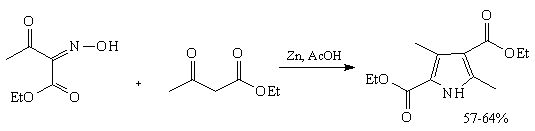
16. Синтез пирролов по Кнорру
17. Сигматропная перегруппировка Кляйзена
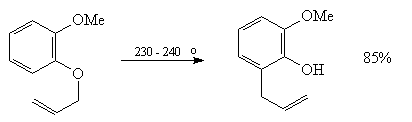
18. Сигматропная окси-перегруппировка Коупа
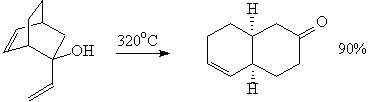
19. Олефинирование по Виттигу
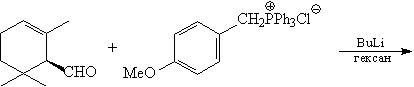
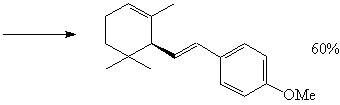
Первый вопрос, который возникает в ходе
ретросинтетического анализа: в каком месте
молекулы лучше всего провести расчленение?
М.Смитом был разработан формализованный подход
для решения этой задачи . Связям С-С
приписывается различное старшинство, в
зависимости от положения этих связей в скелете
молекулы и характера присоединенных к ним
функциональных групп. По определенным правилам
все связи С-С получают то или иное число
«баллов». Первой разрывают связь, получившую
максимальный «балл». Затем эту процедуру
повторяют для полученных «осколков»
молекулы и т.д. до тех пор, пока не придут к
доступным соединениям. Ниже приведен один пример
использования такого алгоритма для анализа ТМ5
.
Анализ
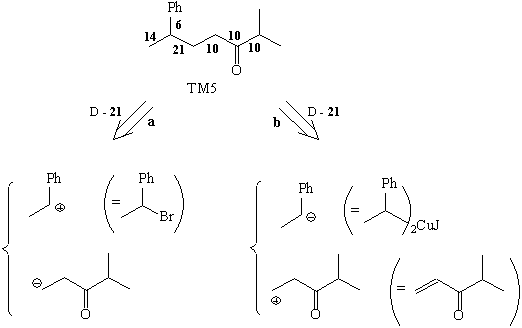
Именно разбиение ТМ5 по способу (b) дает
возможность предложить доступные реагенты для
рационального осуществления синтеза.
Синтез
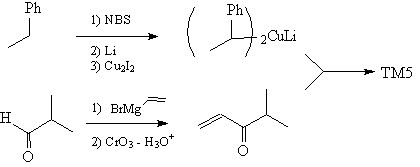
Правила М. Смита для определения
старшинства связей достаточно сложны и здесь не
приводятся. На практике гораздо лучше стремиться
увидеть в ТМ определенные «ключевые»
структурные элементы, подсказывающие, какой
именно трансформ следует провести.
Анализ соединения ТМ6 легко провести,
используя мощный упрощающий трансформ —
трансформ Дильса-Альдера.

Какие особенности в строении ТМ6 позволили
нам применить Tf Дильса-Альдера? Очевидно, это
наличие шестичленного карбоцикла с двойной
связью.
Ясно, что и во многих других (но не во всех)
случаях, когда молекула содержит названные
структурные элементы, можно использовать в
анализе Tf Дильса-Альдера. Аналогично в ТМ7 легко
увидеть структурные элементы, позволяющие
провести Tf Гриньяра.
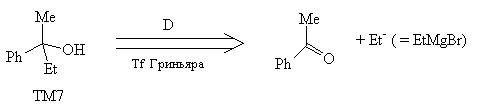
Необходимые и достаточные элементы в
строении молекулы, позволяющие проводить
определенный трансформ, называются ретронами.
Ретроны именуют по названию трансформа.

Целевая молекула может содержать необходимый,
но не достаточный элемент для проведения
трансформа. В таком случае следует говорить о частичном
ретроне.
Например, в ТМ8 присутствует частичный
ретрон Дильса-Альдера:
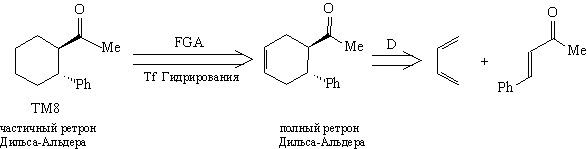
Залогом успешного проведения
ретросинтетического анализа является умение видеть
ретроны, содержащиеся в ТМ и в соответствии с
этими ретронами проводить расчленения.
Региоселективность реакции
При введении в реакцию Дильса — Альдера несимметричных реагентов наблюдается региоселективное образование продуктов циклоприсоединения. Так, при реакции 1-замещённых диенов с несимметричными алкенами преимущественно образуются продукты, в которых заместители расположены у соседних атомов углерода (так называемые «орто»-продукты), а продукты с 1,3-замещением («мета»-продукты) получаются в меньшем количестве. Эта закономерность наблюдается для ряда заместителей в молекуле диена, а также различных диенофилов. Для её объяснения можно рассматривать возникающее под действием заместителей распределение зарядов в молекулах реагентов. Согласно такой модели, избирательность реакции должна возрастать с увеличением донорной способности заместителя в диене и акцепторной способности заместителя в диенофиле.
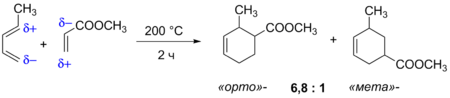 Региоселективность реакции Дильса — Альдера
Региоселективность реакции Дильса — Альдера
В реакциях 2-замещённых диенов общей закономерностью является образование «пара»-продуктов, которое также может быть объяснено на основании поляризации реагентов.
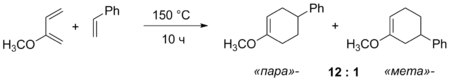 Региоселективность реакции Дильса — Альдера
Региоселективность реакции Дильса — Альдера
Экстремофилы и промышленность
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии. В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
- Источники
- Коровкин Б. Ф. – Ферменты в жизни человека / Б. Ф. Коровкин. – М.: Медицина, 2016 г. – 770 c.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Извозчикова Нина Владиславовна
Специальность: инфекционист, гастроэнтеролог, пульмонолог.
Общий стаж: 35 лет.
Образование: 1975-1982, 1ММИ, сан-гиг, высшая квалификация, врач-инфекционист.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Литература
- Оригинальные работы
Diels O, Alder K. Synthesen in der hydroaromatischen Reihe (нем.) // Justus Liebigs Annalen der Chemie. — 1928. — Bd. 460, Nr. 1. — S. 98—122. — doi (b) :10.1002/jlac.19284600106.
- Русскоязычные источники
- Смит В. А., Дильман А. Д.Глава 22. Реакция Дильса — Альдера. Часть IОсновы современного органического синтеза.— М.: Бином. Лаборатория знаний, 2009.— С.605—642.— ISBN 978-5-94774-941-0.
- Смит В. А., Дильман А. Д.Глава 23. Реакция Дильса — Альдера. Часть IIОсновы современного органического синтеза.— М.: Бином. Лаборатория знаний, 2009.— С.643—681.— ISBN 978-5-94774-941-0.
Иммуномодуляция
Известно, что когда иммунная система организма ослаблена, мы становимся уязвимыми и с большей вероятностью заболеем инфекционными заболеваниями. Также при слабом иммунитете наш организм вырабатывает антитела, которые атакуют ткани и клетки человеческого организма, и это проявляется при различных аутоиммунных заболеваниях (ревматоидный артрит, системная красная волчанка, интерстициальный нефрит и т. д.).
Хотя эти заболевания связаны с выработкой антител, также важны для их развития специфические Т-лимфоциты. Узнав аллоантиген, Т-клетки в организме активируются и секретируют цитокины. Эти секретируемые цитокины могут стимулировать клетки различных систем, например клетки ретикулоэндотелиальной системы кожи, и вызывать реакцию гиперчувствительности замедленного типа (IV).
Когда Т-лимфоциты распознают бета-клетки поджелудочной железы или антигены в головном мозге, возможно развитие сахарного диабета 1 типа и рассеянного склероза
Таким образом, важно понимать, что обучение контролю активности Т-лимфоцитов может лечить аутоиммунные заболевания. . Для активности Т-лимфоцитов важны поверхностные молекулы, особенно CD4, CD44, B7-1
Исследования показали, что эти молекулы действуя на ферменты (трипсин) деградировали и снижали активность Т-клеток. Т-клетки не распознают растворимые антигены, но подвергаются воздействию антигена, присутствующего на антигенпрезентирующей клетке (макрофаги, дендритные клетки, В-лимфоциты).
Для активности Т-лимфоцитов важны поверхностные молекулы, особенно CD4, CD44, B7-1. Исследования показали, что эти молекулы действуя на ферменты (трипсин) деградировали и снижали активность Т-клеток. Т-клетки не распознают растворимые антигены, но подвергаются воздействию антигена, присутствующего на антигенпрезентирующей клетке (макрофаги, дендритные клетки, В-лимфоциты).
Важными в этом процессе распознавания являются рецепторы антигена Т-лимфоцитов (TCR), которые специфически связываются с молекулой основного антигена тканевой совместимости (HLA) и фрагментом процессированного пептидного антигена. Чтобы Т-клетка активировалась, она должна распознавать около 100-300 таких комплексов HLA / пептидный антиген, что является порогом для ее активации.
Этот порог не всегда одинаков и варьируется в зависимости от количества дополнительных молекул, а также от молекул, чувствительных к трипсину. По мере уменьшения количества дополнительных поверхностных молекул порог активации Т-лимфоцитов увеличивается, и, таким образом, их активации и эффектов можно избежать.
Стереохимия реакции
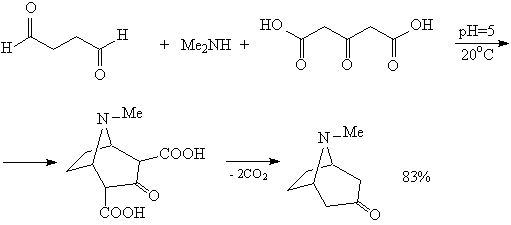
Поскольку реакция Дильса — Альдера протекает как согласованный процесс через циклическое переходное состояние (b) , конфигурация продукта реакции определяется конфигурацией исходных реагентов. Так, из (Z)-алкенов образуются цис-продукты, а из (E)-алкенов — транс-продукты. Подобный принцип применим и для заместителей в 1 и 4 положениях диена: если конфигурации двух двойных связей диена совпадают, то в продукте эти заместители находятся в цис-расположении.
Было замечено, что при реакции циклических диенов с различными диенофилами образуется, в основном, один из двух возможных диастереомеров с эндо-расположением заместителей диенофила. Соотношение эндо— и экзо-изомеров может принимать различные значения (от 3:2 до 20:1). Данная закономерность называется эндо-правилом Альдера. Эндо-правило выполняется и для реакций с участием ациклических 1,4-дизамещённых диенов. Наблюдаемые результаты объясняются вторичными орбитальными взаимодействиями, которые возникают при сближении акцепторной группы диенофила с С2- и С3-атомами диена. Данные взаимодействия стабилизируют переходное состояние и способствуют образованию эндо-продукта.
История
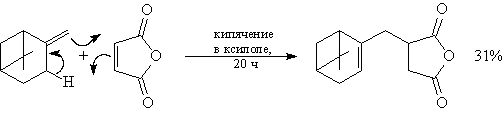
В 1902 году в лаборатории И. Тиле аспирантом В. Альбрехтом была проведена реакция между циклопентадиеном (b) и бензохиноном (b) с целью получения сопряжённого полиена, однако вместо ожидаемого продукта конденсации было получено два дикетона — продукты присоединения одной или двух молекул циклопентадиена по двойным связям хинона. Строение полученных веществ не было установлено, а реакция не получила дальнейшего развития в этой лаборатории.
Также протекание реакции Дильса — Альдера наблюдали в 1910 году С. В. Лебедев (b) (при димеризации изопрена (b) ), а в 1920 году — Г. фон Эйлер и К. Джозефсон (при взаимодействии изопрена с бензохиноном).
Систематическое изучение реакции между 1,3-диенами (b) и сопряжёнными кетонами (b) было представлено Отто Дильсом (b) и Куртом Альдером (b) в 1928 году в журнале Justus Liebigs Annalen der Chemie. Авторы статьи привели свидетельства общего характера реакции, а также с уверенностью указали на возможность её использования в синтезе природных соединений, при этом заявив:
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:
- Концентрация субстрата.
Увеличение концентрации субстрата ведет к ускорению реакции. Чем больше молекул действующего вещества, тем быстрее протекает реакция, поскольку задействовано больше активных центров. Однако ускорения возможно только до тех пор, пока не задействуются все молекулы фермента. После этого, даже повышение концентрации субстрата не приведет к ускорению реакции.
- Температура.
Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталитическая активность фермента теряется навсегда.
- Кислотность.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Катализатор и не только
Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
Биохимические свойства
Хотя при участии ферментов в природе происходит огромное количество реакций, но все они могут быть разделены на 6 категорий. Соответственно, каждая из этих шести реакций протекает под влиянием определенного типа ферментов.
Реакции при участии энзимов:
- Окисление и восстановление.
Ферменты, участвующие в этих реакциях, называются оксидоредуктазами. В качестве примера можно вспомнить как, алкогольдегидрогеназы преобразуют первичные спирты в альдегид.
- Реакция переноса группы.
Ферменты, благодаря которым происходят эти реакции, называются трансферазами. Они обладают умением перемещать функциональные группы от одной молекулы к другой. Так происходит, например, когда аланинаминотрансферазы перемещают альфа-аминогруппы между аланином и аспартатом. Также трансферазы перемещают фосфатные группы между АТФ и другими соединениями, а из остатков глюкозы создают дисахариды.
- Гидролиз.
Гидролазы, участвующие в реакции, умеют разрывать одинарные связи, добавляя элементы воды.
- Создание или удаление двойной связи.
Этот вид реакций негидролитическим путем происходит при участии лиазы.
- Изомеризация функциональных групп.
Во многих химических реакциях положение функциональной группы изменяется в пределах молекулы, но сама молекула состоит из того же количества и типов атомов, что были до начала реакции. Иными словами, субстрат и продукт реакции являются изомерами. Такого типа трансформации возможны под влиянием ферментов изомеразы.
- Образование одинарной связи с устранением элемента воды.
Гидролазы разрушают связь, добавляя в молекулу элементы воды. Лиазы осуществляют обратную реакцию, удаляя водную часть из функциональных групп. Таким образом, создают простую связь.
История открытия
Энзим в переводе с греческого означает «закваска». А открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс. Голландец назвал его fermentum, что в переводе означает «брожение». Затем, почти тремя веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки. А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живым организмом. Он также дал ему свое название – «зимаза». Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы. Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов. И лишь 1897 год положил конец всем научным спорам: оба термины (энзим и фермент) решено использовать как абсолютные синонимы.
Разнообразные эффекты системных ферментов
Как упоминалось ранее, благодаря различным клиническим эффектам системные ферментные препараты могут использоваться в различных областях медицины – заболевания уха, носа, горла, респираторные, желудочно-кишечные, ревматические, сосудистые, лимфатические заболевания, трофические язвы, гинекологические, урологические, дерматовенерологические, онкологические заболевания.
Еще в 1996 г. немецкие ученые провели рандомизированное двойное слепое исследование, чтобы изучить влияние препаратов системных ферментов (вобэнзим) на лечение мастопатии у женщин по сравнению с гормональными препаратами (линестренол). После двух месяцев системной ферментной терапии они наблюдали более выраженный эффект уменьшения уплотнения молочных желез.
Хотя исследователи не обнаружили разницы между устранением других симптомов (количество и размер кист, боль, чувствительность), системная ферментная терапия хорошо переносилась, не имела побочных эффектов, влияла на гормональный баланс в организме, поэтому ее считали альтернативной терапией с низким риском для этой патологии.
Другой важный эффект ферментов – антифибротический, т.е. ферменты разрушают рубцовую ткань. Известно, что с возрастом системные ферменты в организме уменьшаются, поэтому одновременно начинают появляться заболевания, связанные с повышенным количеством фиброзной ткани в организме (фиброзно-кистозная болезнь молочной железы, эндометриоз, миома матки, склеротические изменения артерий), а также возрастые. И любые поражения и раны оставляют заметный шрам.
Поэтому препараты системных ферментов – отличное средство для уменьшения рубцовой ткани и фиброза после хирургических вмешательств (кесарево сечение, лапаротомия) или при различных заболеваниях (почки, фиброз легких)
Также важно подчеркнуть, что ферменты могут разрушить даже старую рубцовую ткань, образовавшуюся несколько месяцев или лет назад. . Ферменты также важны для поддержания чистоты жидкой кровяной среды
Исследователи показали, что ферменты, содержащиеся в крови, улучшают кровообращение, потому что удаляется накопленный фибрин и, таким образом, кровь не густеет, что снижает вероятность образования тромбов. Это снижает риск ишемического инфаркта миокарда и головного мозга.
Ферменты также важны для поддержания чистоты жидкой кровяной среды. Исследователи показали, что ферменты, содержащиеся в крови, улучшают кровообращение, потому что удаляется накопленный фибрин и, таким образом, кровь не густеет, что снижает вероятность образования тромбов. Это снижает риск ишемического инфаркта миокарда и головного мозга.
Однако пациентам с заболеваниями крови (гемофилией) или уже принимающим антикоагулянты (гепарин, варфарин) следует с осторожностью применять ферментные препараты и проконсультироваться с врачом, так как они повышают эффективность этих препаратов и могут привести к значительному снижению вязкости крови
Механизм протекания, при каких условиях
Реагенты при отсутствии заместителей взаимодействуют в достаточно жестких условиях. К примеру, для реакции бутадиена-1,3 и этилена необходим температурный режим более 200 градусов и давление свыше 400 атмосфер. Выход химического процесса при этом небольшой. Если реагенты обладают электронодонорными и электроноакцепторными заместителями, реакция протекает в условиях комнатной температуры или при малом нагреве с количественным выходом. Реакция относится к классу -циклоприсоединения. В процессе три тт-связи разрываются и образуются две σ-связи и одна тт-связь. Реакция является одностадийной и характеризуется единственным переходным состоянием. Кроме бутадиена-1,3, вступать в реакцию Дальса-Альдера могут:
- циклические диены;
- гетероциклические диены;
- енины.
Диенофилы представлены следующими типами:
- малеиновый ангидрид;
- тетрацианэтилен;
- акриловая кислота;
- метилакрилат;
- акрилонитрил.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.