Катализатор и не только
Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
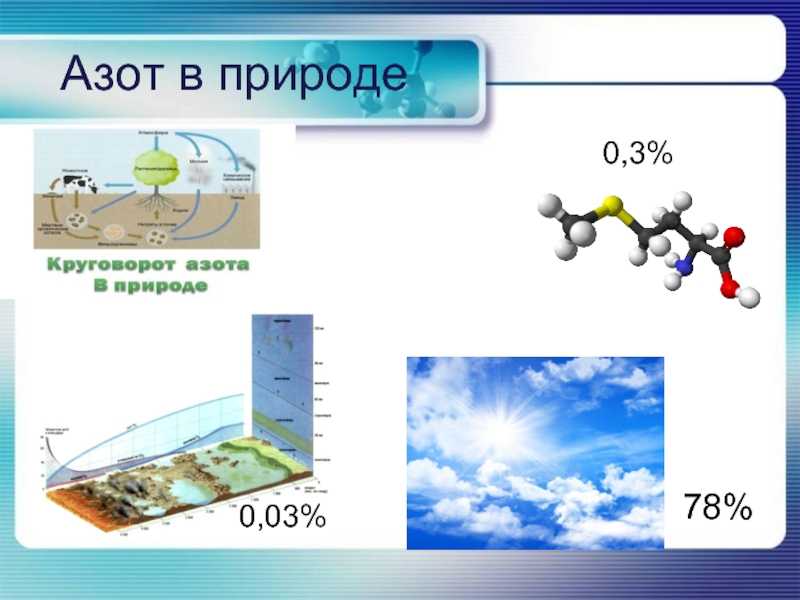
Аммонификация
В этом процессе соединения азота, присутствующие в почве, разлагаются до более простых химических форм. Азот содержится в мертвых органических веществах и отходах, таких как мочевина (моча млекопитающих) или мочевая кислота (экскременты птиц).
Азот, содержащийся в этих веществах, находится в виде сложных органических соединений. Микроорганизмы используют аминокислоты, содержащиеся в этих веществах, для производства своих белков. В этом процессе они выделяют избыток азота в виде аммиака или иона аммония.
Эти соединения доступны в почве для других микроорганизмов, которые могут действовать в следующих фазах цикла.
Перспективы изучения энзимологии ароматазы и регуляции ее активности
Приведенные в настоящем обзоре данные свидетельствуют о том, что в настоящее время существует значительная база экспериментальных данных по структурной организации, биосинтезу и регуляции активности ароматазы. Исследовано действие поллютантов окружающей среды на ароматазную активность, разработан целый комплекс терапевтических мер, направленных на коррекцию ароматазной активности. Данные о высокоспецифичном и, возможно, необратимом изостерическом ингибировании ароматазы рядом соединений раскрывают новые перспективы в плане поиска природных и неприродных фармакологических агентов, подавляющих ароматазную активность.
Что такое лактатдегидрогеназа?
Лактатдегидрогеназа (молочнокислая дегидрогеназа, ЛДГ или ЛД) — катализирующий фермент, ускоряющий обратимую реакцию восстановления пирувата в лактат. Эта реакция — один из ключевых этапов превращения глюкозы из пищи в энергию, необходимую для большинства процессов в организме.
ЛДГ в основном локализуется в клетках паренхиматозных органов — печени, почках, в мышечной ткани и в коже, то есть в метаболически активных клетках. У здоровых людей дегидрогеназа располагается в цитоплазме, то есть внутри клетки, и секретируется в кровь только в момент повреждения клеток или повышения проницаемости клеточной мембраны, что делает ЛДГ важным маркером органной недостаточности, используемым при диагностике внутренних заболеваний.
Биотическая фиксация
Это осуществляется микроорганизмами в почве. Эти бактерии обычно связаны с корнями растений. Ежегодная биотическая азотфиксация оценивается примерно в 200 миллионов тонн в год.
Атмосферный азот превращается в аммиак. В первой фазе реакции N2 сводится к NH3 (аммиак). В этой форме он входит в состав аминокислот.
В этом процессе ферментный комплекс задействован с различными окислительно-восстановительными центрами. Этот комплекс нитрогеназы состоит из редуктазы (обеспечивает электроны) и нитрогеназы. Последний использует электроны для уменьшения N2 в NH3. При этом расходуется большое количество АТФ.
Комплекс нитрогеназы необратимо ингибируется в присутствии высоких концентраций O2. В радикальных узелках присутствует белок (леггемоглобин), который поддерживает очень низкое содержание кислорода.2. Этот белок образуется в результате взаимодействия корней и бактерий.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Нитрификация
На этом этапе почвенные бактерии окисляют аммиак и ион аммония. В процессе высвобождается энергия, которая используется бактериями в их метаболизме.
В первую очередь, нитрозирующие бактерии рода Нитросомы они окисляют аммиак и ион аммония до нитрита. Фермент аммиачная муоксигеназа находится в мембране этих микроорганизмов. Окисляет NH3 в гидроксиламин, который затем окисляется до нитрита в периплазме бактерий.
Впоследствии нитрующие бактерии окисляют нитриты до нитратов с помощью фермента нитрит-оксидоредуктазы. Нитраты содержатся в почве, где они могут поглощаться растениями.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
- метаболические;
- пищеварительные.
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость
На этом этапе на пищу воздействует альфа-амилаза. Она расщепляет углеводы, крахмалы и глюкозу, которые содержатся в картофеле, фруктах, овощах и других продуктах питания.
Поджелудочная железа
На этом этапе «работают»:
- трипсин – отвечает за расщепление белков;
- альфа-химотрипсин – помогает усвоению протеинов;
- эластазы – расщепляют некоторые виды белков;
- нуклеазы – помогают расщеплять нуклеиновые кислоты;
- стеапсин – способствует усвоению жирной пищи;
- амилаза – отвечает за усвоение крахмалов;
- липаза – расщепляет жиры (липиды), содержащиеся в молочных продуктах, орехах, маслах и мясе.
Тонкая кишка
Над пищевыми частицами «колдуют»:
- пептидазы – расщепляют пептидные соединения к уровню аминокислот;
- сахараза – помогает усваивать сложные сахара и крахмалы;
- мальтаза – расщепляет дисахариды к состоянию моносахаридов (солодовый сахар);
- лактаза – расщепляет лактозу (глюкозу, содержащуюся в молочных продуктах);
- липаза – способствует усвоению триглицеридов, жирных кислот;
- эрепсин – воздействует на протеины;
- изомальтаза – «работает» с мальтозой и изомальтозой.
Толстый кишечник
Здесь функции ферментов выполняют:
- кишечная палочка – отвечает за переваривание лактозы;
- лактобактерии – влияют на лактозу и некоторые другие углеводы.
Кроме названных энзимов, существуют еще:
- диастаза – переваривает растительный крахмал;
- инвертаза – расщепляет сахарозу (столовый сахар);
- глюкоамилаза – превращает крахмал в глюкозу;
- альфа-галактозидаза – способствует перевариванию бобов, семян, соевых продуктов, корневых овощей и листовых;
- бромелайн – фермент, полученный из ананасов, способствует расщеплению разных видов белков, эффективен при разных уровнях кислотности среды, обладает противовоспалительными свойствами;
- папаин – фермент, выделенный из сырой папайи, способствует расщеплению мелких и крупных протеинов, эффективен в широком диапазоне субстратов и кислотности.
- целлюлаза – расщепляет целлюлозу, растительные волокна (в человеческом организме не обнаружена);
- эндопротеаза – расщепляет пептидные связи;
- экстракт бычьей желчи – энзим животного происхождения, стимулирует моторику кишечника;
- панкреатин – фермент животного происхождения, ускоряет переваривание жиров и белков;
- панкрелипаза – животный фермент, способствует усвоению белков, углеводов и липидов;
- пектиназа – расщепляет полисахариды, содержащиеся во фруктах;
- фитаза – способствует усвоению фитиновой кислоты, кальция, цинка, меди, марганца и других минералов;
- ксиланаза – расщепляет глюкозу из зерновых.
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие из полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Ферментированные продукты являются практически идеальным источником полезных бактерий, необходимых для правильного пищеварения. И в то время, когда аптечные пробиотики «работают» только в верхнем отделе пищеварительной системы и часто не добираются до кишечника, эффект от ферментативных продуктов ощущается во всем желудочно-кишечном тракте.
Лучшие материалы месяца
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Ассимиляция
Растения, не имеющие симбиотической ассоциации с N-фиксирующими бактериями2, они забирают азот из почвы. Поглощение этого элемента осуществляется в виде нитратов через корни.
Как только нитраты попадают в растение, часть их используется клетками корня. Другая часть распределяется ксилемой по всему растению.
При использовании нитрат восстанавливается в цитоплазме до нитрита. Этот процесс катализируется ферментом нитратредуктазой. Нитриты транспортируются в хлоропласты и другие пластиды, где они восстанавливаются до иона аммония (NH4).
Ион аммония в больших количествах токсичен для растений. Таким образом, он быстро включается в карбонатный скелет с образованием аминокислот и других молекул.
В случае потребителей азот получают путем кормления непосредственно от растений или других животных.
Когда назначают анализ на LDH?
Лактатдегидрогеназа поступает в кровоток преимущественно в условиях повреждения и распада клеток, поэтому повышенный уровень этого фермента свидетельствует о наличии недостаточности или повреждении внутренних органов.
Исследование лактатдегидрогеназы в крови помогает в таких ситуациях, как:
- Обнаружение повреждений тканей в организме.
- Диагностика и контроль гемолитической или мегалобластной анемии. В случае гемолитической анемии определение ЛДГ позволяет дифференцировать сопутствующую желтуху от желтухи другого происхождения, поскольку при распаде эритроцитов значение ЛДГ увеличивается в несколько раз.
- Определение стадии, мониторинг и оценка прогноза для некоторых видов рака — лимфомы, лейкемии, меланомы, опухоли половых клеток.
Иногда, когда происходит травма, воспаление или инфекция, жидкость скапливается в определенной части тела, тогда определение уровня ЛДГ в этой жидкости помогает определить причину ее накопления. Тканевая лактатдегидрогеназа может быть изучена в жидкостях организма, например, при подозрении на менингит, перикардит или плеврит.
На анализ может быть отправлена:
Спинномозговая жидкость. Берется для отличия бактериального менингита от вирусного;
Плевральная, перикардиальная и перитонеальная жидкость
Важно отличать экссудат от транссудата.
Таким образом, лактатдегидрогеназа тканей полезна при дифференциации типа жидкости из полостей организма:
- Экссудат возникает при воспалении, вызванном, например, бактериальной инфекцией или при повреждении тканей.
- Транссудат связан с повышением сосудистого давления, например, при сердечной недостаточности, или уменьшением количества белков крови, например, в результате цирроза печени, потери белка почками.
Промышленные процессы
Возможность того, что атмосферный азот вступает в реакцию с некоторыми химическими веществами, впервые обнаружил Десфосс в 1828 году. Он заметил, что смеси оксидов щелочных металлов и углерода реагируют с азотом при высоких температурах. С использованием карбоната бария в качестве исходного материала в 1860-х годах стал доступен первый коммерческий процесс, разработанный Маргаритой и Сурдевалем. Образующийся цианид бария реагирует с паром с образованием аммиака. Метод фиксации азота был впервые описан Генри Кавендишем в 1784 году с использованием электрической дуги, реагирующей на азот и кислород в воздухе. Этот метод был реализован в процессе Биркеланда – Эйда . Фиксация азота молнией — очень похожий естественный процесс.
Франк-Каро процесс
В 1898 году Франк и Каро разработали способ фиксации азота в форме цианамида кальция . В Франке-Кары процессы и Оствальд доминировали промышленную фиксацию до открытия процесса Габер в 1909 году.
Процесс Габера
Оборудование для изучения связывания азота альфа-лучами (Лаборатория исследования фиксированного азота, 1926 г.)
Самый распространенный метод производства аммиака — это процесс Габера . Процесс восстановления азота Haber-Bosch для промышленного производства удобрений произвел революцию в современных технологиях. Производство удобрений в настоящее время является крупнейшим источником фиксированного азота, производимого человеком в наземной экосистеме . Аммиак — необходимый прекурсор для удобрений , взрывчатых веществ и других продуктов. Процесс Габера требует высокого давления (около 200 атм) и высоких температур (не менее 400 ° C), которые являются обычными условиями для промышленного катализа. В этом процессе в качестве источника водорода используется природный газ, а в качестве источника азота — воздух. Получение аммиака привело к интенсификации производства азотных удобрений во всем мире и, как считается, способствовало увеличению численности населения с примерно 2 миллиардов в начале 20 века до примерно 8 миллиардов человек в настоящее время.
Гомогенный катализ
Было проведено много исследований по открытию катализаторов фиксации азота, часто с целью снижения потребности в энергии. Однако такие исследования пока не смогли приблизиться к эффективности и простоте процесса Габера. Многие соединения реагируют с атмосферным азотом с образованием диазотных комплексов . Первым описанным диазотным комплексом был Ru (NH3)5( N2) 2+ . Некоторые растворимые комплексы действительно катализируют азотфиксацию.
Ссылки
- Серон Л. и Аристизабаль (2012) Динамика круговорота азота и фосфора в почвах. Преподобный Коломб. Biotechnol. 14: 285-295.
- Эступинян Р. и Б. Кесада (2010) процесс Хабера-Боша в агропромышленном обществе: опасности и альтернативы. Система Agrifood: коммерциализация, борьба и сопротивление. Редакция ILSA. Богота, Колумбия. 75-95
- Гэллоуэй Дж. Н. (2003) Глобальный круговорот азота. В: Schelesinger W (ed.) Трактат по геохимии. Эльзевир, США. С. 557-583.
- Гэллоуэй Дж. Н. (2005) Глобальный круговорот азота: прошлое, настоящее и будущее. Наука в Китае Ser C Life Sciences 48: 669-677.
- Pajares S (2016) Азотный каскад, вызванный деятельностью человека. Ойкос 16: 14-17.
- Стейн Л. и М. Клотц (2016) Круговорот азота. Текущая биология 26: 83-101.
Щелочная фосфатаза у детей – норма, причины отклонения от нормы
Контрольные значения для теста на щелочную фосфатазу меняются в зависимости от возраста из-за роста.
Нормальный уровень щелочной фосфатазы в плазме зависит от возраста и пола. Норма для детей и подростков:
|
Возраст |
Норма фосфатазы |
|
Новорожденные |
до 250 ед / д |
|
1 – 9 лет |
до 350 ед / д |
|
10 – 15 лет |
до 280 ед / л |
|
16 – 19 лет |
до 150 ед / л |
Уровень этого фермента в сыворотке крови может незначительно отличаться в зависимости от используемых методов тестирования и реагентов.
В педиатрической практике исследование активности щелочной фосфатазы играет важную роль в диагностике заболеваний печени, что дополняется снижением оттока желчи в двенадцатиперстной кишке. Кроме того, уровень щелочной фосфатазы в крови ребенка часто повышен. Высокий уровень фосфатазы нарушает отток желчи из-за камней в желчных протоках или опухолей желчных протоков.
Ребенку с повышенной щелочной фосфатазой врач может поставить следующие диагнозы:
- заболевания костей, включая опухоли, саркомы, метастазы рака костей;
- гиперпаратиреоз;
- поражение костей при лимфогранулематозе;
- рахит;
- педиатрические заболевания – болезни скелета;
- инфекционный мононуклеоз;
- миелома;
- детская цитомегалия;
- кишечные инфекции.
Большое значение у детей имеет показатель щелочной фосфатазы в ранней диагностике рахита. В этом случае активность фермента увеличивается задолго до появления клинических симптомов заболевания.
Иногда происходит физиологическое, то есть естественное, повышение уровня щелочной фосфатазы в сыворотке крови: у недоношенных детей или подростков в период полового созревания и интенсивного роста костей.
Лекарственные препараты с побочными гепатотоксическими эффектами могут также повышать уровень фермента щелочной фосфатазы у ребенка. К таким препаратам относятся парацетамол, пенициллины, сульфаниламиды, эритромицин и многие другие. Повышенный метаболизм в костной ткани во время заживления переломов костей часто увеличивает уровень этого фермента.
Снижение уровня фермента щелочной фосфатазы не имеет клинического значения. Снижение уровня ферментов может происходить при различных нарушениях роста костей, дефиците цинка, магния, витаминов C и B12 в пище, анемии и гипотиреозе, а также в редких случаях врожденной гипофосфатазии.
Нитрифицирующие бактерии
В процессе нитрификации участвуют три типа микроорганизмов. Эти бактерии способны окислять аммиак или ион аммония, присутствующий в почве. Это хемолиттрофные организмы (способные окислять неорганические материалы в качестве источника энергии).
В процесс последовательно вмешиваются бактерии разных родов. Нитросома и нитроцистис они окисляют NH3 и NH4 до нитритов. затем Нитробактер Y Нитрозококк они окисляют это соединение до нитратов.
В 2015 году была обнаружена еще одна группа бактерий, вмешивающаяся в этот процесс. Они способны непосредственно окислять аммиак до нитратов и принадлежат к роду Нитроспира. Некоторые грибы также способны нитрифицировать аммиак.
История открытия
Энзим в переводе с греческого означает «закваска». А открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс. Голландец назвал его fermentum, что в переводе означает «брожение». Затем, почти тремя веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки. А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живым организмом. Он также дал ему свое название – «зимаза». Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы. Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов. И лишь 1897 год положил конец всем научным спорам: оба термины (энзим и фермент) решено использовать как абсолютные синонимы.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Виды ЛДГ в организме
Если общий уровень ЛДГ повышен, назначаются дополнительные и более подробные тесты. Концентрация отдельных изоферментов ЛДГ измеряется, чтобы выяснить, какие органы были повреждены.
Лактатдегидрогеназа встречается в тканях в пяти возможных изоформах, обозначаемых последовательными числами: LDH1, LDH2, LDH3, LDH4 и LDH5. Изоформы – это разные формы одного и того же фермента, катализирующие одну специфическую химическую реакцию. Они отличаются друг от друга по химическому строению, а их взаимные пропорции изменчивы в разных органах
Таблица 1. Виды лактатдегидрогеназы и содержание в органах
| Тип ЛДГ | Процентное содержание в организме | Органы, содержащие ЛДГ в максимальных количествах |
| LDH1 | 14-26% | клетки миокарда, эритроциты, клетки почек |
| LDH2 | 29-39% | почки, эритроциты, клетки сердечной мышцы |
| LDH3 | 20-26% | селезенка, легкие, почки |
| LDH4 | 8-16% | селезенка, легкие, плацента |
| LDH5 | 8-16% | ткани печени, кожа, скелетные мышцы |
Благодаря тому, что отдельные изоформы ЛДГ отличаются друг от друга по структуре, возможно определить концентрацию каждой из них в отдельности, что значительно повышает чувствительность и прогностическое значение результата.






![Фиксация азота [1983 гэлстон а., дэвис п., сэттер р. - жизнь зеленого растения]](http://mediaex.ru/wp-content/uploads/e/a/f/eaffd0a6a35f98f69fa0a21d8f4a7310.jpeg)


















![Фиксация азота [1983 гэлстон а., дэвис п., сэттер р. - жизнь зеленого растения]](http://mediaex.ru/wp-content/uploads/b/9/2/b924dc0c8b8d0de702c9c0994ebfffb2.jpeg)





![Глава 12 происхождение жизни. возникновение трансляции, репликации, метаболизма и мембран: биологический, геохимический и космологический подходы. логика случая [о природе и происхождении биологической эволюции]](http://mediaex.ru/wp-content/uploads/6/8/c/68c0bac6685b1bbfa07cf96abca152f8.jpeg)