Содержание:

Ферменты и катализаторы оба влияют на скорость реакции. Фактически, все известные ферменты являются катализаторами, но не все катализаторы являются ферментами. В разница между катализаторами и ферментами заключается в том, что ферменты в основном являются органическими по своей природе и являются биокатализаторами, тогда как неферментативные катализаторы могут быть неорганическими соединениями. Ни катализаторы, ни ферменты не расходуются в катализируемых ими реакциях.
Для простоты, катализатор В этой статье речь идет о неферментативных катализаторах, которые легко отличить от ферментов.
Открытие
Схема, показывающая расщепление РНК рибозимом.
До открытия рибозимов ферменты , которые определяют как каталитические белки , были единственными известными биологическими катализаторами . В 1967 году Карл Вёзе , Фрэнсис Крик и Лесли Оргел первыми предположили, что РНК может действовать как катализатор. Эта идея была основана на открытии того, что РНК может образовывать сложные вторичные структуры . Эти рибозимы были обнаружены в интроне РНК-транскрипта, который удалился из транскрипта, а также в РНК-компоненте комплекса РНКазы Р, который участвует в созревании пре- тРНК . В 1989 году Томас Р. Чех и Сидни Альтман разделили Нобелевскую премию по химии за «открытие каталитических свойств РНК». Термин рибозим был впервые введен Kelly Kruger et al. в 1982 г. в статье, опубликованной в Cell .
В биологии существовало твердое убеждение, что катализ предназначен только для белков. Однако идея катализа РНК частично мотивирована старым вопросом о происхождении жизни: что первично, ферменты, выполняющие работу клетки, или нуклеиновые кислоты, которые несут информацию, необходимую для производства ферментов? Концепция «рибонуклеиновые кислоты как катализаторы» позволяет обойти эту проблему. РНК, по сути, может быть как куриным, так и яйцом.
В 1980-х Томас Чех из Колорадского университета в Боулдере изучал удаление интронов в гене рибосомной РНК у Tetrahymena thermophila . Пытаясь очистить фермент, ответственный за реакцию сплайсинга, он обнаружил, что интрон может быть сплайсирован в отсутствие какого-либо добавленного клеточного экстракта. Как ни старались, Чех и его коллеги не смогли идентифицировать какой-либо белок, связанный с реакцией сплайсинга. После долгой работы Чех предположил, что часть интронной последовательности РНК может разрывать и восстанавливать фосфодиэфирные связи. Примерно в то же время Сидни Альтман, профессор Йельского университета , изучал способ процессинга молекул тРНК в клетке, когда он и его коллеги выделили фермент под названием РНКаза-P , который отвечает за превращение предшественника тРНК в клетку. активная тРНК. К своему большому удивлению они обнаружили, что РНКаза-P содержит РНК в дополнение к белку и что РНК является важным компонентом активного фермента. Это была настолько чужая идея, что им было трудно опубликовать свои выводы. В следующем году Альтман продемонстрировал, что РНК может действовать как катализатор, продемонстрировав, что субъединица РНКазы-P может катализировать расщепление тРНК-предшественника в активную тРНК в отсутствие какого-либо белкового компонента.
После открытия Чеха и Альтмана другие исследователи обнаружили другие примеры саморасщепляющейся РНК или каталитических молекул РНК. Многие рибозимы имеют активный центр в форме шпильки или головки молотка и уникальную вторичную структуру, которая позволяет им расщеплять другие молекулы РНК по определенным последовательностям. Теперь можно создавать рибозимы, которые будут специфически расщеплять любую молекулу РНК. Эти катализаторы РНК могут иметь фармацевтическое применение. Например, рибозим был разработан для расщепления РНК ВИЧ. Если бы такой рибозим был произведен клеткой, все поступающие вирусные частицы имели бы свой РНК-геном, расщепленный рибозимом, что предотвратило бы инфекцию.
Ссылки
- Девлин, Т. М. (2004). Биохимия: учебник с клиническим применением. Я поменял направление.
- Мюллер, С., Аппель, Б., Балке, Д., Иероним, Р., & Нюбель, К. (2016). Тридцать пять лет исследований рибозимов и катализа нуклеиновых кислот: где мы находимся сегодня? F1000Research, 5, F1000 Faculty Rev-1511.
- Стробель, С. А. (2002). Рибозим / Каталитическая РНК. Энциклопедия молекулярной биологии.
- Воет Д., Воет Дж. Г. и Пратт К. В. (2014). Основы биохимии. Panamerican Medical Ed.
- Вальтер, Н. Г., и Энгельке, Д. Р. (2002). Рибозимы: каталитические РНК, которые разрезают и создают вещи, а также выполняют странную и полезную работу. Биолог (Лондон, Англия), 49(5), 199.
- Уотсон, Дж. Д. (2006). Молекулярная биология гена. Panamerican Medical Ed.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Гринин Леонид Ефимович Большая История Развития Мира: планеты Солнечной системы. Их история и эволюция. Химическая эволюция в космосе и на Земле
Lib.ru/Современная литература:
Оставить комментарий
Copyright Гринин Леонид Ефимович
Размещен: 11/01/2021, изменен: 11/01/2021. 1587k.
Учебник: Обществ.науки
Иллюстрации/приложения: 3 шт.
Скачать FB2
Аннотация:Настоящая книга является третьей частью задуманной автором большой моногра-фии. В ней предпринимается попытка объединить преимущества Большой истории, то есть истории всего: от возникновения Вселенной до современного состояния человече-ства и эволюционистики. Автор стремился показать, с одной стороны, процесс роста эволюционной сложности мира, а с другой — сходства в эволюционных законах, прин-ципах и механизмах на разных уровнях и этапах эволюции. Такая задача еще не реша-лась никем.
Первая книга была посвящена космической эволюции и истории от Большого взрыва 13,8 млрд лет назад до формирования Солнечной системы (4,57 млрд лет назад). Вторая книга — эволюции и истории ранней Солнечной системы в ее первый миллиард лет (от зарождения до конца поздней тяжелой бомбардировки метеоритами и установ-ления орбит планет).Третья книга включает довольно подробное описание планет и части спутников Солнечной системы, а также их 4,5-миллиардную историю и эволюцию в сравнении между собой и с эволюцией Земли
Важно отметить, что подобных исследований, кото-рые бы представляли историю и эволюцию планет и спутников Солнечной системы комплексе, с хронологией, сравнением истории планет в синхронных срезах, нет. В этом, а также и в некоторых других отношениях данная книга является уникальной.Помимо истории планет и планетных тел нашей Солнечной системы, в этой книге также представлена краткая история химической эволюции — от зарождения первых атомов во Вселенной до абиогенеза на Земле, то есть этапа преджизни и формирования предпосылок для появления первых живых организмов
Раздел о химической эволюции очень важен для понимания как истории жизни (поскольку химическая абиогенная эво-люция — это переход от косной к живой материи), так и истории Земли (геологической эволюции).Книга будет интересна и полезна всем, кто интересуется проблемами космологии, эволюции и философии мироздания, кого волнуют проблемы устройства мира, тем, кто работает на стыке междисциплинарных проблем и хочет быть в курсе современных научных достижений. Она написана в достаточно популярной манере, но в то же время опирается на серьезные научные исследования, то есть рассчитана как на специалистов, так и на широкий круг читателей.
Структура: цепь из тысяч аминокислот
Все ферменты являются белками, но не все белки – ферменты. Как и другие протеины, энзимы состоят из аминокислот. И что интересно, на создание каждого фермента уходит от ста до миллиона аминокислот, нанизанных, словно жемчуг на нить. Но эта нить не бывает ровной – обычно изогнута в сотни раз. Таким образом, создается трехмерная уникальная для каждого фермента структура. Меж тем, молекула энзима – сравнительно крупное образование, и лишь небольшая часть его структуры, так называемый активный центр, участвует в биохимических реакциях.
Каждая аминокислота соединена с другой определенным типом химической связи, а каждый фермент имеет свою уникальную последовательность аминокислот. Для создания большинства из них используются примерно по 20 видов. Даже незначительные изменения последовательности аминокислот могут кардинально менять внешний вид и «таланты» фермента.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование: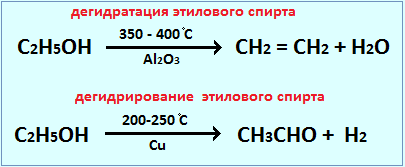
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Типы рибозимов
Существует пять классов или типов рибозимов: три из них участвуют в реакциях самомодификации, в то время как остальные два (рибоназа P и рибосомная РНК) используют другой субстрат в каталитической реакции. Другими словами, молекула, отличная от каталитической РНК.
Интроны I группы
Этот тип интронов был обнаружен в митохондриальных генах паразитов, грибов, бактерий и даже вирусов (таких как бактериофаг T4).
Например, у простейших видов Тетрахимена термофила, Интрон удаляется из предшественника рибосомной РНК в несколько этапов: сначала нуклеозид или нуклеозид гуанозина реагирует с фосфодиэфирной связью, связывающей интрон с реакцией экзон-трансэтерификации..
Затем свободный экзон выполняет ту же реакцию в фосфодиэфирной связи экзон-интрон на конце акцепторной группы интрона..
Интроны II группы
Интроны группы II известны как «autoempalme», поскольку эти РНК способны к самосвязыванию. Интроны этой категории находятся в предшественниках митохондриальной РНК в линии грибов.
Группы I и II и рибонуклеазы P (см. Ниже) представляют собой рибозимы, характеризующиеся большими молекулами, длиной до нескольких сотен нуклеотидов и образованием сложных структур..
Интроны III группы
Интроны III группы называются «автокортируемыми» РНК и были идентифицированы в патогенных вирусах растений..
Эти РНК имеют особенность в том, что они способны разрезать себя в реакции созревания геномных РНК, начиная с предшественников со многими единицами.
В этой группе один из самых популярных и изученных рибозимов: рибозимная головка молотка. Это найдено в инфекционных рибонуклеиновых агентах растений, называемых вироидами.
Эти агенты требуют, чтобы саморасщепляющийся процесс размножался и производил несколько своих копий в непрерывной цепи РНК..
Вироиды должны быть отделены друг от друга, и эта реакция катализируется последовательностью РНК, обнаруженной с обеих сторон области связывания. Одна из этих последовательностей является «головкой молотка» и названа в честь сходства ее вторичной структуры с этим инструментом..
Рибонуклеаза Р
Четвертый тип рибозимов состоит из молекул РНК и белков. У рибонуклеаз структура РНК жизненно важна для осуществления каталитического процесса..
В клеточной среде рибонуклеаза P действует так же, как белковые катализаторы, разрезая предшественники РНК-переносчика, чтобы получить зрелый 5′-конец.
Этот комплекс способен распознавать мотивы, последовательности которых не изменились в ходе эволюции (или изменились очень мало) предшественников трансфер-РНК. Чтобы связать субстрат с рибозимом, он широко не использует комплементарность между основаниями.
Они отличаются от предыдущей группы (рибозимы головки молотка) и РНК, сходных с этим, конечным продуктом среза: рибонуклеаза продуцирует 5′-концевой фосфат.
Бактериальная рибосома
Исследования структуры рибосомы бактерий позволили сделать вывод, что он также обладает свойствами рибозима. Участок, ответственный за катализ, находится в субъединице 50S..
Структура катализаторов и ферментов
А катализатор Любое вещество, которое может вызвать значительное изменение скорости химической реакции. Таким образом, это может быть чистый элемент, такой как никель или платина, чистое соединение, такое как диоксид кремния, диоксид марганца, растворенные ионы, такие как ионы меди, или даже смесь, например железо-молибден. Наиболее часто используемые катализаторы — протонные кислоты в реакции гидролиза. Редокс-реакции катализируются переходными металлами, а платина используется для реакций с участием водорода. Некоторые катализаторы выступают в качестве предварительных катализаторов и превращаются в катализаторы в ходе реакции. Типичный пример — катализатор Уилкинсона — RhCl (PPh3)3 который теряет один трифенилфосфиновый лиганд при катализе реакции.
Ферменты представляют собой глобулярные белки и могут состоять из 62 аминокислот (4-оксалокротонат) и размером в 2500 аминокислот (синтаза жирных кислот). Также существуют ферменты на основе РНК, называемые рибозимы. Ферменты специфичны к субстрату и обычно больше, чем соответствующие субстраты. Только небольшая часть фермента принимает участие в ферментативной реакции. Активный центр — это место, где субстраты связываются с ферментом для облегчения реакции. Другие факторы, такие как кофакторы, прямые продукты и т. Д., Также имеют специфические участки связывания с ферментом. Ферменты состоят из длинных цепочек аминокислот, которые складываются друг над другом, образуя глобулярную структуру. Аминокислотная последовательность придает ферментам субстратную специфичность. Тепло и химические вещества могут денатурировать фермент.
Историческая перспектива
В течение многих лет считалось, что единственными молекулами, способными участвовать в биологическом катализе, являются белки.
Белки состоят из двадцати аминокислот, каждая из которых имеет разные физические и химические свойства, что позволяет им группироваться в самые разнообразные сложные структуры, такие как альфа-спирали и бета-листы.
В 1981 году произошло открытие первого рибозима, положившего конец парадигме, согласно которой единственными биологическими молекулами, способными к катализу, являются белки.
Структуры ферментов позволяют взять субстрат и превратить его в определенный продукт. Молекулы РНК также обладают способностью сворачиваться и катализировать реакции.
Фактически, структура рибозима напоминает структуру фермента со всеми его наиболее заметными частями, такими как активный сайт, сайт связывания субстрата и сайт связывания кофактора.
РНКаза P была одним из первых открытых рибозимов и состоит как из белков, так и из РНК. Он участвует в генерации молекул транспортной РНК, начиная с более крупных предшественников.
Рибозимы и происхождение жизни [ править ]
РНК также может действовать как наследственная молекула, что побудило Уолтера Гилберта предположить, что в далеком прошлом клетка использовала РНК как генетический материал, так и структурную и каталитическую молекулу, а не разделяла эти функции между ДНК и белком, как сегодня; эта гипотеза известна как « гипотеза мира РНК » происхождения жизни . Поскольку нуклеотиды и РНК и, следовательно, рибозимы могут образовываться неорганическими химическими веществами, они являются кандидатами на роль первых ферментов., и, по сути, первые «репликаторы», то есть содержащие информацию макромолекулы, которые реплицируются сами. Пример самовоспроизводящегося рибозима, который лигирует два субстрата для создания его точной копии, был описан в 2002 году.
Открытие каталитической активности РНК разрешило парадокс происхождения жизни «курица и яйцо», решив проблему центральная догма проблемы происхождения пептидов и нуклеиновых кислот. Согласно этому сценарию, в самом начале жизни вся ферментативная активность и кодирование генетической информации осуществлялось одной молекулой, РНК.
Действия [ править ]
Рибосомой является биологической машиной , которая использует рибосомы , чтобы перевести РНК в белках
Хотя рибозимы в большинстве клеток встречаются довольно редко, их роль иногда важна для жизни. Например, функциональная часть рибосомы , биологическая машина, которая переводит РНК в белки, по сути, представляет собой рибозим, состоящий из третичных структурных мотивов РНК , которые часто координируются с ионами металлов, такими как Mg 2+, в качестве кофакторов . В модельной системе, не существует никакого требования в отношении двухвалентных катионов в пять-нуклеотид РНК катализирующего транс — phenylalanationчетырехнуклеотидного субстрата с 3 парами оснований, комплементарными катализатору, где катализатор / субстрат были созданы путем усечения рибозима С3.
Наиболее изученными рибозимами, вероятно, являются те, которые разрезают сами себя или другие РНК, как в оригинальном открытии Чеха и Альтмана. Однако рибозимы могут быть разработаны для катализирования ряда реакций (см. Ниже), многие из которых могут происходить в жизни, но не были обнаружены в клетках.
РНК может катализировать складывания патологического конформации белка в виде приона в манере , аналогичной той , что из шаперонина .
Катализатор и не только
Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике
Это особенно важно для детей, страдающих муковисцидозом
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом
Трудности
Такие фундаментальные и древние явления очень трудно обосновать, так как долгая эволюция во многом стерла их возможные следы.
РНК — сложная и хрупкая молекула. Чтобы гипотеза о мире РНК была достоверной, мы должны представить себе, что достаточно длинный предшественник РНК, способный к репликации, мог спонтанно появиться в пребиотическом супе. Некоторым ученым это событие кажется маловероятным. Чтобы обойти эту трудность, было высказано предположение, что этому предшествовал предшественник, более простой, чем РНК.
Также была выдвинута гипотеза о возникновении и развитии жизни в ледяной среде, при этом РНК легче растет во льду, чем при высоких температурах ( нуклеотиды естественным образом собираются с образованием цепей РНК, когда они находятся в замороженной среде).
Однако успех пребиотического синтеза РНК командой Джона Сазерленда (in) в 2009 году показывает, что спонтанное появление РНК в «пребиотическом супе» не так невероятно, как первоначально предполагалось. В 2019 году был обнаружен механизм, который позволяет пребиотический синтез нуклеозидов РНК из обоих семейств, пуринов и пиримидинов , в одной и той же среде и путем простой последовательности сухих и влажных эпизодов.
Действие
Несмотря на то, что большинство рибозимов достаточно редко встречаются в клетках, иногда они очень важны для их существования. Например, активная часть рибосомы — молекулярной машины, осуществляющей трансляцию белков из РНК — является рибозимом.
В качестве кофакторов некоторые рибозимы часто содержат двухвалентные ионы металлов, например, Mg2+.
То обстоятельство, что РНК может содержать наследственную информацию, позволило Уолтеру Гилберту выдвинуть предположение, что в древности РНК использовалась как в качестве генетического материала, так и в качестве катализаторов и структурных компонентов клетки, а впоследствии эти роли были перераспределены между ДНК и белками. Эта гипотеза сейчас известна как Гипотеза РНК-мира.
Если РНК были первыми молекулярными машинами, использовавшимися в ранних живых клетках, то рибозимы, существующие сегодня (например, аппарат рибосомы), могут считаться живыми ископаемыми — образцами живых существ, состоящих из нуклеиновых кислот.
Недавние исследования свертывания прионов показывают, что РНК может катализировать свертывание белка в патологические конфигурации подобно ферментам-шаперонам.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
- метаболические;
- пищеварительные.
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость
На этом этапе на пищу воздействует альфа-амилаза. Она расщепляет углеводы, крахмалы и глюкозу, которые содержатся в картофеле, фруктах, овощах и других продуктах питания.
Поджелудочная железа
На этом этапе «работают»:
- трипсин – отвечает за расщепление белков;
- альфа-химотрипсин – помогает усвоению протеинов;
- эластазы – расщепляют некоторые виды белков;
- нуклеазы – помогают расщеплять нуклеиновые кислоты;
- стеапсин – способствует усвоению жирной пищи;
- амилаза – отвечает за усвоение крахмалов;
- липаза – расщепляет жиры (липиды), содержащиеся в молочных продуктах, орехах, маслах и мясе.
Тонкая кишка
Над пищевыми частицами «колдуют»:
- пептидазы – расщепляют пептидные соединения к уровню аминокислот;
- сахараза – помогает усваивать сложные сахара и крахмалы;
- мальтаза – расщепляет дисахариды к состоянию моносахаридов (солодовый сахар);
- лактаза – расщепляет лактозу (глюкозу, содержащуюся в молочных продуктах);
- липаза – способствует усвоению триглицеридов, жирных кислот;
- эрепсин – воздействует на протеины;
- изомальтаза – «работает» с мальтозой и изомальтозой.
Толстый кишечник
Здесь функции ферментов выполняют:
- кишечная палочка – отвечает за переваривание лактозы;
- лактобактерии – влияют на лактозу и некоторые другие углеводы.
Кроме названных энзимов, существуют еще:
- диастаза – переваривает растительный крахмал;
- инвертаза – расщепляет сахарозу (столовый сахар);
- глюкоамилаза – превращает крахмал в глюкозу;
- альфа-галактозидаза – способствует перевариванию бобов, семян, соевых продуктов, корневых овощей и листовых;
- бромелайн – фермент, полученный из ананасов, способствует расщеплению разных видов белков, эффективен при разных уровнях кислотности среды, обладает противовоспалительными свойствами;
- папаин – фермент, выделенный из сырой папайи, способствует расщеплению мелких и крупных протеинов, эффективен в широком диапазоне субстратов и кислотности.
- целлюлаза – расщепляет целлюлозу, растительные волокна (в человеческом организме не обнаружена);
- эндопротеаза – расщепляет пептидные связи;
- экстракт бычьей желчи – энзим животного происхождения, стимулирует моторику кишечника;
- панкреатин – фермент животного происхождения, ускоряет переваривание жиров и белков;
- панкрелипаза – животный фермент, способствует усвоению белков, углеводов и липидов;
- пектиназа – расщепляет полисахариды, содержащиеся во фруктах;
- фитаза – способствует усвоению фитиновой кислоты, кальция, цинка, меди, марганца и других минералов;
- ксиланаза – расщепляет глюкозу из зерновых.
Структура и механизм [ править ]
Несмотря на то, что для каждой мономерной единицы (нуклеотидов) имеется только четыре варианта выбора, по сравнению с 20 боковыми цепями аминокислот, обнаруженными в белках, рибозимы имеют различные структуры и механизмы. Во многих случаях они способны имитировать механизм, используемый их белками. Например, в саморасщепляющихся рибозимных РНК проточная реакция SN2 осуществляется с использованием 2′-гидроксильной группы в качестве нуклеофила, атакующего мостиковый фосфат и заставляющего 5′-кислород основания N + 1 действовать как уходящая группа. Для сравнения, РНКаза А, белок, который катализирует ту же реакцию, использует координирующий гистидин и лизин, чтобы действовать как основание для атаки на фосфатный остов. [ требуется пояснение ]
Как и многие белковые ферменты, связывание металлов также имеет решающее значение для функционирования многих рибозимов. Часто эти взаимодействия используют как фосфатный остов, так и основание нуклеотида, вызывая резкие конформационные изменения. Существует два класса механизмов расщепления основной цепи фосфодиэфира в присутствии металла. В первом механизме внутренняя 2′-OH группа атакует фосфорный центр по SN 2 механизму. Ионы металлов способствуют этой реакции, сначала координируя фосфатный кислород, а затем стабилизируя оксианион. Второй механизм также следует за SN 2смещение, но нуклеофил происходит из воды или экзогенных гидроксильных групп, а не из самой РНК. Самым маленьким рибозимом является UUU, который может способствовать расщеплению G и A тетрануклеотида GAAA по первому механизму в присутствии Mn 2+ . Причина, по которой этот тринуклеотид, а не комплементарный тетрамер катализирует эту реакцию, может заключаться в том, что спаривание UUU-AAA является самым слабым и наиболее гибким тринуклеотидом среди 64 конформаций, которые обеспечивают сайт связывания для Mn 2+ .
Перенос фосфорила также можно катализировать без ионов металлов. Например, рибонуклеаза поджелудочной железы А и рибозимы вируса гепатита дельта (HDV) могут катализировать расщепление основной цепи РНК посредством кислотно-основного катализа без ионов металлов. Рибозим-шпилька также может катализировать саморасщепление РНК без ионов металлов, но механизм до сих пор неясен.
Рибозим также может катализировать образование пептидной связи между соседней аминокислотой за счет снижения энтропии активации.
Изображение, показывающее разнообразие структур рибозима. Слева направо: свинец, рибозим в форме головки молотка, рибозим-вертушка.




![Глава 12 происхождение жизни. возникновение трансляции, репликации, метаболизма и мембран: биологический, геохимический и космологический подходы. логика случая [о природе и происхождении биологической эволюции]](http://mediaex.ru/wp-content/uploads/5/0/1/50146fa46d90410a3b6f3a0ef80f8f4b.jpeg)























![Глава 12 происхождение жизни. возникновение трансляции, репликации, метаболизма и мембран: биологический, геохимический и космологический подходы. логика случая [о природе и происхождении биологической эволюции]](http://mediaex.ru/wp-content/uploads/6/8/c/68c0bac6685b1bbfa07cf96abca152f8.jpeg)