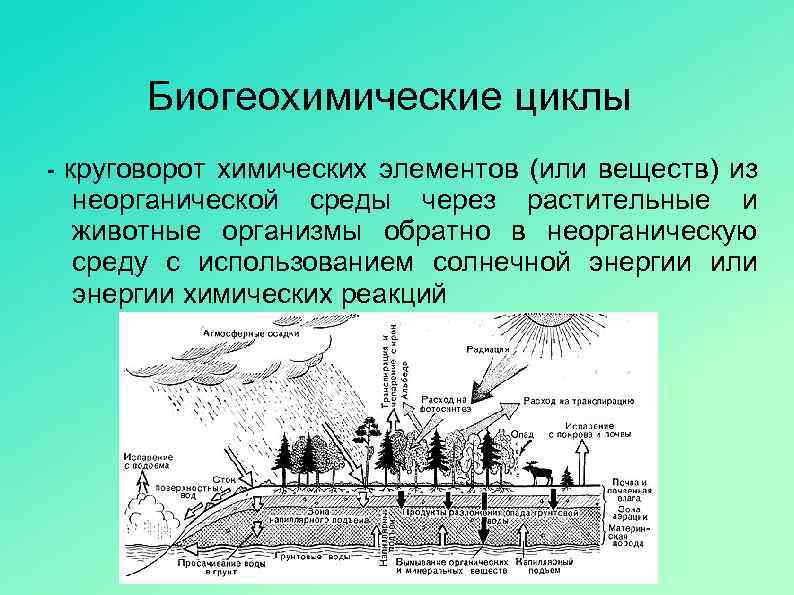
Формы углерода
Углерод присутствует в природе в нескольких основных формах:
- восстановленная форма в виде метана и других углеводородов он содержится в мантии, коре, атмо- и гидросфере
- в нейтральном состоянии в виде графита, алмаза и карбида в коре и мантии
- в окисленной форме в виде углекислого газа, карбонатов и примеси в силикатах в мантии, коре и атмо- и гидросфере
- в виде сложных биоорганических соединений углерод сосредоточен в биосфере, почве, и океане.
Перенос углерода между различными геохимическими резервуарами осуществляется через атмосферу и мировой океан. При этом углерод в атмосфере находится в виде углекислого газа и метана.
Углерод в атмосфере
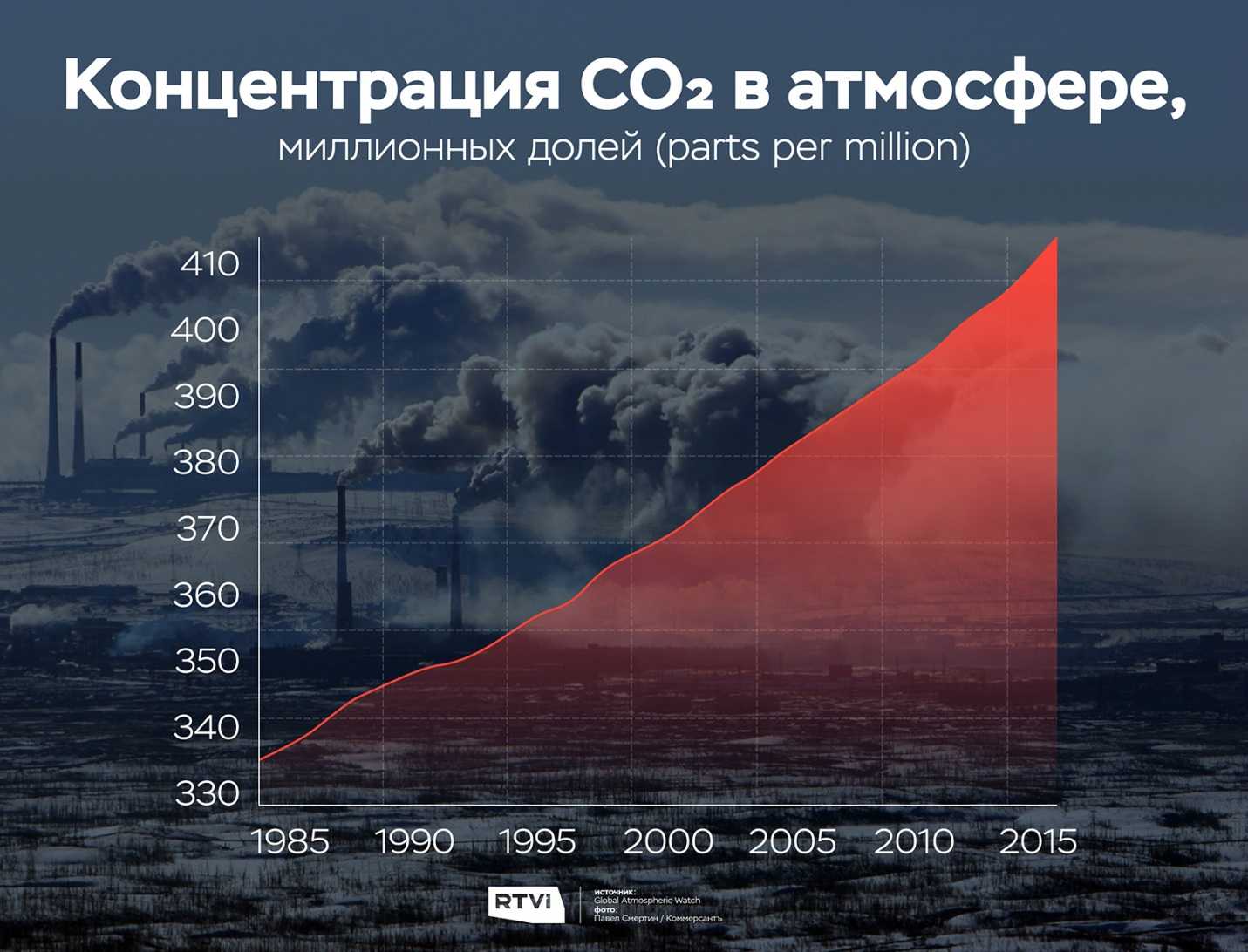
В атмосфере углерод содержится в виде углекислого газа, угарного газа, метана и некоторых других углеводородов. Содержание СО2 сейчас составляет ~0.04 % (увеличилось на 31 %, по сравнению с доиндустриальной эпохой), метана ~1.7 ppm (увеличился на 149 %), на два порядка меньше, чем СО2; содержание СО ~0.1 ppm. Метан и углекислый газ обладают парниковым эффектом, угарный газ такого влияния не оказывает.
Для атмосферных газов применяется понятие время жизни газа в атмосфере, это время за которое в атмосферу поступает столько же газа, сколько его содержится в атмосфере. Время жизни метана оценивается в 10-14 лет, а время жизни углекислого газа оценивается в 3-5 лет. СО окисляется до СО2 за несколько месяцев.
Метан поступает в атмосферу в результате анаэробного разложения растительных остатков. Основными источниками поступления метана в современную атмосферу являются болота и тропические леса.
Современная атмосфера содержит большое количество кислорода, и метан в ней быстро окисляется. Таким образом, сейчас доминирующем циклом является кругооборот CO2, однако в ранней истории Земли ситуация была принципиально иной и метановый цикл доминировал, а углекислотный имел подчинённое значение. Углекислый газ атмосферы является источником углерода для других приповерхностных геосфер.
Углерод в океане
Океан является исключительно важным резервуаром углерода. Общее количество элемента в нём в 100 раз больше чем содержится в атмосфере. Океан через поверхность может обмениваться с углекислым газом с атмосферой, и посредством осаждения и растворения карбонатов с осадочным чехлом Земли. Растворенный в океане углерод существует в трех основных формах:
- неорганический углерод
- растворённый CO2
- HCO3—
- CO32-
- органический углерод, сосредоточенный в океанических организмах
Гидросферу можно разделить на три геохимических резервуара: приповерхностный слой, глубокие воды и слой реактивных морских осадков, способных к обмену углекислотой с водой. Эти резервуары различаются по времени отклика на внешние изменения углеродного цикла.
Углерод в земной коре
Содержание углерода в земной коре составляет порядка 0.27 %. С началом индустриальной эпохи человечество стало использовать углерод из этого резервуара и переводить его в атмосферу. Ещё академик Вернадский сравнивал этот процесс с мощной геологической силой, подобной эрозии или вулканизму.
Человеческая деятельность участвует в углеродном цикле
Люди меняют углеродный цикл (1990–1999).
Количество углерода, выбрасываемого в атмосферу в результате деятельности человека, составляет:
- 6,4 Гт / год в 1990-е годы ;
- 7,2 Гт / год на период 2000-2005 гг .;
- 10 Гт / год за 2000-2006 годы в соответствии с Национальной академии наук в США , или на 37% больше , чем в 1990 году.
Около половины этого углерода реабсорбируется биосферой в результате увеличения фотосинтеза и океанами в результате растворения .
Таким образом, количество углерода в атмосфере увеличилось с 3,2 до 3,3 Гт / год в период 1990-1999 гг.
Горение
Концентрации и потоки CO 2 атмосферный.
Нефтяная вышка в Мексиканском заливе .
Наиболее очевидные человеческие вмешательства:
- массовое сжигание органических веществ из-за вырубки лесов ,
- горение углеродистых пород ( уголь , нефть , природный газ ), которые выделяют большое количество углекислого газа и метана.
Производство цемента
Изготовление цемента является, наряду с другими процессами, с помощью прокаливания из известняка в прокаливания печах , отличающийся тем , CaCO 3превращается в CaO ( известь ) с выделением CO 2 в воздухе : Минерал или порода CaCO 3 → твердый CaO + CO 2газ
Этот первоначальный выброс CO 2когда кальцинирование известняка не вызывает большого беспокойства. Действительно, при использовании произведенного цемента сложная физико-химическая реакция схватывания растворов и бетонов поглощает CO 2.содержится в воздухе в тех же пропорциях. Первоначально преобразование негашеной извести в гашеную производится добавлением воды (H 2 O). Эта операция тушения, проводимая в промышленном гидраторе, производит гидроксид кальция Ca (OH) 2 с сильным выделением тепла:CaO + H 2 O→ Са (ОН) 2+ 1 155 кДж / кг
Во-вторых, так называемая «воздушная» известь закрепляется за счет карбонизации , то есть повторного поглощения как можно большего количества углекислого газа (CO 2) присутствует в атмосфере, чем было выпущено ранее: Са (ОН) 2+ CO 2→ СаСО 3 + Н 2 О
С другой стороны, для первоначального обжига требуется много энергии, часто ископаемого происхождения. Именно из-за этого обжига производство цемента является источником приблизительно от 7 до 8% общих выбросов CO 2 . в мировом масштабе.
Потребление энергии из ископаемого топлива вызывает низкий расход (0,2 Гт / год ), хотя и немаловажный; накопление углерода в известняковых породах будет происходить с эквивалентной или немного большей скоростью .
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует с неметаллами при нагревании
| Реагент | Уравнение | Описание |
|---|---|---|
| O2 | 2C + O2 →to 2CO↑2CO + O2 →to 2CO2↑ | Продуктами горения углерода являются CO и CO2(монооксид углерода и диоксид углерода соответственно).
Известен также неустойчивый недооксид углерода C3O2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты.
На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит). |
| S Se | C + S →to CS2 C + Se →to CSe2 | При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2.
Получен селенид углерода CSe2. |
| H2 F2 | C + 2H2 → to,P, cat CH4↑ C + 2F2 →>900oC CF4 | Из углерода можно получить метан в присутствии оксидов железа, однако гораздо практичнее получать метан из синтез газа.
Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C. |
| Si | C + Si →to SiC | При сплавлении получается карбид кремния. |
| N2 | 2C + N2 →to (CN)2 | При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан.
При высоких температурах взаимодействием углерода со смесью H2 и N2 получают синильную кислоту:
Также такой же реакцией получают циан
|
| P | Не реагирует |
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения.
| Уравнение | Описание |
|---|---|
| C + H2O →to CO↑ + H2↑ | Важна в промышленности реакция углерода с водяным паром для получения синтез газа |
| 3C + S + 2KNO3 →to K2S + 3CO2↑ + N2↑ | Горение чёрного пороха. |
| 5C + 4KNO3 → 2K2CO3 + 3CO2↑ + 2N2↑ C + 2KNO3 → 2KNO2 + CO2↑ | С калиевой селитрой углерод проявляет восстановительные свойства. |
| 3C + BaSO4 → BaS + 2CO↑ + CO2↑ | Восстанавливает сульфат бария |
| C + MxOy →to M + CO↑ C + CaO → 2500oC CaC2 + CO↑ | При сплавлении углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. |
С большинством металлов углерод образует карбиды, например:
- 4Al + 3C →t Al4C3
- Ca + 2C →t CaC2
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Токсическое действие углерода
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5—0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)⋅109 Бк/сутки 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и лёгких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14С (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0⋅104 Бк/л, предельно допустимое поступление через органы дыхания 3,2⋅108 Бк/год.
- https://www.poznavayka.org/himiya/uglerod
- https://wiki2.org/ru/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
- http://lifebio.wiki/%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
- https://www.alto-lab.ru/elements/uglerod
Глава 1 Теоретические основы научного знания о природе и сущности климатических изменений на Земле
- О разной трактовке понятия «климат» Здесь дать определения с указанием источников)
- О прошлых и современных дискуссиях на тему о современном глобальном потеплении (или похолодании) климата
- О недостаточности научных знаний о природе, сущности, причинах и следствиях климатических изменений на Земле для составления достоверного прогноза изменения климата даже на ближайшие десятилетия.
- О причинах этой недостаточности (изменение климата во времени и пространстве как функции от множества взаимосвязанных процессов продолжительностью от миллионов до десятков лет, имеющих как космическое, так и земное происхождение).
- О широком спектре научных направлений, продолжающих вносить свой вклад в решение данной проблемы («старые науки» география, астрономия, физика и др. и новые, работающих на стыке научных направлений – экологии и химии, биологии и физики атмосферы, экологии и географии, геотектоники и климатологии, астрономии и медицины, математики и физики и многих других).
Любая дискуссия нуждается в базе знаний, и в этой главе мы обобщим теоретические основы, которые необходимы в дебатах об изменении климата. Существует минимум простых формул, связанных с введением таких понятий, как парниковый эффект или чувствительность климата. Возникают различные вопросы, связанные с чувствительностью климатической системы и к механизмам, посредством которых образование парниковых газов естественными или антропогенными процессами повлияет на их концентрацию в атмосфере. Естественно, нам нужно определение климата в отличие от повседневной погоды. На самом деле климат, который и является предметом климатологии, как науки, является более широким понятием, чем просто «средняя погода». Самое простое и эффективное различие между погодой и климатом — это популярная поговорка «Климат — это то, что вы ожидаете, погода — это то, что вы получаете». Высказывание приписывается Марку Твену, но впервые появляется в романе «Достаточно времени для любви» фантаста Хайнлайна (1973 год). Однако об этом прямо сообщил Эдвард Лоренц в статье, которая никогда не публиковалась.Исторические инструментальные данные о климате восходят к 1880-м годам, когда люди начали регулярно измерять температуру на метеостанциях и на кораблях, пересекающих Мировой океан. Эти данные показывают четкую тенденцию к потеплению в течение 20-го века. Тем не менее остается резонным вопрос, могут ли эти записи быть искажены различными факторами, например, тем фактом, что непропорционально большое количество метеостанций находится вблизи городов. Несмотря на то, что ученые регулярно исправляют эти потенциальные ошибки при моделировании и воспроизведении глобальных температур, остается ряд разногласий в недостаточности научных знаний о природе в разрезе глобального климата планеты, сущности и его причинах, а также факторов, способных в корне повлиять на динамику климата
Как следствие, остаётся логичным вопрос, достаточно ли факторов было принято во внимание для составления достоверного прогноза изменения климата даже на ближайшие десятилетия
Поглотители двуокиси углерода
Поглотителями называют любые искусственные или природные системы, которые впитывают из воздуха углекислый газ. Поглотитель — это структура, которая вбирает из воздуха больше CO2 чем выбрасывает в него.
Природные поглотители
Леса способны воздействовать на количество двуокиси углерода в воздухе. Они могут быть и поглотителями, и источниками выбросов параллельно (при вырубке). Когда деревья увеличиваются, а лес растет, то углекислый газ поглощается. Данный процесс считается основой развития биомассы. Выходит, что прогрессирующий лес выступает поглотителем.
Лес северного полушария
При сжигании и уничтожении леса основная доля накопленного углерода опять преобразуется в углекислый газ. В итоге лес снова является источником СО2.
Фитопланктон также является поглотителем углекислого газа на земле. При этом большая часть поглощенного углерода, передаваясь по пищевой цепочке, остается в океане.
Искусственные поглотители
Самыми известными поглотителями СО2 считаются: раствор едкого калия, натронная известь и асбест, едкий натр.
Эти соединения при протекании химических реакций связывают углекислоту, преобразовывая ее в другие соединения. Существуют установки, которые улавливают углекислый газ из выбросов электростанций и преобразуют его в жидкое или твердое состояние с последующим применением в промышленности. Производятся испытания закачки углекислого газа, растворенного в воде, в базальтовые породы под землей. В процессе реакции образуется твердый минерал.
Станция закачки углекислого газа под землю
Приложения
Список используемой литературы
- Аллен А.П., Гиллули Дж. Ф., Браун Дж. Х. (2005) Связь глобального углеродного цикла с индивидуальным метаболизмом . Функциональная экология, 19, 202–213.
- Жерар Борвон, История углерода и CO2. От происхождения жизни до изменения климата , Vuibert , 2013 г., 256 страниц.
- Ферментация
- Окаменелость
- Седиментация
- Дыхание
- Фотосинтез
- Горение
- Биосфера
- Гидросфера
- Литосфера
- Атмосфера
- Геологическое хранение углерода
- Углеродный сток
- Выход из ископаемого топлива
- Углеродный след
- Биогеохимический цикл кремния
внешние ссылки
- Авторитетные записи :
- Примечания в общих словарях или энциклопедиях :
- Ресурс, связанный со здоровьем
(ru) Медицинские тематические рубрики
:
- Цикл ребалансировки углерода (дюйм )
|
Биогеохимический цикл |
|---|
|
|
Углерод |
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Аллотропные формы углерода |
|
||||||||||
| Производные аллотропных форм |
|
||||||||||
| Ископаемый углерод |
|
||||||||||
| Другие формы |
|
||||||||||
| Изотопы |
|
Основные парниковые газы
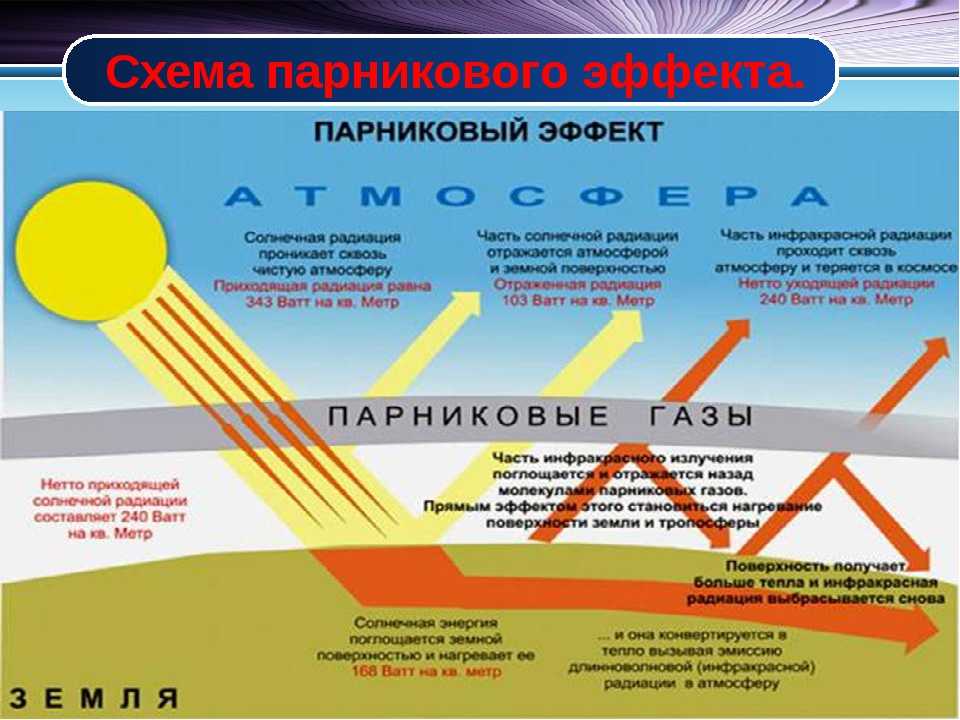
Индустриальное развитие и экономическая деятельность человека ведет к постоянно растущему образованию примесей, создающих губительный парниковый эффект.
Водяной пар
Одним из основных газов природного происхождения является водяной пар, составляющий 60% от всего парникового явления.
Главной причиной в образовании этой глобальной проблемы стало повышение температуры воздуха, что привело к увеличению содержащейся в атмосфере влаги при сохранении относительной влажности.
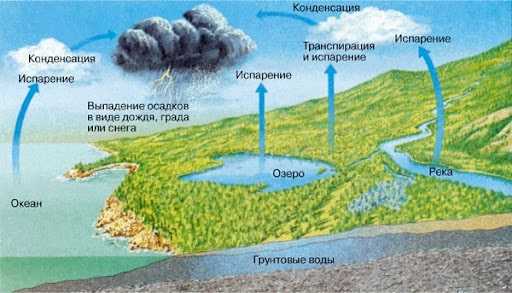
Именно это и стало толчком для усиления парникового эффекта, а температура продолжает расти и по сей день. На сегодня температура на 1,5ºС больше нормы и, если гипотетически остановить все заводы мира, выбрасывающие вредные газы, то она еще не изменится в течение 20 лет.
Это говорит о серьезности проблемы.
Высокая концентрация этого пара ведет к возникновению антипарникового явления – формированию облаков. Именно он способствует росту облачности и изменению годовых норм выпадения осадков, что, в свою очередь, сказывается в росте паводков и наводнений в населенных пунктах.
Углекислый газ
Но самое неблагоприятное влияние на климат оказывает углекислый газ (СО2), источниками которого становятся вулканы с их выбросами и человек со своей активной деятельностью.
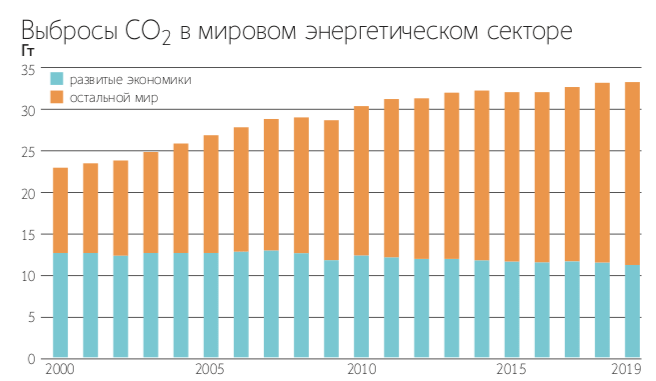
Растительность, поглощающая СО2 в процессе фотосинтеза, является самым важным, созданным природой хранилищем этого газа.
Тропосферный озон
Принадлежащий к числу парниковых газов озон в слоях тропосферы, непосредственно влияет на наш климат через поглощение волн радиации Земли и Солнца.
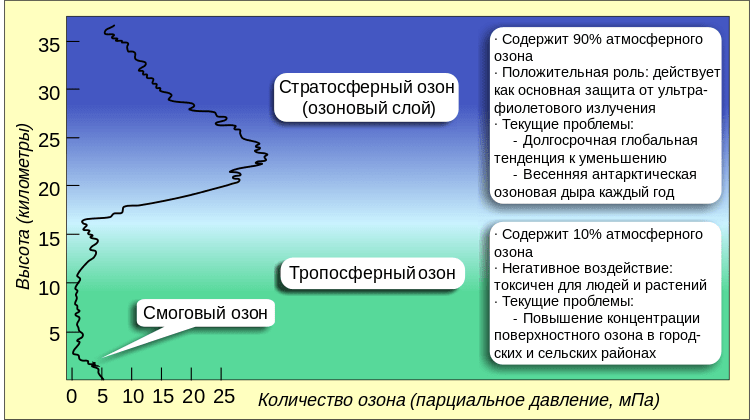
Посредством химических реакций, он изменяет объемы прочих парниковых газов, к примеру, метана (CH4)
Тропосферный озон отвечает за образование важного окислителя парниковых газов – радикала ОН
Влияние глобального потепления на углеродный цикл
Углеродный цикл зависит от климата и наоборот. Взаимодействия сложны: одни явления способствуют положительной обратной связи , другие — отрицательной . Не все явления полностью идентифицированы и количественно определены, но мы все же можем назвать несколько:
- CO 2и атмосферный метан вносят вклад в парниковый эффект : увеличение их скорости является фактором глобального потепления.
- Глобальное потепление снижает растворение CO 2.в океанах: растворимость углекислого газа в океанах зависит от их температуры. Если эта температура увеличивается, способность океанов накапливать неорганические вещества уменьшается, и они сами начинают выделять углекислый газ. Возникновение такого порочного круга было бы катастрофой.
- Глобальное потепление может уменьшить перенос CO 2в сторону глубоких вод и, таким образом, еще больше уменьшит его растворение в поверхностных водах. Если он станет слишком большим, он также может значительно уменьшить океаническое осаждение за счет замедления или даже подавления в определенных широтах глубоководных океанических течений ныряющих (на уровне Гренландии для Гольфстрима и в Тихом океане для азиатской ветви). ) холодные и более соленые воды, насыщенные углекислым газом. Даже если это осаждение очень низкое, именно оно генерирует все карбонатные породы, то есть содержащие карбонаты, такие как карбонат кальция ( известняк ).
- Глобальное потепление увеличивает разложение органического вещества в мерзлых почвах ( вечная мерзлота ) и торфяных средах , в результате чего выделяется CO 2.и метан , усиливающий дополнительный парниковый эффект.
Формы углерода
Углерод присутствует в природе в нескольких основных формах:
- восстановленная форма в виде метана и других углеводородов он содержится в мантии, коре, атмо- и гидросфере
- в нейтральном состоянии в виде графита, алмаза и карбида в коре и мантии
- в окисленной форме в виде углекислого газа, карбонатов и примеси в силикатах в мантии, коре и атмо- и гидросфере
- в виде сложных биоорганических соединений углерод сосредоточен в биосфере, почве, и океане.
Перенос углерода между различными геохимическими резервуарами осуществляется через атмосферу и моровой океан. При этом углерод в атмосфере находится в виде углекислого газа и метана.
Углерод в атмосфере
В атмосфере углерод содержится в виде углекислого газа, угарного газа, метана и некоторых других углеводородов. Содержание СО2 сейчас составляет ~0.04 % (увеличилось на 31 %, по сравнению с доиндустриальной эпохой), метана ~1.7 ppm (увеличился на 149 %), на два порядка меньше, чем СО2; содержание СО ~0.1 ppm. Метан и углекислый газ обладают парниковым эффектом, угарный газ такого влияния не оказывает.
Для атмосферных газов применяется понятие время жизни газа в атмосфере, это время за которое в атмосферу поступает столько же газа, сколько его содержится в атмосфере. Время жизни метана оценивается в 10-14 лет, а время жизни углекислого газа оценивается в 3-5 лет. СО окисляется до СО2 за несколько месяцев.
Метан поступает в атмосферу в результате анаэробного разложения растительных остатков. Основными источниками поступления метана в современную атмосферу являются болота и тропические леса.
Современная атмосфера содержит большое количество кислорода, и метан в ней быстро окисляется. Таким образом, сейчас доминирующем циклом является кругооборот CO2, однако в ранней истории Земли ситуация была принципиально иной и метановый цикл доминировал, а углекислотный имел подчинённое значение. Углекислый газ атмосферы является источником углерода для других приповерхностных геосфер.
Углерод в океане
Океан является исключительно важным резервуаром углерода. Общее количество элемента в нем в 100 раз больше чем содержится в атмосфере. Океан через поверхность может обмениваться с углекислым газом с атмосферой, и посредством осаждения и растворения карбонатов с осадочным чехлом Земли. Растворенный в океане углерод существует в трех основных формах:
- неорганический углерод
- растворённый CO2
- HCO3—
- CO32-
- органический углерод, сосредоточенный в океанических организмах
Гидросферу можно разделить на три геохимических резервуара: приповерхностный слой, глубокие воды и слой реактивных морских осадков, способных к обмену углекислотой с водой. Эти резервуары различаются по времени отклика на внешние изменения углеродного цикла.
Углерод в коре
Содержание углерода в земной коре составляет порядка 0.27 %. С началом индустриальной эпохи челолвечество стало извлекать углерод из этого резервуара и переводить его в атмосферу. Ещё академик Вернадский сравнивал этот процесс с мощной геологической силой, подобной эрозии или вулканизму.
Резервуары углерода
Рассмотрение углеродного цикла имеет смысл начать с оценок количества углерода сосредоточенного в различных земных резервуарах. При этом мы будем рассматривать состояние системы на 1850 год, до начала индустриальной эры, когда начались массовые выбросы в атмосферу продуктов сжигания ископаемого топлива.
В атмосфере находится не много углерода по сравнению с океаном и земной корой, но углекислый газ атмосферы очень активен, он является строительным материалом для земной биосферы.
Метан не стабилен в современной окислительной атмосфере, в верхних слоях атмосферы при участии гидроксил ионов он реагирует с кислородом, образуя всё тот же углекислый газ и воду. Основными производителями метана являются анаэробные бактерии, перерабатывающие образовавшуюся в результате фотосинтеза органику. Большая часть метана поступает в атмосферу из болот.
Для газов атмосферы введено понятие времени жизни, это то время, за которое в атмосферу поступает масса газа равная массе этого газа в атмосфере. Для СО2 время жизни оценивается в 5 лет. Как это ни странно, но время жизни неустойчивого в атмосфере метана значительно больше — порядка 15 лет. Дело в том, что атмосферный углекислый газ участвует в исключительно активном кругообороте с наземной биосферой и мировым океаном, в то время как метан в атмосфере только разлагается.
| Резервуар | количество углерода в мегатоннах С |
|---|---|
| Атмосфера | 590 |
| Океан | (3.71 — 3.9)*104 |
| поверхностный слой, неорганический углерод | 700—900 |
| глубокие воды, неорганический углерод | 35600 — 38000 |
| весь биологический углерод океанов | 685—700 |
| Пресноводная биота | 1 — 3 |
| наземная биота и почвы | 2000—2300 |
| растения | 500—600 |
| почвы | 1500 — 1700 |
| Морские осадки способные кобмену углеродом с океанической водой | 3000 |
| неорганические, главным образом карбонатные осадки | 2500 |
| органические осадки | 650 |
| Кора | (7.78 — 9.0)*107 |
| осадочные карбонаты | 6.53*107 |
| органический углерод | 1.25*107 |
| Мантия | 3.24*108 |
| Ресурсы и резервы ископаемого топлива | (7.78 — 9.0)*107 |
| Нефть | 636—842 |
| Природный газ | 483—564 |
| Уголь | (3.10 — 4.27)*10³ |
Резервуары углерода
Рассмотрение углеродного цикла имеет смысл начать с оценок количества углерода сосредоточенного в различных земных резервуарах. При этом мы будем рассматривать состояние системы на 1850 год, до начала индустриальной эры, когда начались массовые выбросы в атмосферу продуктов сжигания ископаемого топлива.
В атмосфере находится не много углерода по сравнению с океаном и земной корой, но углекислый газ атмосферы очень активен, он является строительным материалом для земной биосферы.
Метан не стабилен в современной окислительной атмосфере, в верхних слоях атмосферы при участии гидроксил ионов он реагирует с кислородом, образуя всё тот же углекислый газ и воду. Основными производителями метана являются анаэробные бактерии, перерабатывающие образовавшуюся в результате фотосинтеза органику. Большая часть метана поступает в атмосферу из болот.
Для газов атмосферы введено понятие времени жизни, это то время, за которое в атмосферу поступает масса газа равная массе этого газа в атмосфере. Для СО2 время жизни оценивается в 5 лет. Как это не странно, но время жизни неустойчивого в атмосфере метана значительно больше — порядка 15 лет. Дело в том, что атмосферный углекислый газ участвует в исключительно активном кругообороте с наземной биосферой и мировым океаном, в то время как метан в атмосфере только разлагается.
| Резервуар | количество углерода в мегатоннах С |
|---|---|
| Атмосфера | 590 |
| Океан | (3.71 — 3.9)*104 |
| поверхностный слой, неорганический углерод | 700—900 |
| глубокие воды, неорганический углерод | 35600 — 38000 |
| весь биологический углерод океанов | 685—700 |
| Пресноводная биота | 1 — 3 |
| наземная биота и почвы | 2000—2300 |
| растения | 500—600 |
| почвы | 1500 — 1700 |
| Морские осадки способные к обмену углеродом с океанической водой |
3000 |
| неорганические, главным образом карбонатные осадки | 2500 |
| органические осадки | 650 |
| Кора | (7.78 — 9.0)*107 |
| осадочные карбонаты | 6.53*107 |
| органический углерод | 1.25*107 |
| Мантия | 3.24*108 |
| Ресурсы и резервы ископаемого топлива | (7.78 — 9.0)*107 |
| Нефть | 636—842 |
| Природный газ | 483—564 |
| Уголь | (3.10 — 4.27)*10³ |
Геохимический круговорот углерода.
Извлечение углекислого газа из атмосферы.
Углекислый газ из атмосферы Земли извлекается зелеными растениями в процессе фотосинтеза, который осуществляется посредством пигмента хлорофилла, использующего энергию солнечного излучения. Полученный из атмосферы углекислый газ растения преобразуют в углеводы и кислород. Углеводы участвуют в образовании органических соединений растений, а кислород выделяется обратно в атмосферу.
Связывание углекислого газа.
В активном круговороте углерода участвует очень небольшая часть всей его массы. Огромное количество угольной кислоты законсервировано в виде ископаемых известняков и других пород. Между углекислым газом атмосферы Земли и водой океана, в свою очередь, существует подвижное равновесие.
Благодаря высокой скорости размножения растительные организмы (особенно низшие микроорганизмы и морской фитопланктон) продуцируют в год около 1,5-1011 т углерода в виде органической массы, что соответствует 5,86-1020 Дж (1,4-1020 кал) энергии.
Растения частично поедаются животными, при отмирании которых органическое вещество отлагается в виде сапропеля, гумуса, торфа, которые, в свою очередь, дают начало многим другим каустобиолитам — каменным углям, нефти, горючим газам.
В процессах распада органических веществ, их минерализации огромную роль играют бактерии (например, гнилостные), а также многие грибы (например, плесневые).
Основные запасы углерода находятся в связанном состоянии (в основном в составе карбонатов) в осадочных породах Земли, значительная часть растворена в водах океана, и относительно небольшая – присутствует в составе воздуха.
Отношение количеств углерода в литосфере, гидросфере и атмосфере Земли, по уточненным расчетам, составляет 28 570 : 57 : 1.
Как углекислый газ возвращается снова в атмосферу Земли?
Углекислый газ выделяется в атмосферу Земли:
— в процессе дыхания живых организмов и разложения их трупов, распада карбонатов, процессов брожения, гниения и горения;
— зеленые растения, днем поглощая углекислый газ из атмосферы в процессе фотосинтеза, ночью некоторую его часть возвращают обратно;
— в результате деятельности вулканов, газы которых состоят в основном из углекислого газа и паров воды. Современный вулканизм в среднем приводит к выделению 2·108 тонн CO2 в год, что составляет величину менее 1 % от антропогенной эмиссии (выделенной в результате человеческой деятельности);
— в результате индустриальной деятельности человека, в последние годы занявшей особое место в круговороте углерода. Массовое сжигание ископаемого топлива ведет к возрастанию содержания углерода в атмосфере, так как только 57% процентов производимого человечеством углекислого газа перерабатывается растениями и поглощается гидросферой. Массовая вырубка лесов также ведет к увеличению концентрации углекислоты в воздухе.
Применение
Графит используют в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Алмаз благодаря исключительной твердости — незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бурмашин. Кроме этого, ограненные алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая себестоимость добычи алмазов ($97,47 за один карат) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности, углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является CO2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.