Ингибиторы электронной транспортной цепи
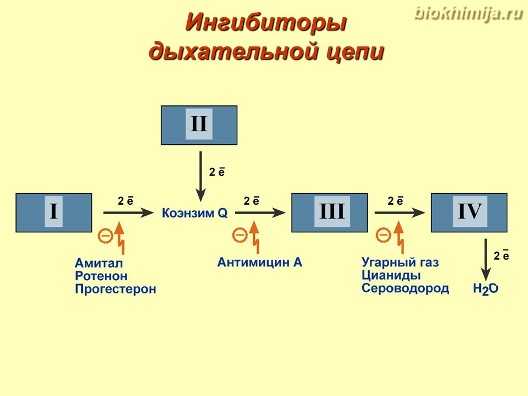
Некоторые специфические ингибиторы действуют на электронную транспортную цепь, вмешиваясь в ее процесс. Ротенон — это широко используемый инсектицид, который стехиометрически связывается с комплексом I, предотвращая восстановление CoQ.
Некоторые препараты типа барбитуратов, такие как Пиерицидин и Амитал, ингибируют комплекс I, препятствуя передаче электронов от групп Fe-S к CoQ.
В комплексе II некоторые соединения, такие как теноилтрифторацетон и малонат, действуют как конкурентные ингибиторы сукцината, предотвращая его окисление и, в свою очередь, перенос электронов на FAD.
Некоторые антибиотики, такие как миксотиазол и стигмателлин, связываются с Q-связывающими сайтами CoQ, ингибируя перенос электронов от кофермента Q к Fe-S-центрам белков.
Цианид, азид (N3-), серная кислота и окись углерода ингибируют комплекс IV. Эти соединения связываются с гемовыми группами, предотвращая перенос электронов к биядерному центру комплекса или к кислороду (O2).
Подавляя цепь переноса электронов, производство энергии останавливается за счет окислительного фосфорилирования, вызывая серьезные повреждения и даже смерть организма.
Подсчёт АТФ: сколько молекул можно получить с помощью окислительного фосфорилирования?
Теперь, когда мы понимаем все механизмы, можно подсчитать сколько АТФ было получено в ходе катаболизма одной молекулы глюкозы.
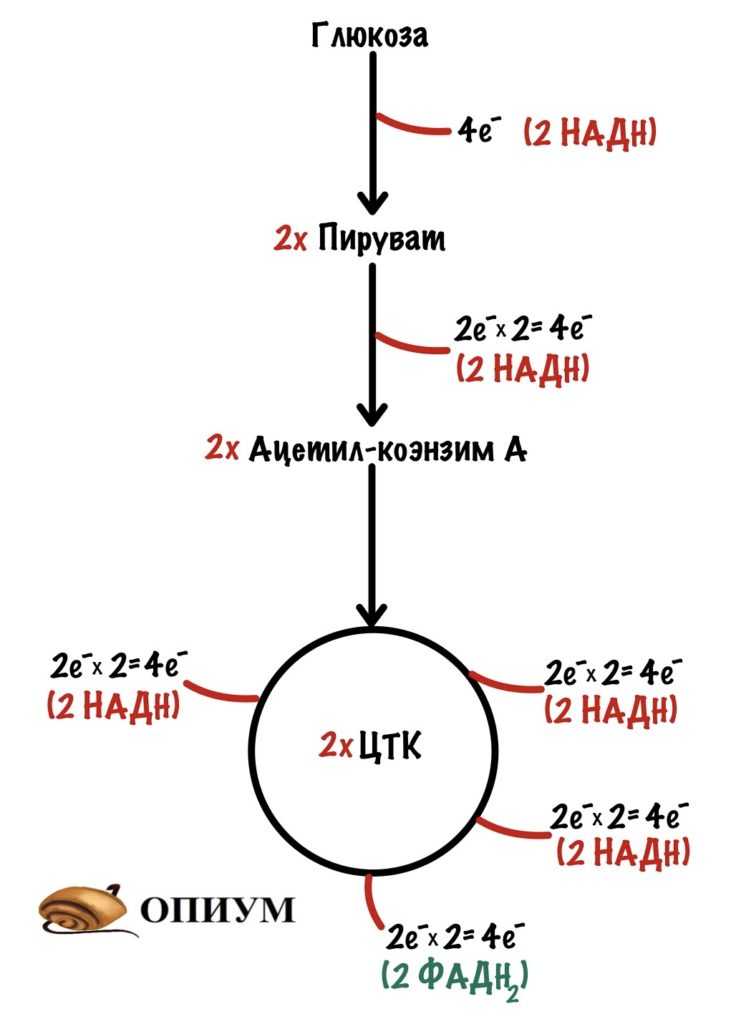
Катаболизм глюкозы. Гликолиз заканчивается образованием двух молекул пирувата. Далее пируват превращается в ацетил-коэнзим А с помощью комплекса. Ацетил-коэнзим А отправляется в цикл трикарбоновых кислот, где будет получены восстановленные коферменты. Из пирувата образуется два ацетил-коэнзима А, поэтому цикл трикарбоновых кислот будет проходить дважды.
В ходе гликолиза было получено две молекулы НАДH. Они транспортируются в матрикс митохондрий — ведь гликолиз шёл в цитоплазме. Для этого используются челночные механизмы. Глицеролфосфатный челнок переносит электроны с НАДH на ФАД — образуется ФАДH2. Малат-аспартатный переносит электроны на митохондриальный НАД+ — переходит в НАДH
Теперь понимаете, почему это важно? Будет получено разное количество АТФ
Остальные восстановленные коферменты уже находятся в митохондрии, поэтому их электроны можно сразу отправить на дыхательную цепь. Допустим, что мы использовали малат-аспартатный челнок, тогда в матриксе митохондрии находятся: 10 молекул НАДH и 2 молекулы ФАДH2.
10 х 2,5 АТФ + 2 х 1,5 АТФ = 28 молекул АТФ.
Если мы использовали глицеролфосфатный челнок, то в матриксе находятся: 8 молекул НАДH и 4 молекулы ФАДH2.
8 x 2,5 АТФ + 4 х 1,5 АТФ = 26 молекул АТФ.
Но это не общий выход катаболизма глюкозы, потому что в нём были и другие реакции синтеза АТФ — субстратного фосфорилирования. Если вспомнить гликолиз, то там были две таких реакции.
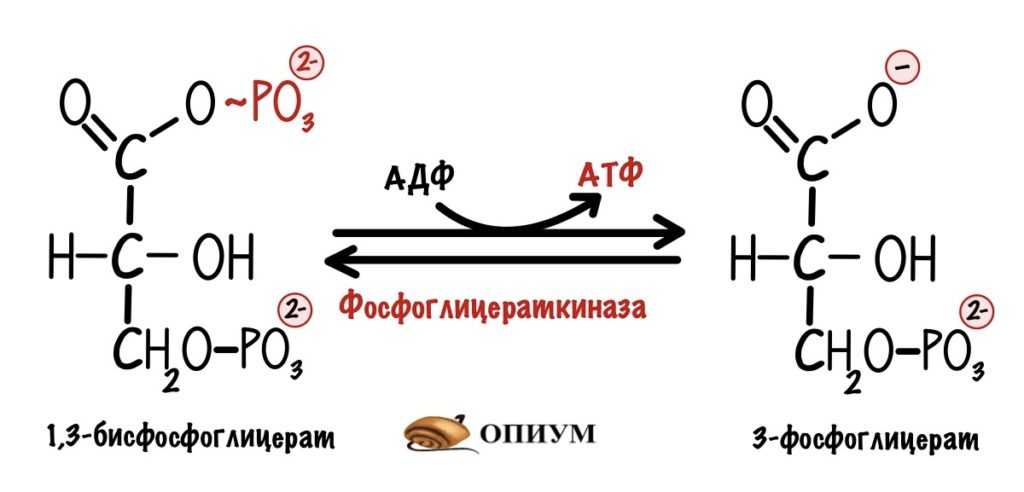 Седьмая реакция гликолиза — субстратное фосфорилирование.
Седьмая реакция гликолиза — субстратное фосфорилирование.
И вот вторая:
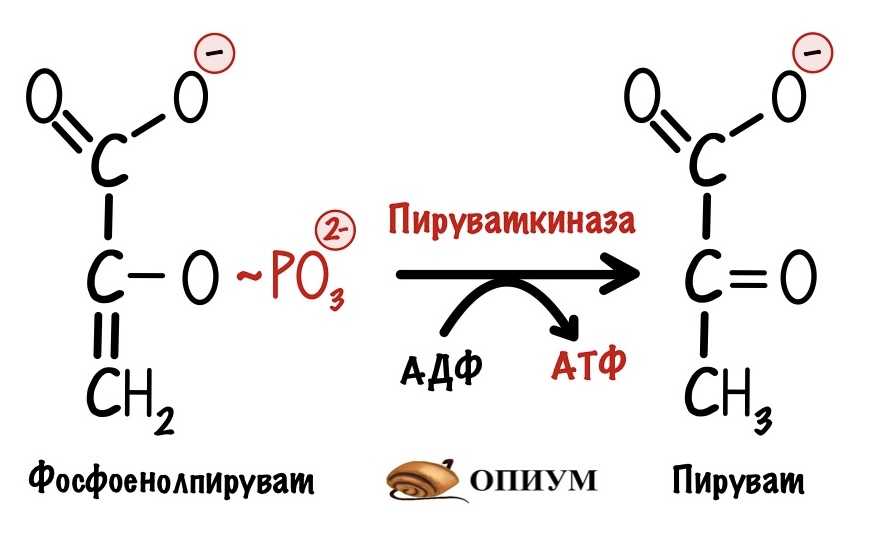 Десятая реакция гликолиза — субстратное фосфорилирование.
Десятая реакция гликолиза — субстратное фосфорилирование.
Мы видим, что из одной триозы образуется ещё 2 молекулы АТФ. Но в ходе гликолиза были образованы две триозы, поэтому всего там было получено 4 молекулы АТФ. Но это ещё не всё…
На активацию молекулы глюкозы мы затратили 2 молекулы АТФ — первая и третья реакции гликолиза.
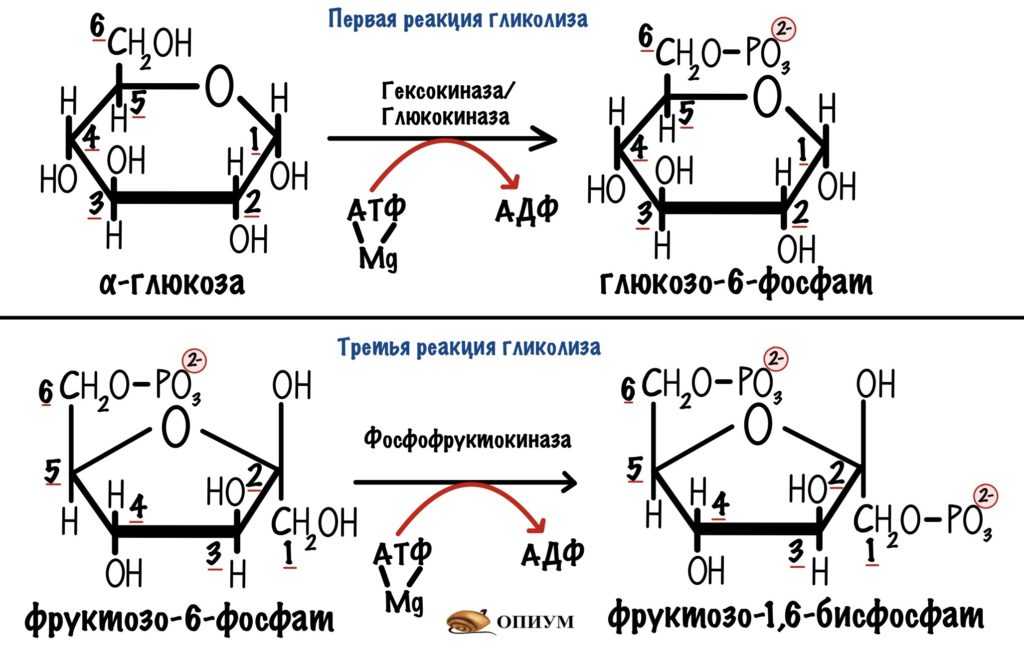
Затрата двух молекул АТФ в ходе гликолиза.
Так что общий выход гликолиза — 2 молекулы АТФ. Но и это ещё не всё!
Вспоминаем цикл трикарбоновых кислот, где были получены ещё две молекулы ГТФ. ГТФ равно АТФ, так как можно легко их переводить друг в друга.
Пятая реакция цикла трикарбоновых кислот
Сделаем общий подсчёт. Гликолиз = 2 АТФ и 2 НАДH. Окислительное декарбоксилирование пирувата = 2 НАДH. ЦТК = 6 НАДH + 2 ФАДH2 + 2 ГТФ (АТФ). Итого:
2 АТФ + 10 НАДH + 2 ФАДH2 + 2 ГТФ (АТФ) = 2 + 25 + 3 + 2 = 32 молекулы АТФ
Это для малат-аспартатного челнока. Если будет использован глицеролфосфатный, то:
2 АТФ + 8 НАДH + 4 ФАДH2 + 2 ГТФ (АТФ) = 2 + 20 + 6 + 2 = 30 молекул АТФ
Дыхательная цепь переноса электронов
Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
2. Электроны движутся по ферментам дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
6. При этом они теряют энергию, которая используется для синтеза АТФ.
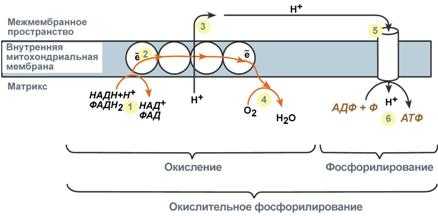
Общий принцип окислительного фосфорилирования
Восстановленные формы НАД и ФАД окисляютсяферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование.
Дыхательная цепь
Всего цепь переноса электронов включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
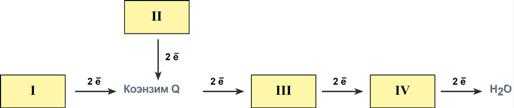
Блок-схема дыхательной цепи
Переносчики электронов
1. Цитохромы с1, c, a, a3 (простетическая группа – гем) располагаются в различных участках дыхательной цепи, цитохром с – подвижный водорастворимый белок, перемещается по внешней стороне мембраны между 3 и 4-ым комплексами. Цитохромы aa3 содержат гем А. Он содержит вместо метильной (-СНз) и винильной (-СН=СН2) групп формильную (-СОН) группу и углеводородную цепь соответственно. Вторая особенность — наличие ионов меди в специальных белковых центрах.
Сu+ <-> Сu2+ + e и Fe2+ <-> Fe3+ + e
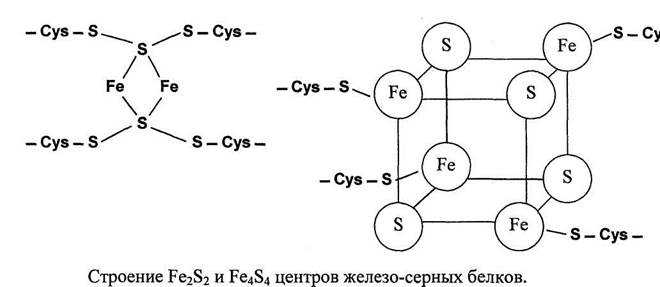
2. Железо-серные белки (FeS) – негемовые белки, функционируют совместно с флавиновыми ферментами (1, 2, 3-й комплексы) 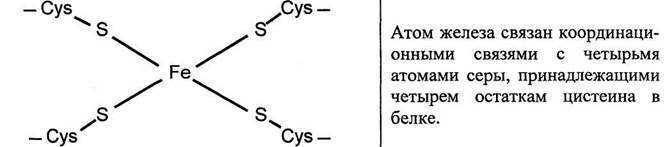
3. FMN (комплекс 1): FMN + NADH + H+ ———FMNH2 + NAD+
(NAD+ + 2e + 2H+ ————- NADH + H+)
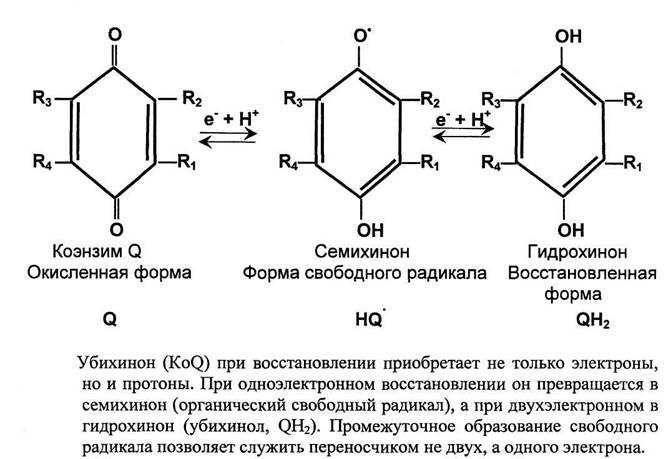
KoQ (убихинон) – небелковый переносчик, комплекс 3.
Длинный гидрофобный «хвост» изопрена обеспечивает подвижность убихинона в липидном бислое.
KoQ и цитохром с – мобильные, все остальные – интегральные белки.
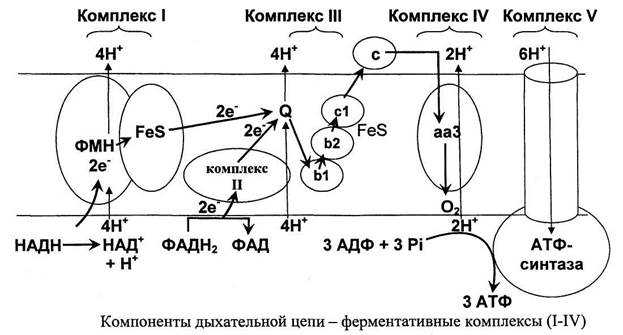
Строение ферментативных комплексов дыхательной цепи
Комплекс. НАДН-КоQ-редуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит 1ФМН, 6 железосерных белков.
1. NADH + H+ + FMN ———2e + 2H+——— NAD+ + FMNH2
2. FMNH2 ————2e——— Fex Sx (Fe2+ <-> Fe3+ + e)
3. Fex Sx ————2e——— KoQ
Функция
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4Н+ на наружную поверхность внутренней митохондриальной мембраны.
Цитохром с оксидаза
Этот фермент (комплекс IV) катализирует окисление цитохрома c (восстановленного) O2, который является конечным акцептором электронов. Этот перенос производит одну молекулу H2O для каждой пары переносимых электронов в дополнение к перемещению протонов через мембрану.
Электроны перемещаются один за другим от восстановленного цитохрома c к паре ионов CuA, затем переходят к гемовой группе и, наконец, достигают биядерного центра комплекса, содержащего ионы CuB и гем a3, где происходит перенос четырех электронов. до кислорода.
В комплексе IV элементы переносят электроны один за другим, так что O2 постепенно восстанавливается, так что не происходит высвобождения некоторых токсичных соединений, таких как супероксид, перекись водорода или гидроксильные радикалы.
Энергия, выделяемая на этой стадии, соответствует -32 ккал / моль. Электрохимический градиент, генерируемый в процессе переноса, и изменения энергии (ΔE), вызванные парой электронов при прохождении через четыре комплекса, соответствуют на каждой стадии свободной энергии, необходимой для производства молекулы АТФ.
викторина
1. Что из следующего является верным утверждением?A. Окислительное фосфорилирование и цепь переноса электронов не связаныB. Окислительное фосфорилирование приводит в движение цепь переноса электроновC. Окислительное фосфорилирование зависит от цепи переноса электронов
Ответ на вопрос № 1
С верно. Процесс присоединения фосфатных групп к АДФ-синтазе АТФ представляет собой процесс фосфорилирования. Энергия, используемая для этого процесса, исходит от окисления различных веществ, и электроны, полученные от этого. Эти электроны генерируют протонный градиент, который управляет АТФ-синтазой.
2. Что случилось бы с клеткой, если бы не было цепи переноса электронов?A. Клетка не будет иметь энергииB. Клетка развалитсяC. Клетка будет иметь меньше энергии
Ответ на вопрос № 2
С верно. В то время как окислительное фосфорилирование действительно обеспечивает огромный запас энергии, клетки могут использовать другие пути для получения энергии. Помните, что цепь переноса электронов нуждается в кислороде. Без кислорода он перестанет работать. Это когда клетки вынуждены прибегать к менее эффективным методам производства энергии, таким как ферментация,
3. Как ученый в своей лаборатории, вы извлекаете митохондрии из вашей собственной клетки и из клеток вашего любимого домашнего растения. Вы кладете каждую митохондрию в маленькое блюдо, окруженное пируватом. Вы измеряете, сколько АТФ делает каждая митохондрия. Что вы ожидаете?A. Митохондрии животных будут производить больше АТФB. Растение митохондрий будет производить больше АТФC. Они будут производить примерно одинаковое количество АТФ
Ответ на вопрос № 3
С верно. Считается, что все митохондрии произошли от одного и того же бактериального предка миллиарды лет назад. Таким образом, у растений и животных они действуют практически одинаково. Основное различие между растениями и животными может заключаться в количестве митохондрий на клетку. Животное может упаковать свои мускул клетки с митохондриями, чтобы обеспечить энергию для сокращений, где растительная клетка может потребоваться лишь горстка митохондрий в каждой клетке, чтобы обеспечить их энергетические потребности.
Строение ферментативных комплексов дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков.
Функция
- Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
- Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
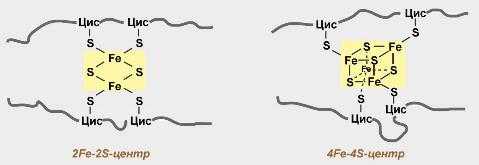
Железосерные белки (FeS-белки) – это белки содержащие атомы железа, которые соединены с атомами серы и с серой остатков цистеина. В результате образуется железо-серный центр.
2 комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода).
Функция
- Восстановление ФАД в окислительно-восстановительных реакциях.
- Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон).
3 комплекс. КоQ-цитохром c-оксидоредуктаза
По другому данный комплекс называется цитохром средуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей.
Функция
- Принимает электроны от коэнзима Q и передает их на цитохром с.
- Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
Имеются разногласия по поводу количества переносимых ионов H+ при участии 3-го и 4-го комплексов. По одним данным, третий комплекс переносит 2 иона H+ и четвертый комплекс переносит 4 иона H+. По другим авторам, наоборот, третий комплекс переносит 4 иона H+ и четвертый комплекс переносит 2 иона H+.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках.
Функция
- Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
- Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
- одна группа формирует субъединицу FО (произносится со звуком «о», а не «ноль» т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
- другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Механизм работы АТФ-синтазы получил название вращательный катализ.
Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н+, и еще один ион H+ используется для транспорта неорганического фосфата в матрикс митохондрии и для антипорта АДФ (в митохондрию) АТФ (в цитозоль). Таким образом, для получения одной молекулы АТФ из АДФ требуется 4 иона Н+.
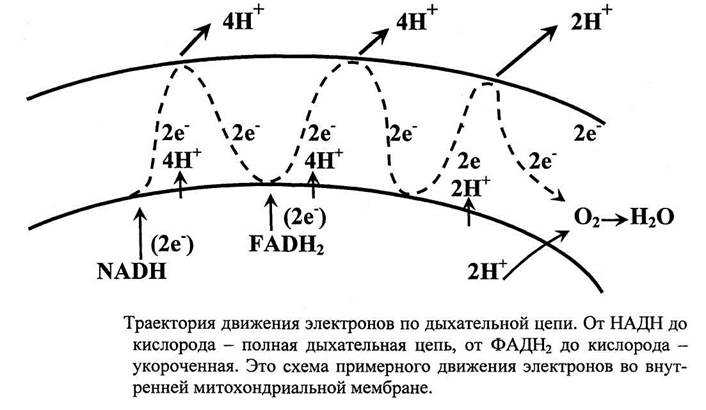
Поскольку при прохождении одной пары электронов по всей дыхательной цепи выкачивается 10 ионов Н+, то окисление одного моля НАДН+Н+ приведет к образованию 2,5 молей АТФ.
Дыхательная цепь (ДЦ) (или Цепь Переноса Электронов ЦПЭ, или Электрон-Транспортная Цепь ЭТЦ)
ДЦ это конвейер по переносу электронов и протонов от восстановленного субстрата к кислороду.
Компоненты ДЦ:
1. Пиридинзависимые ДГ (НАД-, НАДФ-зависимые)
Рабочая часть витамин РР (никотинамид)
НАД + 2Н+ + 2е НАД·Н2
2. ФАД-зависимые ДГ (кофермент в ДЦ ФМН, а акцептор электронов непосредственно от субстрата ФАД. Рабочая часть изоалоксазин.
3. Убихинон (Ko Q). Обладает о/в-свойствами благодаря кето-енольной таутомерии.
4. Цитохромы. Относятся к гемопротеинам, содержат атомы железа, переход степени (23) окисления которого и обеспечивает транспорт электронов (протоны ими не транспортируются !!! ).
В ДЦ цитохромы расположены в следующей последовательности: b — c1 — c — a — a3 .
Совокупность цитохромов b и c1 называют КоQH-дегидрогеназой, т.к. они отщепляют атом водорода от убихинона (KoQ).
Цитохромы а и а3 цитохромоксидазой (т.к. способствуют переносу электронов на молекулярный кислород).
У нас самая большая информационная база в рунете, поэтому Вы всегда можете найти походите запросы
Комплекс III
Комплекс III, комплекс цитохрома bc1 или редуктаза цитохрома c CoQ, переносит электроны от восстановленного кофермента Q на цитохром c. Этот перенос происходит через единственный окислительно-восстановительный путь, известный как Q-цикл.
Этот комплекс состоит из белка с Fe-S и трех различных цитохромов, в которых атом железа, расположенный в гемовой группе, циклически колеблется между восстановленным (Fe2 +) и окисленным (Fe3 +) состояниями.
Цитохромы — это гемопротеины, переносящие электроны, которые обладают окислительно-восстановительной активностью. Они присутствуют во всех организмах, кроме некоторых облигатных анаэробов.
Эти белки имеют гемовые группы, которые чередуются между двумя состояниями окисления (Fe2 + и Fe3 +). Цитохром с — мобильный переносчик электронов, слабо связанный с внутренней мембраной митохондрий.
Цитохромы, обнаруженные в этом комплексе, представляют собой цитохромы b, c и a, все 3 являются окислительно-восстановительными белками с группами hae с разными характеристиками, которые чередуют свои степени окисления между Fe2 + и Fe3 +.
Цитохром c — это белок периферической мембраны, который функционирует как «челнок» электронов с цитохромом c1 и комплексом IV.
. Дыхательная электронтранспортная цепь
. Дыхательная электронтранспортная цепь (ЭТЦ, ETC,) — система структурно и функционально связанных трансмембран-ных белков и переносчиков электронов. ЭТЦ позволяет запасти энергию, выделяющуюся в ходе окисления НАД∙Н и ФАДН2 молекулярным кислородом (в случае аэробного дыхания) или иными веществами (в случае анаэробного) в форме трансмембранного протонного потенциала за счёт по-следовательного переноса электрона по цепи, сопряжённого с перекачкой протонов через мембрану. Компоненты дыхательной цепи. Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-пе-реносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитрат-ному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов. Ком-плексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками. К ним принадлежат флавин , железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена. Электроны поступают в дыхательную цепь различ-ными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см.
Цепь переноса электронов (цпэ).
Цепь переноса электронов (дыхательная цепь) – это сложная система переносчиков, при участии которой происходит процесс последовательного переноса электронов от NADH и FADh3 на O2.
Дыхательной цепи предшествует отнятие атомов водорода от окисляемых субстратов (реакции дегидрирования).
Эти реакции относятся к окислительно-восстановительным.
Их катализируют ферменты оксидоредуктазы (подкласс: дегидрогеназы).
Бóльшая часть окислительно-восстановительных реакций в клетке происходит в матриксе митохондрий.
Реакции дегидрирования происходят в ходе специфических и общего пути катаболизма.
Выделяют 2 типа дегидрогеназ, катализирующие реакции дегидрирования, предшествующие ЦПЭ:
-
NAD+ – зависимые дегидрогеназы (предшественник: витамин PP);
! Субстратов NAD+ – зависимых дегидрогеназ большинство.
Примеры: малат, изоцитрат, -кетоглутарат, глутаминовая кислота и др.
Кофермент NAD+ не образует прочной постоянной связи с ферментом.
Он соединяется с АЦ фермента уже в ходе реакции и после её завершения уже в восстановленной форме отсоединяется.
-
FAD – зависимые дегидрогеназы (предшественник: витамин B2)
Кофермент FAD прочно связан с активным центром фермента как в окисленной, так и в восстановленной форме.
Включаясь в реакцию, он принимает 2H+ и 2 и
переходит в восстановленную форму.
Субстраты FAD-зависимых дегидрогеназ: сукцинат, ацил-KoA, глицерол-3-фосфат (-глицерофосфат).
Структурная организация цепи переноса электронов (цпэ).
В основе функционирования ЦПЭ лежит работа 5 основных компонентов, обеспечивающих перенос электронов от NADH и FADh3 на O2.
В их число входит 3 сложных ферментных комплексов, а также 2 низкомолекулярных переносчика.
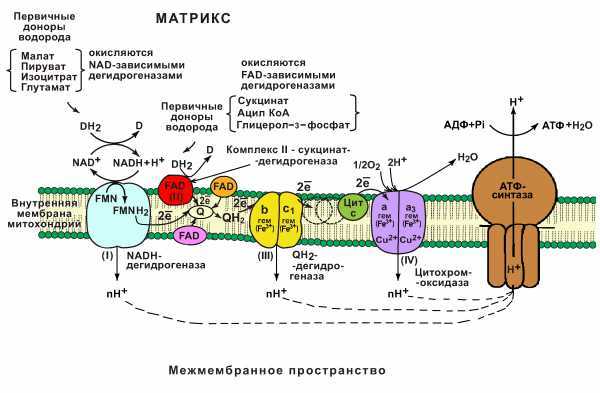
Компоненты цпэ:
-
NADH-дегидрогеназа (комплекс I);
-
сукцинатдегидрогеназа (комплекс II);
-
низкомолекулярный переносчик: убихинон (кофермент Q);
-
Убихинолдегидрогеназа (QН2-дегидрогеназа) (комплекс III);
-
низкомолекулярный переносчик (цитохром с);
-
цитохромоксидаза (комплекс IV)
Все компоненты ЦПЭ располагаются во внутренней мембране митохондрий в порядке возрастания окислительно-восстановительных потенциалов (редокс-потенциалов).
Самый низкий редокс-потенциал у NADH (-0,32В), а самый высокий редокс-потенциал у кислорода (+0,82В).
Это обеспечивает последовательное перемещение электронов от NADH (или FADh3) на O2, при котором происходит выделение энергии на каждом этапе ЦПЭ.
ЦПЭ обеспечивает взаимосвязь (сопряжение) процессов окисления и фосфорилирования АДФ.
Основная роль в переносе электронов принадлежит 3 важнейшим ферментным комплексам (I, III, IV).
Это сложные олигомерные белки, расположенные во внутренней мембране митохондрий.
Они являются интегральными белками.
|
Компонент ЦПЭ |
Кофермент |
Донор ē |
Акцептор ē |
|
|
Окисл. форма |
Восст. форма |
|||
|
NADH-дегидрогеназа (I ферментный комплекс) |
FMN |
FMN∙h3 |
NADH + H+ |
Убихинон (Q) |
|
Убихинон |
NADH-дегидрогеназа (I комплекс) |
Qh3-дегидрогеназа (цит. b и c1) (III комплекс) |
||
|
Окисл. форма: Q |
Восст. форма: Qh3 |
|||
|
Qh3-дегидрогеназа (убихинолдегидрогеназа) III ферментный комплекс, включает цитохромы b и c1 |
Гем (Fe3+) |
Гем (Fe2+) |
Qh3 |
Цитохром c |
|
Цитохром c |
Гем (Fe3+) |
Гем (Fe2+) |
Qh3-дегидрогеназа (III комплекс) |
Цитохромоксидаза (IV комплекс) |
|
Цитохромоксидаза IV ферментный комплекс, включает цитохромы a и a3 |
Гем (Fe3+), Cu2+ |
Гем (Fe2+) Cu+ |
Цитохром c |
O2 |
|
Сукцинатдегидрогеназа (II ферментный комплекс) |
FAD |
FAD∙h3 |
Сукцинат |
Убихинон (Q) |
Нарушение работы окислительного фосфорилирования
Ух, ну и системку мы разобрали. Согласитесь, что она очень сложная. Но при этом отлично справляется со своей работой — в норме. Но давайте немного отойдём от нормы. Время поиграть в доктора!
Представьте себе, что у пациента анемия — снизились эритроциты и/или гемоглобин. Меньше кислорода поступает в ткани и органы, а значит в митохондриях дела плохи. Электроны не могут попасть на свой финальный акцептор — кислород. Электроны застревают в комплексах дыхательной цепи. Они не создают градиент концентрации, поэтому нет синтеза АТФ. Пациент с анемией чувствует общую слабость именно из-за этого.
В организме истощился запас железа. Тут два патологических механизма. Дефицит железа приводит к снижению гемоглобина, а дальше вы уже знаете. Железо идёт не только на синтез гемоглобина, но и цитохромов — компонентов третьего и четвёртого комплекса дыхательной цепи. Если нет акцепторов электронов, то нет и окислительного фосфорилирования.
Дефицит меди. Медь входит в четвёртый комплекс дыхательной цепи, поэтому если её не будет, то комплекс перестанет работать.
Дефицит белка в рационе или нарушение его всасывания. Причин множество, но нас они не интересуют. Белок используется для синтеза собственных белков организма — ферментов и комплексов дыхательной цепи.
Гиповитаминозы. Коснёмся только двух, хотя почти каждый гиповитаминоз будет приводить к нарушениям. НАД+ и ФАД — это производные витаминов. НАД+ — никотиновой кислоты (витамин B3). ФАД — рибофлавина (витамин B2). Если словить два этих гиповитаминоза, то у нас просто не будет начальных акцепторов электронов. Так что электрончики не смогут запрыгнуть на дыхательную цепь с НАДH и ФАДH2.
Дефицит углеводов и липидов в рационе/нарушение их всасывания. Тут всё понятно, если нет субстратов, то откуда взять электроны?
Разобщители окислительного фосфорилирования
Мы договорились, что работа дыхательной цепи сопряжена с синтезом АТФ. Но есть молекулы, которые разобщают эти два процесса. Как? Разобщители — это жирорастворимые молекулы, которые могут проходить через внутреннюю мембрану митохондрий. Но если бы они только проходили! Эти молекулы присоединяют к себе протоны, а потом переносят их в матрикс митохондрии. Они мешают митохондрии создать градиент концентрации протонов, который так важен для синтеза АТФ.
В итоге получается так, что дыхательная цепь работает, но синтеза АТФ нет. Энергия транспорта электронов рассеивается в виде тепла. Я хочу, чтобы вы помнили о разобщителях, которые встречаются в нашем организме: жирных кислотах, неконъюгированном билирубине и трийодтиронине. Это не значит, что в норме они сильно влияют на работу окислительного фосфорилирования. Но при патологических состояниях…
У пациента с ожирением в крови повышается количество жирных кислот. Чем больше жирных кислот, тем больше шанс, что они попадут в митохондрии и повлияют на окислительное фосфорилирование.
Некоъюгированный билирубин повышается при гемолизе эритроцитов или нарушениях функции печени. Его накопление приводит к разобщению работы дыхательной цепи и синтеза АТФ. Представьте какую слабость чувствует пациент при гемолизе эритроцитов — в митохондрии не попадает кислород, да ещё непрямой билирубин вызывает разобщение окислительного фосфорилирования. Мрак.
Трийодтиронин повышается при тиреотоксикозе. Поэтому эти пациенты чувствуют жар и быстро теряют в весе — энергия переноса электронов рассеивается в виде тепла.
Мы и сами можем вызывать разобщение, назначив дикумарин — антикоагулянт непрямого действия. Его побочный эффект — это разобщение окислительного фосфорилирования.
Цепь переноса электронов митохондрий
При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
Кислород, поступающий в митохондрии из крови, связывается с атомом железа в геме цитохрома a3 в форме молекулы O2. Каждый из атомов кислорода присоединяет по два электрона и двапротона и превращается в молекулу воды.
Субстрат, образованный в цикле Кребса, подвергается дегидрированию (отщеплению водорода), в результате чего выделяется энергия, идущая на образование АТФ, а образовавшиеся в процессе электроны и протоны соединяются с кислородом и образуют воду. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.
Электроны передаются по цепи переносчиков, которые находятся в самой мембране. Переносчики, принимая электроны, окисляются, а отдавая следующему, переносчику восстанавливаются. В конце ЦПЭ, электроны переходят на кислород.
Протоны вытесняются за пределы мембраны митохондрии.
Вытеснение протонов происходит за счет энергии движения электронов внутри мембраны.
Протоны не могут самопроизвольно вернуться назад в мембрану, поэтому на внешней ее стороне накапливается положительный заряд.
Протоны в конце ЦПЭ, снова проходят внутрь через специальный белок- АТФ-синтетазу (5-й фактор) и участвуют в образовании воды. При прохождении протона через АТФ-синтетазу, выделяется энергия, которая идет на синтез АТФ.
В результате ОВР реакций переносчиков из АДФ и неорганического фосфата образуется АТФ.
Важно: Без присутствия АДФ окисления не происходит!
Субстраты NAD- и NADР-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле.
Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности (векторно). В этой последовательности их стандартные окислительно-восстановительные потенциалы становятся более положительными по мере приближения к кислороду
1.Субстрат сначала окисляется дегидрогеназой- NAD+, в результате кофермент NAD+ принимает протон и переходит в NADН.
Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа:
R-CHOH-R1 + NAD+ R-CO-R1 + NADH + H+.
NADРН не является непосредственным донором электронов в ЦПЭ, а используется почти
исключительно в восстановительных биосинтезах. Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей реакцию:
NADPH + NAD+ NADP+ + NADH.
Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN.
FAD служит акцептором электронов от многих субстратов в реакциях типа:
R-CH2-CH2-R1 + E (FAD) R-CH=CH-R1 + E (FADH2),
где Е — белковая часть фермента.
Большинство FAD-зависимых дегидрогеназ — растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукци-натдегидрогеназа, находящаяся во внутренней мембране митохондрий
Или субстрат окисляется дегидрогеназой- FAD+, в результате чего кофермент FAD принимает протон и становится FADН2.
Если окисляется сукцинат (янтарная кислота), то окисление идет сукцинатдегидрогеназой сразу по FAD+.
Далее NАDН через FMN и FES передает электроны Коферменту Q.
FAD передает Коферменту Q (убихинон) электроны через FES.
Важно: убихинон не является белком. Все остальные переносчики- белки!. FeS -железно-серные центры
FeS -железно-серные центры.
Предыдущая12345678910111213Следующая
Дата добавления: 2015-06-17; просмотров: 521;
Электронная транспортная цепь в окислительном фосфорилировании
Окислительное фосфорилирование является частью большей системы, клеточное дыхание, 4 шага клеточного дыхания можно увидеть на рисунке ниже. Первый шаг происходит за пределами митохондрий. Это включает в себя расщепление глюкозы, липидов или аминокислот. Этот шаг обозначен здесь только «Гликолиз». Помните, что есть и другие способы создания пируват и является посредником Цикл Кребса (цикл лимонной кислоты).
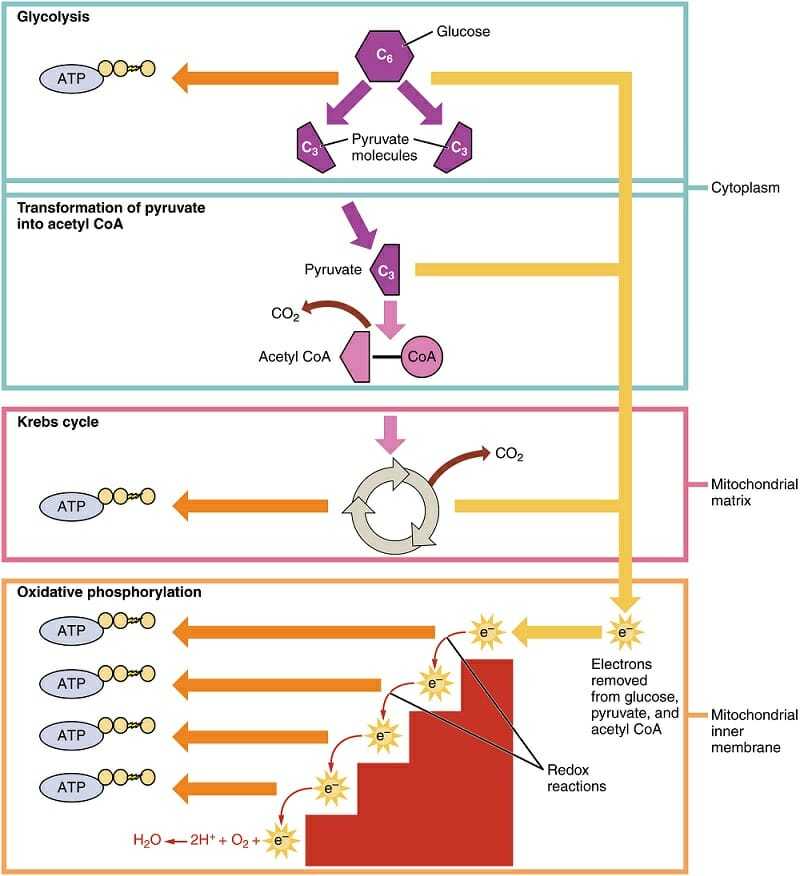
Остальные шаги происходят в митохондриях. Желтые линии на изображении представляют генерацию восстановленных коферментов или молекул, несущих электроны. В то время как некоторое количество АТФ генерируется во время гликолиза и цикла лимонной кислоты, большинство генерируется посредством окислительного фосфорилирования. Цепочка переноса электронов обозначена красной лестницей, обозначающей последовательное выделение энергии электронами. Оранжевые стрелки представляют АТФ-синтазу, которая создает АТФ через протонную движущую силу.