Функции
Основная функция импортина α — это его роль в ядерном импорте белков, содержащих последовательность NLS. Ядерный импорт через путь Importin α можно резюмировать с помощью следующего шестиступенчатого цикла:
- ARM-повторы свободного импортина α в цитоплазме связывают NLS ядер-мишеней, в то время как домен IBB одновременно присоединяется к белку импортина β, образуя тройной комплекс.
- Тройной комплекс связан в стыковочном узле на Ядерном поровом комплексе (NPC).
- Импортин β обеспечивает транспорт через ядерную оболочку
- Тройной комплекс диссоциирует за счет связывания импортина β с Ran-GTP.
- Свободный импортин α образует экспортный комплекс вместе с экспортином CAS и Ran-GTP и транспортируется из ядра.
- GTP гидролизуется, и экспортный комплекс диссоциирует, высвобождая свободный импортин α в цитоплазму.
Хотя этот процесс ядерного импорта действительно составляет большую часть функциональной роли белков импортина α, было показано, что некоторые другие важные функции опосредуются импортином α, включая гаметогенез, развитие, реакцию теплового шока, деградацию белка и инфекцию вирусных патогенов.
Было показано, что на гаметогенез большое влияние оказывают белки importin α множеством различных способов. Модели животных с использованием Caenorhabditis elegans, Drosophila melanogaster, и организмы млекопитающих более высокого порядка показали, что импортин α в изобилии присутствует в развивающихся гаметах, а мутации, которые вызывают функциональные изменения, могут привести к дефектам гамет и бесплодию. На моделях крупного рогатого скота было показано, что нокаут генов, кодирующих импортин α, предотвращает развитие оплодотворенных эмбрионов до стадии бластоцисты, таким образом предотвращая правильное эмбриональное развитие и приводя к гибели организма. Импортин α также участвует в развитии ответа на тепловой шок у Дрозофила эмбрионы. Кроме того, было показано, что импорт импортина α регулирует функцию протеаз, в том числе Taspase1, разрушителя лейкозных белков.
Взятые вместе, ясно, что белки импортина α абсолютно необходимы для правильного функционирования клеток, и мутации этих белков могут иметь множество катастрофических и потенциально летальных последствий.
Роль в вирусной патогенности
Исследования связывают импортин α с распознаванием и импортом некоторых вирусных нуклеопротеидов, в том числе вируса гриппа А. Грипп A является уникальным патогеном, так как он использует клеточный аппарат хозяина для выполнения генетической репликации и, следовательно, должен иметь механизм для проникновения в ядро для выполнения этой репликации. Было обнаружено, что вирус гриппа A получает доступ к этому аппарату хозяина через NLS-подобную последовательность по направлению к N-концу вирусного нуклеопротеина, который может распознаваться белками класса импортина α. Эта последовательность находится в первых 20 аминокислотных положениях вирусного нуклеопротеина и содержит кластеры основных аминокислот, очень похожие на те, которые обнаруживаются в последовательностях NLS хозяина и в домене IBB импортина α. Из-за такого структурного сходства вирусный нуклеопротеин гриппа A может импортироваться в ядро своего хозяина и брать на себя репликационный аппарат для пролиферации. Вирус иммунодефицита обезьян (SIV) также известен тем, что использует путь импортина α через NLS-подобную последовательность.
Структура
Импортин α представляет собой небольшой белок, состоящий из трех функционально различных доменов: домена IBB, домена ARM и домена связывания экспортина CAS.
N-концевая область белков состоит из импортин-β-связывающего домена или IBB. Эта область белка отвечает за взаимодействие с импортином β. Эта область была описана как серия из по меньшей мере 41 незаменимого аминокислотного остатка, в частности, положений 10-50 белка. Было показано, что удаление одной из этих аминокислот снижает активность ядерного импорта примерно на 50%. Более крупные делеции коррелируют с еще большей потерей функции тройного импортного комплекса, состоящего из импортина α, импортина β и целевого белка.
Большая часть белка импортина α состоит из серии из десяти тандемных броненосных повторов, или ARM, повторов. Централизованный домен ARM, состоящий из девяти повторов ARM, отвечает за регулирование связывания NLS для прямого взаимодействия с белками-мишенями ядра. Эти повторы ARM распознают основные остатки, характерные для последовательностей NLS. Последовательности NLS могут быть одночастными (один кластер основных аминокислот) или двудольными (два кластера основных аминокислот с линкерной последовательностью). Домен ARM содержит два сайта связывания внутри, позволяя одной молекуле импортина α взаимодействовать с двумя одночастными NLS-содержащими белками или одним двудольным белком NLS.
С-концевой домен импортина α, который включает десятый повтор ARM, отвечает за взаимодействие с экспортином CAS, другим белком кариоферина, который функционирует в рециркуляции импортина α из ядра обратно в цитоплазму клетки. Ассоциация этого экспортного CAS-связывающего домена является Ran-GTP-зависимой, и гидролиз GTP приводит к диссоциации импортина α от комплекса экспортина CAS-Ran.
Связывание NLS с доменом ARM и, таким образом, образование комплекса импорта регулируется доменом IBB импортина α. Домен IBB молекул импортина α содержит много основных аминокислотных остатков, подобных тем, которые обнаруживаются в последовательностях NLS. Это сходство в структуре приводит к способности домена IBB складываться внутрь и занимать сайты связывания NLS, когда нет молекулы импортина β, связанной с импортином α. Этот механизм автоингибирования предотвращает связывание импортином α белков, содержащих NLS, если уже не существует ассоциированного импортина β, гарантируя, что связывание не произойдет до того, как будет доступен весь необходимый механизм импорта. Из-за этого один только импортин α имеет довольно низкое сродство к последовательностям NLS, а более высокое сродство к NLS наблюдается, когда присутствуют как импортин α, так и импортин β.
Ссылки
- Альбертс Б. и Брей Д. (2006).Введение в клеточную биологию. Panamerican Medical Ed.
- Эйнард, А. Р., Валентич, М. А., и Ровасио, Р. А. (2008).Гистология и эмбриология человека: клеточные и молекулярные основы. Panamerican Medical Ed.
- Хетцер М. В. (2010). Ядерная оболочка.Перспективы Колд-Спринг-Харбор в биологии, 2(3), а000539.
- Мейер, И. (2008). Функциональная организация ядра растения. Springer.
- Росс, М. Х., и Павлина, В. (2006).Гистология. Липпинкотт Уильямс и Уилкинс.
- Велш, У., и Соботта, Дж. (2008).Гистология. Panamerican Medical Ed.
- Янг Б., Вудфорд П. и О’Дауд Г. (ред.). (2014).Уитер. Функциональная гистология: текст и атлас в цвете. Elsevier Health Sciences.
Реакции матричного синтеза
Это особая категория химических реакций, происходящих в клетках живых организмов. Во время этих реакций происходит синтез полимерных молекул по плану, заложенному в структуре других полимерных молекул-матриц. На одной матрице может быть синтезировано неограниченное количество молекул-копий. К этой категории реакций относятся репликация, транскрипция, трансляция и обратная транскрипция.
Ген
— участок молекулы ДНК, кодирующий первичную последовательность аминокислот в полипептиде или последовательность нуклеотидов в молекулах транспортных и рибосомных РНК. ДНК одной хромосомы может содержать несколько тысяч генов, которые располагаются в линейном порядке. Место гена в определенном участке хромосомы называется локусом
. Особенностями строения гена эукариот являются: 1) наличие достаточно большого количества регуляторных блоков, 2) мозаичность (чередование кодирующих участков с некодирующими). Экзоны
(Э) — участки гена, несущие информацию о строении полипептида. Интроны
(И) — участки гена, не несущие информацию о строении полипептида. Число экзонов и интронов различных генов разное; экзоны чередуются с интронами, общая длина последних может превышать длину экзонов в два и более раз. Перед первым экзоном и после последнего экзона находятся нуклеотидные последовательности, называемые соответственно лидерной (ЛП) и трейлерной последовательностью (ТП). Лидерная и трейлерная последовательности, экзоны и интроны образуют единицу транскрипции. Промотор
(П) — участок гена, к которому присоединяется фермент РНК-полимераза, представляет собой особое сочетание нуклеотидов. Перед единицей транскрипции, после нее, иногда в интронах находятся регуляторные элементы (РЭ), к которым относятся энхансеры
и сайленсеры
. Энхансеры ускоряют транскрипцию, сайленсеры тормозят ее.
Транскрипция — синтез РНК на матрице ДНК. Осуществляется ферментом РНК-полимеразой.
РНК-полимераза может присоединиться только к промотору, который находится на 3″-конце матричной цепи ДНК, и двигаться только от 3″- к 5″-концу этой матричной цепи ДНК. Синтез РНК происходит на одной из двух цепочек ДНК в соответствии с принципами комплементарности и антипараллельности. Строительным материалом и источником энергии для транскрипции являются рибонуклеозидтрифосфаты (АТФ, УТФ, ГТФ, ЦТФ).
В результате транскрипции образуется «незрелая» иРНК (про-иРНК), которая проходит стадию созревания или процессинга. Процессинг включает в себя: 1) КЭПирование 5″-конца, 2) полиаденилирование 3″-конца (присоединение нескольких десятков адениловых нуклеотидов), 3) сплайсинг (вырезание интронов и сшивание экзонов). В зрелой иРНК выделяют КЭП, транслируемую область (сшитые в одно целое экзоны), нетранслируемые области (НТО) и полиадениловый «хвост».
Транслируемая область начинается кодоном-инициатором, заканчивается кодонами-терминаторами. НТО содержат информацию, определяющую поведение РНК в клетке: срок «жизни», активность, локализацию.
Транскрипция и процессинг происходят в клеточном ядре. Зрелая иРНК приобретает определенную пространственную конформацию, окружается белками и в таком виде через ядерные поры транспортируется к рибосомам; иРНК эукариот, как правило, моноцистронны (кодируют только одну полипептидную цепь).
Что такое посттрансляционная модификация?
Посттрансляционные модификации относятся к химическим изменениям, которые претерпевают белки после того, как они были синтезированы в рибосомах. Транскрипция и трансляция приводят к образованию пропептидов, которые необходимо модифицировать, чтобы в конечном итоге достичь истинной функциональности белкового агента. Эти изменения могут происходить посредством ферментативных или неферментативных механизмов.
Одна из наиболее распространенных посттрансляционных модификаций — добавление функциональной группы. В следующем списке мы приводим вам несколько примеров этого биохимического события.
- Ацилирование: состоит из добавления ацильной группы. Соединение, которое предоставляет эту группу, известно как «ацилирующая группа». Например, аспирин получают в процессе ацилирования.
- Фосфорилирование: состоит из добавления фосфатной группы. Это посттрансляционная модификация, связанная с передачей энергии на клеточном уровне.
- Метилирование: добавить метильную группу. Это эпигенетический процесс, поскольку метилирование ДНК предотвращает транскрипцию определенных генов-мишеней.
- Гидроксилирование: добавление гидроксильной группы (ОН). Например, добавление гидроксильной группы к пролину является важным этапом образования коллагена у живых существ.
- Нитрование: добавление нитрогруппы.
Существует еще много механизмов добавления функциональных групп, поскольку также было зарегистрировано нитрозилирование, гликозилирование или пренилирование. От создания лекарств до синтеза биологических тканей — все эти процессы так или иначе необходимы для выживания нашего вида.
Как мы уже говорили, геном человека содержит 25 000 генов, но протеом нашего вида (общее количество белков, экспрессируемых в клетке) составляет около миллиона белковых единиц. Помимо сплайсинга информационной РНК, посттрансляционные модификации составляют основу разнообразия белков у людей, поскольку они способны добавлять небольшие молекулы посредством ковалентных связей, которые полностью изменяют функциональность полипептида.
Помимо добавления определенных групп, существуют также модификации, которые связывают белки вместе. Примером этого является сумоилирование, при котором к белкам-мишеням добавляется миниатюрный белок (небольшой модификатор, связанный с убиквитином). Распад белка и ядерная локализация — некоторые из эффектов этого процесса.
Другим важным дополнительным посттрансляционным механизмом является убиквитинирование, которое, как следует из названия, добавляет убиквитин к белку-мишени. Одна из многих функций этого процесса — управлять рециклингом белка, поскольку убиквитин связывается с полипептидами, которые необходимо разрушить.
На сегодняшний день обнаружено около 200 различных посттрансляционных модификаций, которые влияют на многие аспекты функциональности клеток, включая такие механизмы, как метаболизм, трансдукция сигнала и стабильность самого белка. Более 60% участков белка, возникающих в результате посттрансляционных модификаций, связаны с областью белка, которая непосредственно взаимодействует с другими молекулами или, что то же самое, с его активным центром.
Общие характеристики
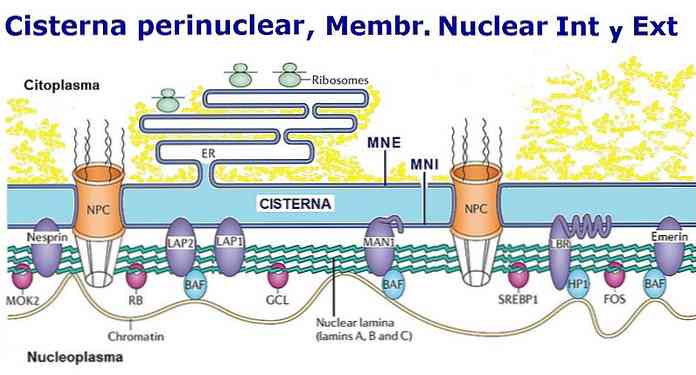
Ядерная мембрана является одной из наиболее ярких отличительных черт эукариотических клеток. Это высокоорганизованная двойная биологическая мембрана, которая заключает в себе ядерный генетический материал клетки — нуклеоплазму..
Внутри мы находим хроматин, вещество, образованное ДНК, связанной с различными белками, в основном гистонами, которые обеспечивают эффективную упаковку. Он делится на эухроматин и гетерохроматин.
Изображения, полученные с помощью электронной микроскопии, показывают, что наружная мембрана образует континуум с эндоплазматическим ретикулумом, поэтому на ней также закреплены рибосомы. Аналогично, перинуклеарное пространство образует континуум с просветом эндоплазматического ретикулума.
Якорь на стороне нуклеоплазмы во внутренней мембране, мы находим структуру в виде листа, образованного белковыми нитями под названием «ядерная пластинка».
Мембрана ядра перфорирована рядом пор, которые позволяют регулировать движение веществ между ядерным и цитоплазматическим поведением. Например, считается, что у млекопитающих насчитывается в среднем около 3000 или 4000 пор..
Есть очень компактные массы хроматинов, которые прилипают к внутренней мембране оболочки, за исключением областей, где существуют поры.
Посттрансляционная модификация белков
К основным реакциям процессинга относятся:
1. Удаление с N-конца метионина или даже нескольких аминокислот специфичными аминопептидазами.
2. Образование дисульфидных мостиков между остатками цистеина.
3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином или протеолитическими ферментами ЖКТ.
4. Присоединение химической группы к аминокислотным остаткам белковой цепи:
- фосфорной кислоты – например, фосфорилирование по аминокислотам Серину, Треонину, Тирозину используется при регуляции активности ферментов или для связывания ионов кальция,
- карбоксильной группы – например, при участии витамина К происходит в составе протромбина, проконвертина, фактора Стюарта, Кристмаса, что позволяет связывать ионы кальция при инициации свертывания крови,
- метильной группы – например, метилирование аргинина и лизина в составе используется для регуляции активности генома,
- гидроксильной группы – например, присоединение ОН-группы к лизину и пролину с образованием гидроксипролина и гидроксилизина необходимо для созревания молекул при участии витамина С,
- йода – например, в тиреоглобулине необходимо для образования предшественников тиреоидных гормонов йодтиронинов,
5. Включение простетической группы:
- углеводных остатков – например, гликирование требуется при синтезе гликопротеинов.
- гема – например, при синтезе гемоглобина, миоглобина, цитохромов, каталазы,
- витаминных коферментов – биотина, ФАД, пиридоксальфосфата и т.п.
6. Объединение протомеров в единый олигомерный белок, например, гемоглобин, коллаген, лактатдегидрогеназа, креатинкиназа.
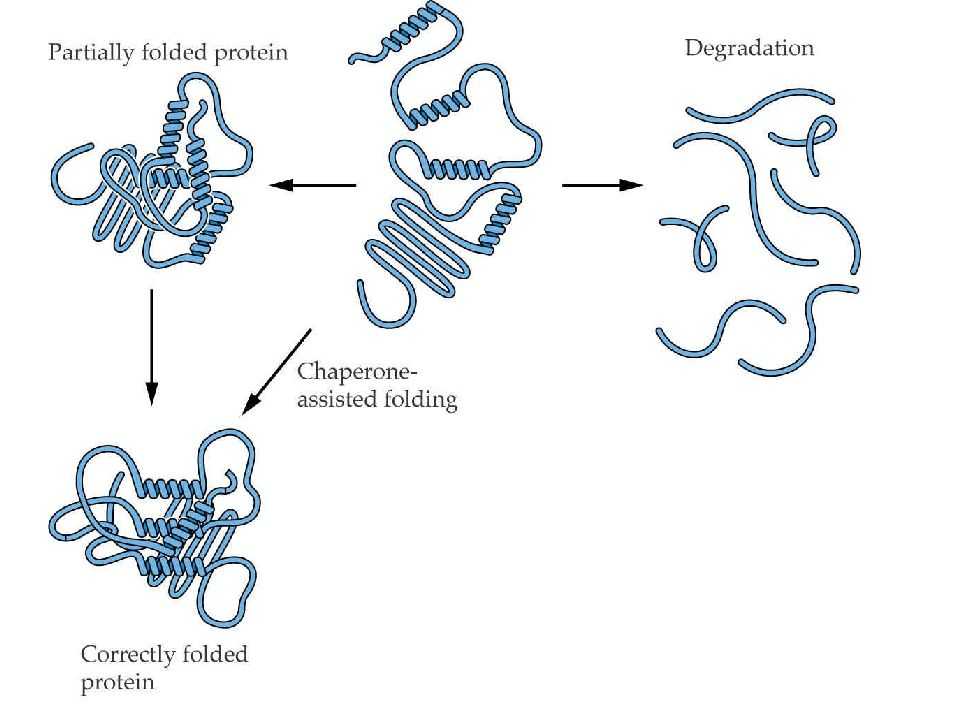
Фолдинг белков
Фолдинг – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру. Для обеспечения фолдинга используется группа вспомогательных белков под названием шапероны (chaperon, франц. – спутник, нянька). Они предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и «убирают» их внутрь молекулы, правильно располагают белковые домены.
В целом шапероны способствуют переходу структуры белков от первичного уровня до третичного и четвертичного.
При нарушении функции шаперонов и в отсутствии фолдинга в клетке формируются белковые отложения – развивается амилоидоз. Насчитывают около 15 вариантов амилоидоза.
состав
Ядерная оболочка образована двумя липидными бислоями, образованными типичными фосфолипидами, с несколькими интегральными белками. Пространство между двумя мембранами называется внутримембранозным или перинуклеарным пространством, которое продолжается светом эндоплазматического ретикулума..
На внутренней стороне внутренней ядерной мембраны имеется характерный слой, образованный промежуточными филаментами, называемыми ядерными пластинками, прикрепленными к белкам внутренней мембраны с помощью гетерохромарина Н.
Ядерная оболочка имеет множество ядерных пор, которые содержат комплексы ядерных пор. Это цилиндрические структуры, состоящие из 30 нуклеопоринов (они будут подробно описаны ниже). С центральным диаметром около 125 нм.
Белки ядерной мембраны
Несмотря на преемственность с сетью, как внешняя, так и внутренняя мембрана представляют группу специфических белков, которые не обнаружены в эндоплазматической сети. Наиболее выдающимися являются следующие:
нуклеопорины
Среди этих специфических белков ядерной мембраны у нас есть нуклеопорины (также известные в литературе как Nups). Они образуют структуру, называемую комплексом ядерных пор, который состоит из ряда водных каналов, которые обеспечивают двунаправленный обмен белков, РНК и других молекул..
Другими словами, нуклеопорины функционируют как своего рода молекулярные «двери», которые очень избирательно опосредуют прохождение разных молекул..
Гидрофобное внутреннее пространство канала исключает определенные макромолекулы в зависимости от размера макромолекулы и уровня ее полярности. Небольшие молекулы, приблизительно менее 40 кДа или гидрофобные, могут пассивно диффундировать через комплекс пор..
Напротив, полярные молекулы, которые больше, нуждаются в ядерном транспортере, чтобы войти в ядро.
Транспортировка через комплекс ядерных пор
Транспортировка через эти комплексы достаточно эффективна. Только 100 молекул гистонов в минуту могут проходить через одну пору.
Белок, который должен быть перенесен в ядро, должен связываться с альфа-импортином. Бета-импортин связывает этот комплекс с внешним кольцом. Таким образом, альфа-импортин, связанный с белком, способен пересекать поровый комплекс. Наконец, бета-импортин диссоциирует от системы в цитоплазме, а альфа-импортин диссоциирует уже внутри ядра..
Белки внутренней мембраны
Другая серия белков специфична для внутренней мембраны. Однако большая часть этой группы из почти 60 интегральных мембранных белков не была охарактеризована, хотя было установлено, что они взаимодействуют с пластинкой и хроматином..
Каждый раз появляется все больше доказательств того, что поддерживает различные и важные функции для внутренней ядерной мембраны. По-видимому, он играет роль в организации хроматина, в экспрессии генов и в метаболизме генетического материала..
Фактически, было обнаружено, что местоположение и ошибочная функция белков, которые составляют внутреннюю мембрану, связаны с большим количеством заболеваний у людей..
Белки наружной мембраны
Третий класс специфических белков ядерной мембраны находится во внешней части указанной структуры. Это очень гетерогенная группа интегральных мембранных белков, которые имеют общий домен под названием KASH.
Белки, обнаруженные во внешней области, образуют своего рода «мост» с белками внутренней ядерной мембраны..
Эти физические связи между цитоскелетом и хроматином, по-видимому, имеют отношение к событиям транскрипции, репликации и механизмам репарации ДНК..
Белки клинка
Последняя группа белков ядерной мембраны образована белками листа, каркас, образованный промежуточными нитями, которые состоят из листов типа А и В. Толщина листа составляет от 30 до 100 нанометров..
Пластинка является важной структурой, которая обеспечивает стабильность ядра, особенно в тканях, которые находятся в постоянном воздействии механических сил, таких как мышечная ткань.. Подобно внутренним белкам ядерной мембраны, мутации в пластине тесно связаны с большим количеством очень разнообразных заболеваний человека.
Подобно внутренним белкам ядерной мембраны, мутации в пластине тесно связаны с большим количеством очень разнообразных заболеваний человека..
Кроме того, обнаруживается все больше и больше свидетельств, касающихся ядерной пластинки при старении
Все это подчеркивает важность белков ядерной мембраны в общем функционировании клетки
Литература
- Crick F.H.C. (1958). On Protein Synthesis. Symp. Soc. Exp. Biol. XII, 139–163;
- Кнорре Д.Г., Кудряшова Н.В., Годовикова Т.С. (2009). Химические и функциональные аспекты посттрансляционной модификации белков. Acta Naturae № 3 (2009), 32–56;
- биомолекула: «В полку генов убыло»;
- Benayoun B.A., Veitia R.A. (2009). A post-translational modification code for transcription factors: sorting through a sea of signals. Trends Cell Biol. 19, 189–197;
- биомолекула: «Бессмертные клетки Генриетты Лакс»;
- биомолекула: «Как избавиться от РНК за несколько минут»;
- биомолекула: «Вездесущий убиквитин»;
- Meulmeester E., Kunze M., Hsiao H.H., Urlaub H., Melchior F. (2008). Mechanism and consequences for paralog-specific sumoylation of ubiquitin-specific protease 25. Mol. Cell 30, 610–619;
- Zhang S.D., Goeres J., Zhang H., Yen T.J., Porter A.C., Matunis M.J. (2008). SUMO-2/3 modification and binding regulate the association of CENP-E with kinetochores and progression through mitosis. Mol. Cell 29, 729–741;
- Ulrich H.D. (2008). The Fast-Growing Business of SUMO Chains. Mol. Cell. 32, 301–305;
- Matunis M.J., Coutavas E., Blobel G. (1996). A Novel Ubiquitin-like Modification Modulates the Partitioning of the Ran-GTPase-activating Protein RanGAP1 between the Cytosol and the Nuclear Pore Complex. J. Cell Biol. 135, 1457–1470;
- Fan J., Ren H., Fei E., Jia N., Ying Z., Jiang P. et al. (2008). Sumoylation is critical for DJ-1 to repress p53 transcriptional activity. FEBS Lett. 582, 1151–1156;
- Yang S.H., Sharrocks A.D. (2004). SUMO promotes HDAC-mediated transcriptional repression. Mol. Cell 13, 611–617;
- Stancovic-Valentin N., Deltour S., Seeler J., Pinte S., Vergoten G., Guerardel C., Dejean A., Leprince D. (2007). An acethylation/deacethylation-SUMOylation switch through a phylogenetically conserved ψKXEP motif in the tumor supressor HIC1 regulates transcriptional repression activity. Mol. Cell Biol. 27, 2661–2675;
- Uchimura Y., Ichimura T., Uwada J., Tachibana T., Sugahara S., Nakao M. et al. (2006). Involvement of SUMO modification in MBD1- and MCAF1-mediated Heterochromatin Formation. J. Biol. Chem. 281, 23180–23190.
Этапы биосинтеза белка
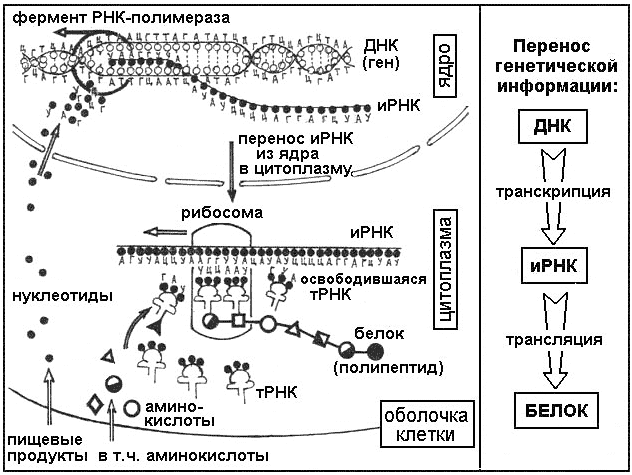
Транскрипция
Процесс протекает в ядре. ДНК образована большим количеством нуклеотидов. Это единица макромолекулы. Она включает в свой состав 3 компонента:
-
углевод, представленный пентозой – дезоксирибозой;
-
минеральную кислоту – фосфорную;
-
органическое соединение, относящееся к классу азотистых оснований.
В составе ДНК могут содержаться 4 разных основания. Они имеют краткое обозначение, по первой букве названия:
-
А – аденин;
-
Г – гуанин;
-
Ц – цитозин;
-
Т – тимин.
Именно этими основаниями и отличаются нуклеотиды. Чередование 3 нуклеотидов образует триплет. Один триплет соответствует одной аминокислоте. Вопрос соответствия аминокислот триплетам изучен и указан в таблице генетического кода.
Последовательность триплетов в молекуле дезоксирибонуклеиновой кислоты, отвечающей за синтез одного белка, называют геном. Между разными генами расположены триплеты, которые не соответствуют аминокислотам. Их называют стоп-кодонами. Они служат сигналом начала и окончания гена.
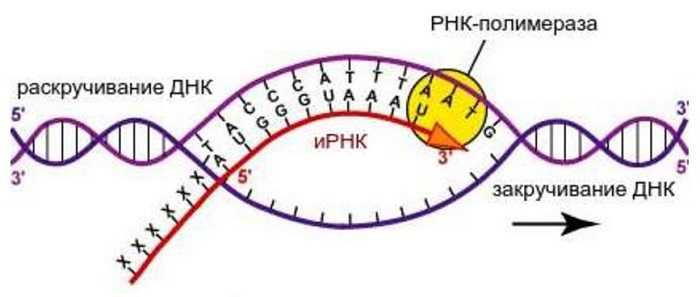
Для осуществления транскрипции, участок макромолекулы ДНК раскручивается. Он выполняет роль матрицы. На нём выстраивается и-РНК. Осуществляется синтез по принципу соответствия. Еще его называют комплементарностью.
РНК также имеет нуклеотидное строение. Вместо дезоксирибозы присутствует углевод рибоза. Содержится остаток ортофосфорной кислоты. Третьим компонентом является азотистое основание. Три основания одинаковые – А, Г, Ц в ДНК и РНК. Четвертое основание рибонуклеиновой кислоты – урацил (У).
Комплементарными основаниями являются: Т – А, А – У, Г – Ц, Ц – Г. В парах комплементарных оснований первое соответствует ДНК, второе – РНК. Таким образом, на макромолекуле ДНК по принципу соответствия выстраивается и-РНК. В дальнейшем цепь РНК транспортируется через ядерную мембрану к месту синтеза белка.
Трансляция
Процесс идет на органоидах – рибосомах. Они нанизываются на цепь и-РНК, передвигаются по ней не плавно, а прерывисто. Располагаются таким образом, что внутри рибосомы находится полностью 1-2 триплета. На одну РНК может одновременно нанизываться большое количество рибосом.
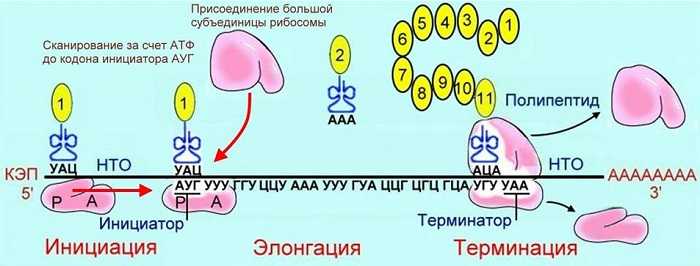
В процессе принимают участие т-РНК. Они имеют пространственную структуру, принимают форму трилистника. Верхняя часть листа, то есть молекулы, содержит антикодон. Это триплет, распознающий кодон (один триплет) и-РНК.
Каждая т-РНК транспортирует к рибосоме строго определенную аминокислоту. Если триплет-антикодон т-РНК распознает триплет-кодон и-РНК, тогда аминокислота встраивается в макромолекулу белка. Следующая т-РНК подтаскивает другую аминокислоту, снова идет процесс распознавания. В данном случае также идет матричный процесс сборки белка. РНК служит матрицей для синтеза белка.
Как только белковая молекула синтезирована, она освобождается от рибосомы. Правильное чередование аминокислот в макромолекуле образует первичную структуру белковой молекулы. Она является определяющей, поэтому так важен матричный синтез белков. Другие структуры белковые макромолекулы приобретают самопроизвольно.
Рекомендации
- (in) Миллер Дж. Д., Вильгельм Х, Гираш Л., Р. Гилмор, Уолтер П. (1993) Связывание и гидролиз GTP с помощью частицы распознавания сигнала Во время инициации транслокации белка, Nature , vol. 366 : 351-354 с.
- (ru) Мотес В., Генрих А., Граф Р., Нильссон И., фон Хейне Г., Дж. Бруннер, Рапопорт Т.А. (1997) Молекулярный механизм интеграции мембранных белков в эндоплазматический ретикулум, Cell , vol. 89 (4) : 523-533 с.
- (ru) Do H, Falcone D, Lin J, Andrews DW, Johnson AE. (1996) Котрансляционная интеграция мембранных белков в фосфолипидный бислой представляет собой многоступенчатый процесс, Cell , vol. 85 : 369-378 с.
- (en) Генрих С.У., Мотес В., Дж. Бруннер, Рапопорт Т.А. (2000) Комплекс Sec61p опосредует интеграцию мембранного белка, позволяя липидному разделению трансмембранного домена, Cell , vol. 102 : 233-244 с.
- Джонсон А.Е., Хей Н.Г. (2000) Транслокон и ретротранслокация ER: переключение на обратный ручной или автоматический?, Cell , vol. 102 : 709-712 с.
- (in) Годер, В., Списс, М. (2001) Топогенез мембранных белков: детерминанты и динамика, FEBS Lett. , т. 504 : 87-93 с.
- (in) von Heijne, G. (1986) Чистая нагрузка дисбаланса NC Может иметь значение для функции сигнальной последовательности у бактерий, J. Mol. Биол. , т. 192 : 287-290 с.
- (in) фон Хейне, Г. (1992) Прогнозирование структуры мембранного белка. Анализ гидрофобности и правило положительного внутреннего, J. Mol. Биол. , т. 225 : 487-494 с.
- (in) Валлин, Э., фон Хейне, Г. (1998) Полногеномный анализ интегральных мембранных белков эубактериальных, архейских и эукариотических организмов, Protein Sci. , т. 7 : 1029-1038 с.
- (ru) Хартманн, Э., Рапопорт Т.А., Лодиш Х.Ф. (1989) Предсказание ориентации эукариотических трансмембранных белков, Proc. Natl. Акад. Sci. США , т. 86 : 5786-5790 стр.
- (in) Парков Г.Д., Ягненка Р.А. (1993) Роль NH2-концевых положительно заряженных остатков в установлении топологии мембранных белков, J. Biol. Chem. , т. 268 : 19101-19109 с.
- (in) Rutz, C., W. Rosenthal, Schulein, R. (1999) Один отрицательно заряженный остаток влияет на ориентацию мембранного белка во внутренней мембране Escherichia coli, только когда он расположен рядом с трансмембранным доменом. , J. Biol. Chem. , т. 274 : 33757-33763.
- ↑ и (en) van Klompenburg W, Nilsson I, von Heijne G, de Kruijff B. (1998) Анионные фосфолипиды являются детерминантами топологии мембранных белков, EMBO J. , vol. 16 : 4261-4266.
- (in) Goder, V., Junne, T., Spiess, M. (2003) SEC61p способствует ориентации сигнальной последовательности в соответствии с правилом положительного внутреннего, Mol. Биол. Клетка. , т. 15 : 1470-1478 с.
- ↑ и (ru) Годер В., Списс М. (2003) Молекулярный механизм ориентации сигнальной последовательности в эндоплазматическом ретикулуме, EMBO J. , vol. 22 : 3645-3653 с.
- (in) Rosch, K., Naeher, D. Laird, V., Goder, V., Spiess, M. (2000) Вклад топогенных незаряженных аминокислот — сигнал ориентации последовательности в эндоплазматическом ретикулуме, J. Biol. Chem. , т. 275 : 14916-14922 стр.
- (in) Harley, CA, Holt, JA, Turner, R., Tipper, DJ (1998) Направление вставки трансмембранного белка в дрожжах зависит от разницы нагрузки между трансмембранными сегментами. Их общая гидрофобность и ее распределение, J. Biol. Chem. , т. 273 : 24963-24971 стр.
- (in) Denzer, AJ, Nabholz EC, Mr Spiess (1995) Трансмембранная ориентация сигнальных якорных белков зависит от состояния сворачивания, но не от размера N-концевого домена, EMBO J. , ‘ flight. 14 : 6311-6317 стр.