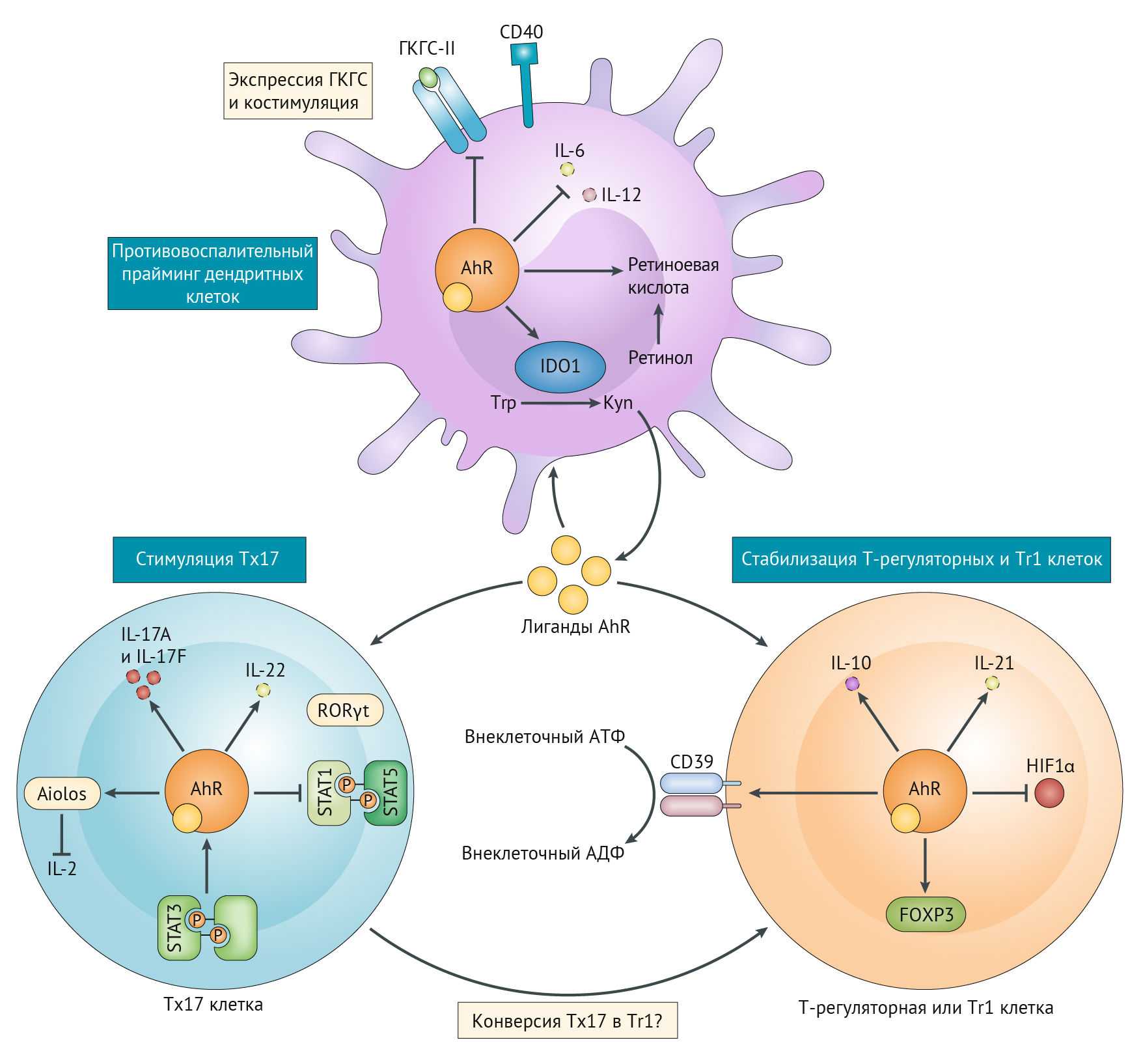
Почему их назначают
По словам терапевта GMS Clinic Натальи Поленовой, весь предыдущий год врачи большинства специальностей занимались лечением одной «главной» болезни — новой респираторной вирусной инфекции, COVID-19. Это заболевание принципиально отличается от своих инфекционных предшественников риском развития быстро прогрессирующих осложнений, в том числе, опасных для жизни. И тесты на воспаление, особенно на С-реактивный белок (СРБ) играют в его диагностике очень важную роль.
«Одну из главных опасностей для жизни при Covid представляет так называемый цитокиновый шторм, — рассказывает Наталья Поленова. — Предвестниками этого шторма можно считать стойкую (в течение 5 дней) лихорадку более 38°С, снижение уровня лейкоцитов менее 3 тыс/мл, повышение уровня СРБ более 30 мг/дл, ферритина более 500 нг/мл, интерлейкина-6 более 40 пк/мл. Последний является биологически активным веществом, цитокином, непосредственно ответственным за продукцию белков острой фазы: СРБ, прокальцитонина и ферритина».

Если пациенту с коронавирусной болезнью не становится легче, а лихорадка сохраняется в течение нескольких дней, оценка уровня воспалительных маркеров в крови позволяет заподозрить риск тяжелого течения болезни. В результате врач вовремя понимает, когда нужно госпитализировать пациента, или принимает решение усилить терапию — например, назначить ему глюкокортикостероиды, антибактериальную терапию и другие лечебные мероприятия.
«Оценка параметров системного воспаления позволяет определить тактику лечения, не допустить развития тяжелых осложнений, а также оценить эффективность проводимой терапии при повторном тестировании», — заключает Наталья Поленова.
Что может показать тест на CRP?
С-реактивный белок проявляется как защитная реакция организма. Его функция – в участии в иммунном ответе, заключающемся в инактивации воспалительного фактора и стимуляции функции иммунных клеток.
Количественное тестирование CRP имеет меньшую диагностическую ценность в случае хронических воспалительных заболеваний, например, ревматических заболеваний, поскольку значение CRP может варьироваться от 10 до 1000 мг / л. Однако диагностически важным является тот факт, что уровень СРБ связан со степенью и активностью воспалительного процесса. Мониторинг изменений концентрации С-реактивного белка – уменьшение или увеличение – информирует о стадии воспаления, его угасании или неудачи терапии.
Перед тем как пройти тест на СРБ, рекомендуется заранее проконсультироваться с врачом и обсудить любые медицинские условия, могущие повлиять на его результаты.
Важно, чтобы на консультации врача были учтены факторы риска, связанные с образом жизни, другие медицинские состояния и семейный анамнез. В случае риска сердечно-сосудистых заболеваний могут быть назначены: эхокардиограмма, компьютерная томография коронарных артерий, стресс-тест, катетеризация сердца или электрокардиограмма
Виды передачи наследственных форм рака
Выявлено 8 наследственных синдромов, проявляющиеся семейной предрасположенностью к раку по женской линии.
К наиболее частым формам наследственных опухолевых синдромов относятся рак молочной железы, эндометрия и яичников. На долю рака молочных желез приходится до 5% заболеваемости, на рак яичников – 15%, на рак эндометрия – 3%.
Далее по распространенности следуют злокачественные опухоли желудочно-кишечного тракта, легких, толстого кишечника.
Прохождение генетического тестирования рекомендуется лицам, у кого имеется высокий риск носительства врожденной генетической мутации, определяющий вероятность развития злокачественных новообразований.
В настоящее время невозможно определить у кого из членов семьи с повышенным риском развития злокачественных опухолей разовьется рак, а у кого нет. Поэтому в группу риска включаются все близкие кровные родственники.
Группы риска:
- У кровных родственников рак диагностировали в возрасте до 50 лет.
- Локализация опухолей совпадает у разных членов семьи.
- У одного из представителей рода был выявлен рецидивирующий злокачественный процесс.
- Присутствие хотя бы одного из факторов в семейном анамнезе человека является основанием для проведения молекулярно-генетического анализа.
Профилактика семейного рака
Профилактика наследственных форм рака включает раннюю диагностику, своевременное устранение опасных предраковых состояний, повышение устойчивости организма, следование здоровому образу жизни: сбалансированное питание, отказ от вредных привычек, занятия спортом.
Для людей с предрасположенностью к различным видам рака разработаны стандарты первичного обследования для ранней диагностики. Для каждого пациента с высоким риском по развитию онкозаболеваний составляется индивидуальная программа динамического наблюдения.
За рубежом при некоторых разновидностях наследственного рака, как к эффективному способу избежать заболевания, прибегают к превентивным мерам – удалению здорового органа. Ярким примером стала голливудская звезда Анджелина Джоли, которой удалили обе молочные железы и яичники, так как, по прогнозам, риск заболеть раком у нее составлял 87%. Такие радикальные меры профилактики болезни выполняются лишь при высоком уровне риска, который подтверждается генетическими исследованиями. У нас в стране отсутствует правовая база, разрешающая такие операции.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Большинство онкологов в России НЕ используют молекулярно-генетические тесты. Потому что не имеют достаточного опыта работы с ними и специфических знаний. Не получится просто открыть отчет и «списать» оттуда лечение
Нужно принимать во внимание множество факторов, понимать, как все эти многочисленные мутации влияют друг на друга, на рост опухоли, на потенциальную индивидуальную переносимость пациентом препарата и т. п
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Необходимо продумывать комбинации из таргетных препаратов, уметь сочетать их химиотерапевтическими лекарствами, предусматривать возможные побочные эффекты таких «коктейлей». Это довольно сложная задача — и врач должен быть очень мотивирован постоянно учиться.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Так что, хоть нам в международной клинике Медика24 и приходится все время держать мозги в тонусе, разбираться в новых и новых исследованиях генетических мутаций — результаты определенно того стоят.
Будьте здоровы.
Материал подготовлен заместителем главного врача по лечебной работе международной клиники Медика24, кандидатом медицинских наук Сергеевым Петром Сергеевичем.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Гены-супрессоры опухолей сдерживают размножение клеток, восстанавливают поврежденную ДНК, вызывают апоптоз — запрограммированную клеточную смерть. Примеры таких генов: BRCA1, BRCA2, TP53 (кодирует белок p53 — «страж генома», который запускает апоптоз в поврежденных клетках).
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).
Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Кому это нужно?
Тем, у кого развилась резистентность опухоли или непереносимость ко всем препаратам из стандартного протокола лечения. Ситуация, когда «все перепробовали — не помогло».
В принципе, нынешние стандарты лечения, особенно европейские и американские протоколы (NCCN), которые мы применяем в международной клинике Медика24, обладают хорошим терапевтическим потенциалом — не зря они считаются «золотым стандартом» лечения в онкологии.
По этим стандартам, сначала назначают препараты 1-й линии терапии — те, что статистически лучше всего помогают при данном диагнозе. Смотрят динамику. Если опухоль не реагирует на лечение или — что хуже — прогрессирует — переходят к препаратам 2-й линии — тем, что по результатам исследований давали чуть менее успешное лечение. Если эти препараты тоже перестают помогать — идем к 3-й линии, и т. д. Многим пациентам длины этой «цепи» хватает до конца жизни.
Но регулярно, к сожалению, врачи оказываются в тупике: в ситуации, когда все линии «протокольной» терапии закончились, а пациент жив и прогрессирует. Коварство раковых опухолей — в их изменчивости. Они очень быстро мутируют дальше, и приспосабливаются к любым условиям, к любым препаратам. Для пациента это означает развитие резистентности — все препараты, прописанные в протоколах лечения, перестали действовать на его опухоль.
Нужно продолжать лечение — а у врача закончились «инструменты», предписанные официальными стандартами лечения. Есть другие препараты, есть право назначить их off-label, вне стандартных линий терапии. Но как узнать, какое лекарство выбрать?
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Влияние препаратов на концентрацию СРБ
Прием ацетилсалициловой кислоты или аспирина даже в высоких дозах не влияет на количественный уровень СРБ. Это несколько удивительно, поскольку аспирин известен своими противовоспалительными свойствами.
Пациенты с высоким уровнем холестерина, получающие статины, менее подвержены сердечному приступу, потому что статины не только снижают уровень липидов, но и обладают противовоспалительными свойствами
Это очень важно, потому что повышенный уровень СРБ и низкий уровень холестерина более опасны, чем повышенный уровень холестерина и низкий уровень СРБ. Уровень СРБ также снижается препаратами из группы фибратов и бета-адреноблокаторов, но менее эффективно, чем статинами
Стадии развития рака толстой кишки
Существуют четыре типа генов, мутации в которых могут приводить к развитию рака:
-
Протоонкогены
Это нормальные гены клеток, участвующие в регуляции процессов их роста и дифференцировки. Они нужны для бурного развития организма во внутриутробном периоде, и во взрослом состоянии не активны. -
Гены-супрессоры опухолей
Необходимы для подавления размножения клеток. -
Гены, участвующие в запрограммированной гибели клеток путем апоптоза
Основная биологическая роль апоптоза в норме — установление нужного равновесия между процессами размножения и гибели клеток. - Гены, отвечающие за процессы репарации (исправления) ДНК
Сложность в том, что каждая опухоль уникальна по своему набору «мишеней»-мутаций
Так же, как уникален код ДНК у каждого человека — неповторимы и опухоли. Ведь они «рождены» из собственных клеток организма. Не существует опухолей с одинаковыми генно-молекулярными свойствами. Поэтому создать универсальную «таблетку» от рака — принципиально невозможно. Рак — слишком индивидуальное заболевание.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
Чтобы эффективно использовать таргетную терапию, этого мало. Врач должен знать, какие мутации есть в опухолевых клетках у конкретного пациента, присутствуют ли в них биомаркеры-«мишени» для того или иного препарата. Персонализированная медицина, как она есть.
Для этого мы и применяем молекулярно-генетические исследования. Чтобы найти «мишени», по которым нужно прицельно бить таргетными и иммунотреапевтическими препаратами — нужно определить, из каких генов собрана ДНК опухоли, и какие гены в ней — «сломаны». В результате:
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Там из образца выделяют опухолевую ДНК и секвенируют ее. То есть — «прочитывают» последовательность «букв»-нуклеотидов. А затем сравнивают с диагностической панелью, отобранной из базы библиотек — уже расшифрованных геномов тысяч других людей. Панель подбирают под каждого пациента — с учетом анамнеза и клинических данных. Все это, разумеется, делают автоматические секвенаторы и компьютер.
И если 20 лет назад «чтение» генома занимало месяцы, требовало медленной и сложной расшифровки, то сегодня в лаборатории, с которой мы сотрудничаем, делают анализ за несколько рабочих дней.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадъювантной терапией.
Другие методы лечения:
- Химиопрепараты обладают разными механизмами действия, но все они сводятся к повреждению и уничтожению быстро размножающихся клеток. В первую очередь, конечно же, раковых, но страдают и некоторые нормальные ткани, из-за этого могут возникать серьезные побочные эффекты.
- Лучевая терапия действует аналогично химиопрепаратам, поражая быстро размножающиеся клетки.
- Таргетные препараты воздействуют на молекулы, которые помогают раковым клеткам быстро размножаться, выживать и защищаться от иммунной системы. Например, существуют блокаторы HER2, о котором речь шла выше, ингибиторы VEGF — вещества, с помощью которого опухолевые клетки «выращивают» для себя кровеносные сосуды.
- Иммунотерапия помогает иммунной системе обнаруживать и уничтожать опухолевые клетки.
В «Евроонко» применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
C-реактивный белок и СОЭ
СОЭ или реакция Бирнацкого – измерение скорости оседания эритроцитов в пробирке с кровью. Она выражается в миллиметрах в час. СОЭ является косвенным показателем воспалительной реакции. Однако, тест СОЭ менее специфичен, чем СРБ.
Помимо воспаления, на повышение СОЭ также влияют:
- Ожирение. Жировая ткань – источник интерлейкина 6. Это один из белков, участвующих в образовании воспаления.
- Почечная недостаточность. В терминальной стадии почечной недостаточности и в случае нефротического синдрома у пациентов значительно повышаются значения СОЭ.
- Концентрация гемоглобина. Анемия ускоряет падение красных кровяных телец.
- Форма эритроцитов. Определение СОЭ ненадежно при заболеваниях с аномальными эритроцитами, например, серповидноклеточной анемией.
Если существует диспропорция между концентрацией СРБ и СОЭ, первым делом необходимо принять во внимание возможность ложного измерения из-за вышеупомянутых факторов или при лабораторной ошибке, например, слишком долгое время от сбора до доставки в лабораторию или хранения пробирки в неподходящих условиях. Уровень СРБ более динамично реагирует на усиление воспаления, чем СОЭ
В случае, например, красной волчанки, значение СОЭ может быть повышено при низком уровне СРБ в крови. Это вызвано высоким уровнем интерферона 1 типа, подавляющего выработку печенью СРБ
Уровень СРБ более динамично реагирует на усиление воспаления, чем СОЭ. В случае, например, красной волчанки, значение СОЭ может быть повышено при низком уровне СРБ в крови. Это вызвано высоким уровнем интерферона 1 типа, подавляющего выработку печенью СРБ.
Как работает эндокринная система
Разные внешние или внутренние раздражители действуют на чувствительные рецепторы. В результате формируются импульсы, которые действуют на гипоталамус (отдел головного мозга). В ответ на них в гипоталамусе вырабатываются биоактивные вещества, поступающие по локальным сосудам в другой отдел головного мозга – гипофиз.
В ответ на их поступление в гипофизе вырабатываются гормоны гипофиза. Они попадают в кровь и, достигнув с кровотоком конкретной эндокринной железы, стимулируют в ней синтез того или иного гормона. А затем уже этот гормон поступает с кровью к гормональным рецепторам органов-мишеней, как описано выше.
По химическому строению гормоны делят на 4 вида
Стероиды – производные холестерина. Вырабатываются в коре надпочечников (кортикоиды) и половых железах (андрогены, эстрогены). В эту же группу входит кальцитриол.
Производные жирных кислот– эйкозаноиды. К ним относятся простагландины – повышают чувствительность рецепторов к боли и воспалительным процессам, тромбоксаны – участвуют в процессах свертывания крови, лейкотриены – участвуют в патогенезе бронхоспазма.
Производные аминокислот, преимущественно тирозина – гормон стресса адреналин, предшественник адреналина норадреналин и гормоны щитовидной железы.
Белково-пептидные соединения – гормоны поджелудочной железы инсулин и глюкагон, а также гормон роста соматотропин и кортикотропин – стимулятор синтеза гормонов коры надпочечников. В эту же группу входит антидиуретический гормон вазопрессин, «гормон материнства» окситоцин и ТТГ и АКТГ.
По месту образования выделяют гормоны:
- гипофиза и гипоталамуса;
- щитовидной, паращитовидной и поджелудочной желез;
- ЖКТ и надпочечников;
- яичек и яичников;
- жировой ткани;
- предсердия.
По механизму действия различают гормоны:
- проникающие в клетки – изменяют биосинтез белка;
- не проникающие в клетки – изменяют активность ферментов;
- мембранного действия – изменяют скорость транспортирования соединений через клеточные мембраны.
По биологическим функциям различают гормоны, регулирующие:
- обмен белков, жиров и углеводов;
- водно-солевой обмен;
- обмен фосфатов и кальция;
- репродуктивные функции.
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
«Порядочные» клетки живут, не мешая другим. Используют строго отведенное количество ресурсов, достойно выполняют свои биологические функции, а в положенное время — умирают, уступая место следующим поколениям (этот процесс называется апоптозом). Каждые 7–10 лет тело человека полностью обновляется.
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
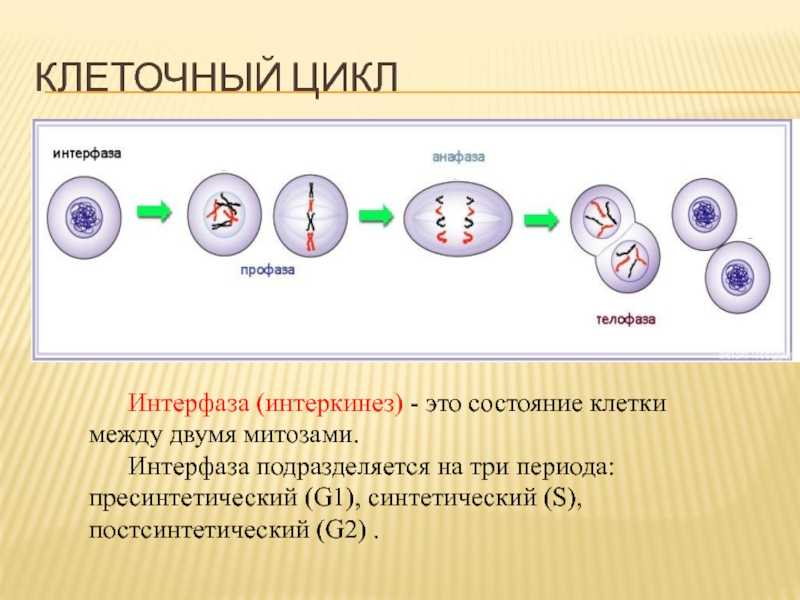
Перед делением клетка запасается «копией» наследственной генетической информации, которая находится в ее ядре. Нити ДНК, «свернутые» в хромосомы внутри ядра — реплицируются, т. е. удваиваются. И уже после этого клетка делится, спокойно раздавая каждой из дочерних клеток по идентичному набору хромосом. Из одной клетки получается две абсолютно таких же, и вместе со своим генетическим багажом каждая из них получает «знания» о том, как ей надо жить, какую функцию выполнять и сколько раз в жизни делиться.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Передается ли рак по наследству
Многие полагают, что, если факт наследования рака установлен, то заболевание возникнет обязательно. Наследственная предрасположенность не является 100% неизбежностью заболевания раком. Присутствие одних и тех же мутаций у одних оборачивается развитием рака в молодом возрасте, а другие остаются здоровыми до преклонных лет.
Проводимые исследования не выявили решающего влияния каких-либо внешних факторов на проявления онкологического заболевания. Ученые пришли к выводу, что в развитии рака большую роль играют особенности генетического фона человека.
Выявлены многочисленные варианты последовательности расположения нуклеотидов в цепочке ДНК, которые увеличивают или уменьшают вероятность образования злокачественных опухолей.
Повышенный CRP – всегда ли это патология?
У взрослых повышенное значение СРБ превышает 5 мг / л, за исключением курильщиков, людей с ожирением или гипертонией, для которых норма составляет менее 10 мг / л.
Считается, что у детей старшего возраста повышенное значение СРБ превышает 10 мг / л. Как и в случае со взрослыми, интерпретация результата должна быть предоставлена педиатру. Он оценит результат в контексте состояния ребенка и данных истории болезни.
Слегка повышенное значения СРБ до 40 мг / л может наблюдаются у пожилых людей и при беременности.
Поэтому при расшифровке результатов и составлении медицинского заключения необходимо учитывать другие лабораторные параметры, такие как общий анализ крови (БКК) с лейкоцитарной формулой.
Функции основных гормонов в организме
Список по названиям
Тестостерон — вырабатывается и у мужчин, и у женщин. Отвечает:
- за половую функцию и образование сперматозоидов у мужчин;
- половое влечение;
- качество мышечной ткани;
- работоспособность и целеустремленность;
- рост волос;
- стрессоустойчивость;
- поведение и эмоции;
- выработку эритроцитов и гемоглобина в крови;
- депонирование кальция в костной ткани.
Эстрогены – женские половые гормоны. Отвечают за формирование первичных половых признаков у женщин. Обеспечивают репродуктивные функции и эмоциональное состояние. У мужчин вырабатываются в жировой ткани живота из тестостерона. Стимулируют синтез коллагена и обеспечивают эластичность кожи. Принимают участие в работе кровеносной системы.
Прогестерон – сохраняет беременность и обеспечивает менструальный цикл у женщин. Кроме этого, и у женщин, и у мужчин он:
- является предшественником кортизола;
- повышает уровень ионов магния в крови и головном мозге;
- подавляет разрушение гормона счастья — серотонина;
- защищает миелиновые оболочки нервных волокон;
- оказывает успокаивающее действие;
- поддерживает нормальную трофику всех структур организма.
Дигидроэпиандростерон – вырабатывается в головном мозге и надпочечниках.
- повышает иммунитет;
- является предшественником половых гормонов;
- оказывает антистрессовое и антидепрессивное действие;
- улучшает память, тормозит развитие болезни Альцгеймера;
- отвечает за увеличение мышечной массы;
- активирует образование фолликулов в яичниках;
- улучшает качество костной ткани и препятствует развитию остеопороза.
Д-гормон (так называемый витамин Д):
- оказывает антиоксидантное и противоопухолевое действие;
- регулирует обмен фосфора и кальция, за счет чего препятствует развитию остеопороза у взрослых и рахита у детей;
- обладает противовоспалительным и иммуномодулирующим эффектом;
- улучшает работу сердечно-сосудистой системы;
- препятствует развитию осенне-весенних депрессий;
- улучшает созревание половых клеток;
- улучшает жировой обмен;
- повышает чувствительность клеток к инсулину;
- необходим при лечении псориаза.
ТТГ — тиреотропный гормон гипофиза. Регулирует выработку гормонов щитовидной железы трийодтиронина Т3 и тироксина Т4. При дисбалансе гормонов щитовидной желез развиваются гипер- и гипотиреоз.
Инсулин – отвечает за усвоение глюкозы клетками. Стимулирует мышечный рост и аппетит. При нехватке инсулина развивается сахарный диабет. Избыток инсулина приводит к инсулинорезистентности (снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки), что ведет к ожирению и развитию сахарного диабета 2 типа.
Дигидротестостерон – влияет на рост волос, образование акне, увеличение простаты у мужчин.
Кортизол – образуется из прогестерона. Адаптирует организм к влиянию стресса, защищает от воспалений, аллергических реакций, поддерживает в норме артериальное давление.
Альдостерон – гормон коры надпочечников; образуется из прогестерона. Отвечает за обмен солей и воды в организме.
ПТГ (паратиреоидный гормон) — вырабатывается в паращитовидных железах. Отвечает за кальце-фосфорный обмен.
СТП (соматотропный гормон) – гормон роста, избыток которого ведет к развитию акромегалии.
Как это может использоваться в борьбе с раком?
Это открытие позволяет по-новому взглянуть на терапию рака. Если норадреналин действительно с помощью сосудисто-метаболического «переключателя» стимулирует образование новых кровеносных сосудов, то терапия бета-блокаторами может обладать свойствами, препятствующими росту опухолевых клеток. Это предположение может быть проверено в клинических исследованиях в самое ближайшее время, т.к. бета-блокаторы уже много лет используются в качестве препаратов для снижения артериального давления. По мнению Френетте, перспективным могло бы быть сочетание бета-блокаторов и блокаторов сосудистого роста.