Открытия
В году эмбриональные стволовые клетки были идентифицированы у мышей Мартином Эвансом , Кауфманом и Мартином, а в 1998 году — у людей командами американца Джеймса Александра Томсона , Джозефа Ицковица-Элдора и израильтянина Бенджамина Рубиноффа. В году последние трансформировали ES-клетки в нейроны.
В 2006 году Шинья Яманака и Джеймс Александр Томсон независимо друг от друга открыли индуцированные плюрипотентные стволовые клетки (ИПСК) . Эти iPS-клетки представляют собой зрелые клетки, которые, таким образом, позволяют рождать все типы клеток в организме. Этот метод также включает генетическое перепрограммирование в лаборатории. Кроме того, генетические манипуляции позволяют получать такие клеточные линии без разрушения эмбрионов. Это открытие было удостоено Нобелевской премии по медицине в 2012 году Шинья Яманака.
И это только начало: стволовые клетки открывают новую эру медицинских исследований
Пока мы лишь составляем начальное представление о потенциале клеточной терапии. В будущем станут доступны еще более эффективные и персонализированные варианты лечения, особенно в сочетании с другими революционными медицинскими технологиями.
Например, благодаря интеграции современных процедур в клеточной биологии и редактировании генома можно создать целое новое поколение клеточной терапии.
Клеточная терапия также стимулирует профилактику онкологических заболеваний с помощью вакцин. Среди недавно предложенных методов — инъекционное введение ИПСК, генетически соответствующих реципиенту, которые не могут воспроизводиться. Это означает, что иммунная система может быть подготовлена для выявления широкого спектра онкологических заболеваний самых разных локализаций и, в конечном итоге, сможет бороться с раком на ранней стадии.
Все это свидетельствует о потенциале клеточной терапии для лечения самых разных заболеваний и является подтверждением того, что стволовые клетки — важный элемент новой эры медицинских исследований.
Что такое конечные продукты гликирования (AGE)
AGE представляют собой гетерогенную группу гликозилированных белков, то есть белков, к которым привязалась молекула сахара. Подробнее об этом мы писали.
Молекула сахара препятствует нормальному функционированию белка. Поскольку кожа содержит много белков, в частности коллаген и эластин, образованием AGE может объясняться в том числе ухудшение ее состояния, видимое старение.
Как только молекула сахара навязывает свое общество молекуле коллагена, его нити истончаются и укорачиваются. На биохимическом уровне это означает разрушение четкой перекрестно связанной организации волокон коллагена друг с другом.
В исследовании Niu et al. 2008 «Влияние гликозилирования внеклеточного матрикса на пролиферацию и апоптоз дермальных фибробластов человека через рецептор для продвинутых гликозилированных конечных продуктов» продемонстрировали на коже диабетиков (живой пример патофизиологии в действии), как укорачиваются, истончаются и дезорганизуются коллагеновые фибриллы по сравнению с контрольной группой здоровых участников6. К видимым изменениям, обусловленным воздействием AGE, можно отнести снижение эластичности кожи, плохое ранозаживление, появление морщин7.
Чем опасны продукты гликирования для клеток
- AGE могут связываться со специфическими рецепторами клеточной поверхности – рецепторами RAGE – и вызывать продукцию активных форм кислорода (ROS), воспалительных цитокинов или активировать внутриклеточные пути8. В исследовании все той же команды Niu et al. 2008 количество жизнеспособных фибробластов, культивированных на гликозилированной матрице, было снижено по сравнению с фибробластами, выращенными на контрольной матрице. Гликозилированный матрикс индуцировал остановку клеточного цикла и апоптоз культивируемых дермальных фибробластов, тогда как применение антител, блокирующих рецепторы RAGE, обращало вспять эти изменения.
- AGE могут образовывать поперечные связи с белками внутри клетки, такими как внутриклеточные домены различных рецепторов, или с белками внеклеточного матрикса, такими как коллаген, что приводит к измененным структурным и функциональным свойствам этих белков и, следовательно, в разрезе косметологии, к старению кожи9.
- AGE способствуют снижению эластичности сосудов, потере пластичности кожи и дегенерации хрящей, связок или хрусталика глаза. Они могут накапливаться в различных тканях и оказывать долгосрочное воздействие10.
В 2020 году группа исследователей представила систематический обзор эффектов гликозилированных белков на жизнеспособность, пролиферацию и апоптоз различных типов первичных изолированных стволовых клеток11.
Ниже мы приводим данные из него, актуальные для косметологов и дерматологов, которые, как уже понятно, не могут существовать в отрыве от открытий биологии и физиологии человека.
Мононуклеарные клетки периферической крови (МКПК)
Исследовательская команда Blackburn et al. 201712 изучала МКПК, выделенные из образцов периферической крови здоровых людей. Культивировались они на 1 мм метилглиоксаль-(MGO-) модифицированном коллагеновом геле в течение 4 дней.
Количество МКПК в культивированной MGO-среде уменьшилось.
Исследовательские команды Bhatwadekar et al. 200813, Chen et al. 200914, Li et al. 201615 изучали эндотелиальные клетки-предшественники (ЭКП). Bhatwadekar et al., Chen et al., Li et al. сообщили о снижении пролиферации клеток и/или увеличении апоптоза эндотелиальных клеток-предшественников после воздействия конечных продуктов гликирования (AGE) в концентрациях 200 мкг/мл и ниже, снижение пролиферации и ускорение апоптоза.
Прикладное значение: регенерация тканей, ускорение ранозаживления, снижение апоптоза и некроптоза.
Мезенхимальные стволовые клетки (МСК)
Несмотря на различия в концентрации (от 25 до 800 мкг/мл) и продолжительности воздействия продуктов гликации (от 6 часов до 19 дней) AGE привели к снижению пролиферации, связанному или не связанному с ней ускорению апоптоза16.
Прикладное значение: регенерация тканей, тканевой инжиниринг, реконструкция разных тканей, в том числе кожи, уменьшение фиброза, стимуляция неоваскуляризации, иммуномодуляция и стимуляция регенерации эндогенной ткани.
Стволовые клетки жировой ткани (СКЖТ)
Этот подвид мезенхимальных стволовых клеток получался путем ферментативной диссоциации коллагеназой. Независимо от различий в концентрации (от 20 до 1600 мкг/мл) и продолжительности (от 8 часов до 7 дней) воздействия AGE, Li et al.17 и Wang et al.18 сообщили об увеличении апоптоза. AGE в целом оказали пагубное влияние на жизнеспособность стволовых клеток, выделенных из жировой ткани.
Прикладное значение: антиапоптотический, противовоспалительный, проангиогенный, иммуномодулирующий и противоракообразующий потенциал, регенерация тканей, реконструкция жировой ткани.
Но в вышеупомянутом обзоре отмечались и противоречивые результаты, когда AGE не оказывали видимого воздействия. Duruksu и Aciksari 201819 связали такие данные с низкими концентрациями используемых продуктов в процессе гликации. Исследователи пока объяснили эти противоречивые результаты тем, что AGE и другие лиганды рецептора RAGE, такие как HMGB1 и кальций-связывающий белок B S100, усиливали пролиферацию стволовых клеток.
Здесь очень важно вспомнить Гиппократа: всё есть яд и всё есть лекарство. Принципиален момент перехода от апоптоза к некрозу и яркая зависимость от концентрации конечных продуктов гликации
Использование стволовых клеток в клинике
Первый большой успех в использовании клеточных технологий связан с успешной
трансплантацией выращенного эпителия на полнослойные раны двум пациентам,
один из которых в результате тяжелых ожогов потерял 80%, а другой частично
или полностью 40% кожного покрова.
Способность стволовых клеток интегрироваться в трехмерные тканевые
структуры организма под контролем микроокружения реципиента делает их
использование идеальным подходом для цитозаместительной терапии. Первые
успехи клеточных технологий были связаны с гистотипическим восстановлением
дефектов кожного покрова с помощью тканевой инженерии. Были разработаны
трехмерные клеточные конструкции, состоящие из внеклеточного матрикса и
аутологичных или аллогенных клеток, названные «живыми эквивалентами дермы и
кожи», которые использовали для трансплантации на ожоговые поверхности,
длительно незаживающие раны и язвы разной природы. Успешно
используются методы тканевой инженерии для лечения ожогов и язв роговицы.
Многие исследователи связывают большие перспективы для клинической практики
с использованием эмбриональных стволовых клеток. Эмбриональные
стволовые клетки можно стимулировать к дифференциации в разные типы клеток,
в том числе и кератиноциты. Однако в настоящее время еще существуют
сомнения в полной безопасности использования эмбриональных стволовых клеток
для тканевой инженерии.
В. Терских, доктор биологических наук,А. Васильев, доктор биологических наукЭстетическая медицина 4/2004
Медицинские приложения
В медицине стволовые клетки животных и человека были предметом большого количества исследований с 1990-х годов с надеждой на регенерирование тканей или даже их создание с нуля, а в идеале — на реконструкцию органов ( клеточная терапия ) таким же образом, как изобретенные опозоны. по Огюст Люмьер . Эти потенциальные преимущества привели к экспериментам по терапевтическому клонированию , чтобы контролировать его производство в больших количествах.
Первый препарат из стволовых клеток одобрен вМай 2012 г.канадскими властями. Это Прохимал , препарат, полученный из взрослых мезенхимальных стволовых клеток .
Что такое гликация?
Гликация – это химический процесс, при котором происходит взаимодействие белков и сахара, в результате чего появляются гликолизированные продукты.
В результате гликации образуются конечные продукты, или AGEs (от английского термина Advanced Glycation Endproducts). Эти остаточные продукты не выводятся ни из клетки, ни из организма в целом; накапливаясь, они вызывают нарушение обменных процессов, гипоксию и гибель клетки.
Этот процесс недружественной коммуникации между молекулами сахара и белками может снижать потенциал регенеративной и восстановительной медицины в области трансплантации стволовых клеток в поврежденную ткань.
Образующиеся конечные продукты гликирования (AGE) создают среду, в которой стволовым клеткам, уже готовым высадиться на поврежденную ткань как на поверхность Марса, выжить становится непросто5. Сложности усугубляет добавленный окислительный стресс и присутствие воспалительных цитокинов.
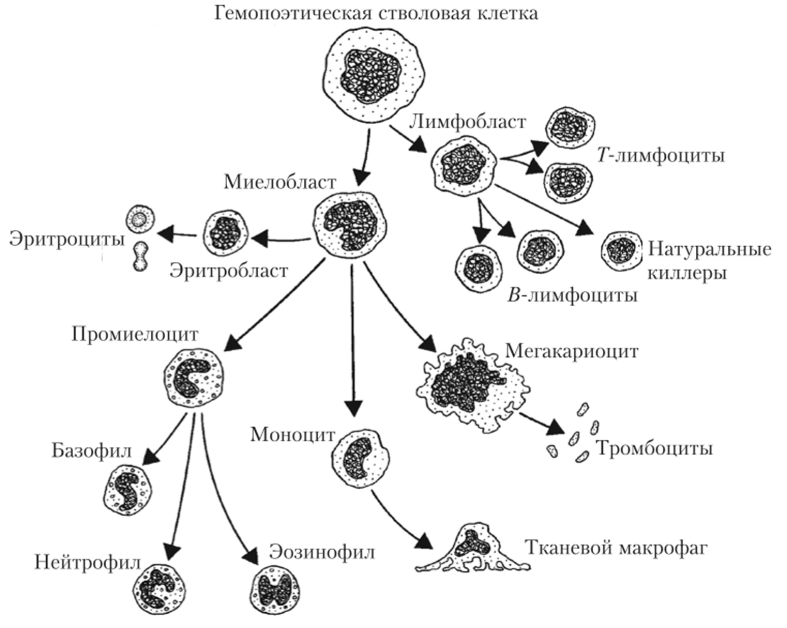
Стволовые клетки в онтогенезе
В онтогенезе стволовые клетки возникают в определенный временной промежуток
и часто формируются в одних участках организма, а выполняют свою функцию —
в других, в связи с чем наблюдается миграция стволовых клеток в новое
микроокружение. Так, первые гематопоэтические стволовые клетки мыши
появляются вне эмбриона в желточном мешке, на следующем этапе развития
организма стволовые кроветворные клетки обнаруживаются в области эмбриона,
которая называется аорта-гонадамезонефрос, затем органом кроветворения
становится печень и, наконец, у взрослого организма кроветворение
происходит в трубчатых костях и селезенке.
Волосяные фолликулы часто рассматривают как резервуар эпидермальных
стволовых клеток, поскольку они могут давать начало эпидермальным
кератиноцитам и нескольким линиям кератиноцитов волосяного фолликула.
Образование волосяных фолликулов происходит только в определенный временной
промежуток онтогенеза, после чего они в редких случаях и у некоторых
видов млекопитающих могут возникать заново.
Дифференциация стволовых клеток
Стволовые клетки способны продуцировать дочерние клетки, которые в
дальнейшем дают начало различным линиям дифференцированных клеток. Моррисон
с соавт. считает, что стволовые клетки способны производить все
дифференцированные клетки, которые возможны в конкретной ткани и в
конкретное время. Обычно стволовые клетки производят дочерние клетки,
которые способны дифференцироваться в разных направлениях, давать разные
линии клеток, что обозначается термином «мультипотентность». Например,
гемато-поэтические стволовые клетки дают начало всем линиям клеток крови.
Но могут быть стволовые клетки, которые дифференцируются только в одном
направлении (монопотентность), например герминативные стволовые клетки,
производящие гаметы одного пола.
Маленькая клетка, большой эффект: как ИПСК помогают в исследованиях
Работа с ИПСК и клетками, полученными в результате их дифференцировки, открывает исследователям широкие возможности: они могут искусственно восстанавливать целые органы из их различных компонентов, и даже могут помочь имитировать различные заболевания. ИПСК используются для создания клеток различных органов — нервных клеток, кардиомиоцитов или гепатоцитов — с классическими признаками заболевания. Таким образом, в чашке Петри можно смоделировать разные заболевания, от болезни Паркинсона до сердечно-сосудистых и даже онкологических заболеваний.
С помощью ИПСК можно воссоздать специфическое поражение, происходящее на уровне генов. Можно создавать модели заболеваний, возникающих вследствие определенных генетических повреждений. Поиск в пораженных клетках определенных веществ позволяет изучить новые подходы к лечению и эффекты потенциальных активных веществ.
Еще один возможный вариант использования: в кардиомиоцитах, созданных из индуцированных стволовых клеток, уже на ранней стадии можно получить информацию о возможных побочных эффектах активных веществ, которые могут представлять опасность для функции сердца у пациента.
Пластичность стволовых клеток
В связи с этим было предположено, что стволовые клетки представляют собой
не столько конкретные клетки, сколько биологическую функцию.
Однако есть авторы, считающие, что такое расширенное толкование феномена
стволовых клеток пока еще преждевременно. По-видимому, статус
стволовых клеток должен постоянно поддерживаться за счет поступающих в
клетки сигналов и синтеза определенных белков. Микроокружение
производит сигналы, определяющие поведение стволовых клеток. Например,
нейральные стволовые клетки присутствуют в разных отделах мозга, но
реализуют эту возможность только клетки, локализованные в определенных
участках. В то же время фактор роста фибробластов (FGF-2) может
активировать латентные нейральные стволовые клетки из разных участков
взрослого мозга. В связи с этим направление дифференциации потомков
стволовых клеток может определяться сигналами, которые создаются в каждой
конкретной нише.
За последнее время увеличилось число сообщений, согласно которым стволовые
(или подобные им) клетки могут быть выделены из разнообразных тканей
взрослого организма. Причем эти клетки способны мигрировать в поврежденные
участки тканей и стимулировать репарацию дефекта либо путем дифференциации
в клетки этих тканей, либо путем создания микроокружения, усиливающего
репарацию эндогенных стволовых клеток. Проблема пластичности
стволовых клеток в настоящее время активно обсуждается.
Органы в «пробирке»
Эмбриональные стволовые клетки способны формировать более 350-ти клеток костей, кожи, мозга и других органов. Но где их взять?
Настоящей сенсацией стали в 2006 году лабораторные исследования японского ученого Cинья Яманака, доказавшего, что можно взять любую клетку взрослого человека и путем генного перепрограммирования вернуть ее в состояние эмбриональной.
Российские ученые не отстают. Так, в московском медико-стоматологическом университете смогли вырастить из стволовых клеток …зубы. Для этого исследователи использовали стволовые клетки кожи и мезенхимальные — из жировой ткани и пульпы зубов. Первыми пациентами, у которых из подсаженных зачатков выросли искусственные зубы и на сколы старых зубов наросла эмаль, стали мыши. Приживаемость — почти 100%.
Следующий этап — адаптация технологии для человека и поиск решения, как вырастить зуб необходимого вида, например, передний резец или моляр.
Параллельно российские ученые работают над проблемой алопеции. Они уже научились конструировать в пробирке волосяной фолликул для дальнейшей пересадки человеку обратно. Но в экспериментах, опять-таки на грызунах, столкнулись с неожиданной проблемой — пересаженные в холку лысым мышкам волосы выросли густым пучком, но в разных направлениях, куда им вздумается, и даже прорастали вовнутрь. И тут нашлись принципиально новые подходы — клонировать, мультиплицировать волосы для пересадки в поредевшие места или пересаживать даже не готовые луковицы, а их клетки, и давать фолликулам образовываться самим. К сожалению, применение этого метода возможно только, если хоть что-то от собственных волос осталось.
Функции
Эмбриональное развитие
Эмбриональные стволовые клетки являются центральными клетками развития, так как они будут постепенно генерировать все другие клетки организма благодаря точно организованным стадиям дифференцировки и пролиферации, чтобы в конечном итоге создать жизнеспособную многоклеточную особь.
Взрослый организм
Эмбриональные стволовые клетки человека: A: стволовые клетки человека все еще недифференцированные. B: нервные клетки.
Взрослые стволовые клетки встречаются гораздо реже, поскольку после завершения развития потребность в пролиферации может стать опасной . Таким образом, стволовые клетки сохраняются в небольших местах каждой ткани ; Эти ниши имеют сложные механизмы поддержания и регулируются для производства только клеток, необходимых для поддержания функционального организма.
Эти стволовые клетки менее «плюрипотентны», чем те, что составляют эмбрион: они могут производить только клетки, специфичные для своей ткани. Например, у взрослых млекопитающих кроветворные стволовые клетки непрерывно регенерируют клетки крови . Существуют также стволовые клетки кишечника и нервные стволовые клетки . Они присутствуют только в двух различных областях мозга: гиппокампе и субвентрикулярной зоне (области, граничащей с боковыми желудочками ).
Наличие стволовых клеток может служить различным механизмам в зависимости от ткани:
- Считается, что стволовые клетки частично ответственны за регенерацию конечностей у некоторых животных. Таким образом, это явление существует у некоторых позвоночных (таких как ящерица , тритон или саламандра ).
- орган, содержащий ткань, должен расти либо во время роста, либо для выполнения определенной функции, например, сердце спортсменов больше, матка становится больше во время беременности и т. д.
- клетки стареют и умирают (например, эритроциты , клетки без ядра и лишенные ДНК, продолжительность жизни которых составляет 120 дней, или кератиноциты на поверхности кожи), и они должны обновляться.
- травма , ишемия или другие явления могут создать гибель клеток регенерировать; эта регенерация иногда несовершенны либо из — за отсутствия стволовых клеток, или потому , что архитектура ткани слишком расстроена (который зависит как от ткани , так и на ущерб, который был нанесен).
Пролиферация стволовых клеток
Благодаря такой структуре клеточной популяции в организме удается
поддерживать гомеостаз эпидермиса за счет очень небольшого числа делений
стволовых клеток. Транзиторные клетки проходят несколько
делений, находясь в базальном слое эпидермиса, прежде чем дают начало
комитированным клеткам, которые переходят в супрабазальные слои эпидермиса,
выходят из клеточного цикла и терминально дифференцируются. Это
обеспечивает быстрое обновление эпидермиса при относительно небольшом числе
делений стволовых клеток. В других случаях стволовые клетки могут иметь
очень короткий цикл. Например, пролиферативный цикл стволовых клеток крипты
тонкого кишечника равен приблизительно 24 часам. В общем, можно
сказать, что в тканях взрослого организма стволовые клетки пролиферируют
сравнительно медленно, но это не является обязательным свойством стволовых
клеток. Экспериментально определить продолжительность пребывания некоторых
стволовых клеток в состоянии покоя трудно, однако имеющиеся данные
позволяют заключить, что некоторые стволовые клетки могут находиться в
покое исключительно длительное время. Учитывая пролиферативные
характеристики, можно представить себе следующую иерархию стволовых и
транзиторных клеток. В ткани имеется некоторое число стволовых клеток,
которые находятся в глубоком покое и делятся редко. Лишь когда внешние
воздействия или общий недостаток стволовых клеток вызывают их мобилизацию,
стволовые клетки начинают пролиферировать. Кроме того, имеется достаточно
много активно пролиферирующих, обычно короткоживущих стволовых клеток,
которые образуют большое число транзиторных клеток, производящих в свою
очередь дифференцированные клетки (схема).
Рейтинг по их потенциалу
Стволовые клетки можно различить по их способности к дифференцировке:
Тотипотентные стволовые клетки : могут продуцировать любой тип клеток и, следовательно, весь организм;
Плюрипотентные стволовые клетки : способны отдавать все типы клеток, кроме эмбриональных придатков ;
Мультипотентные стволовые клетки: способны давать начало различным типам клеток, но специфичны для данной клеточной линии;
Унипотентные стволовые клетки: которые могут дать начало только одному типу клеток (однако они могут, как и любые стволовые клетки, самообновляться, поэтому важно отличать их от предшественников).
Характеристики
Зигота: spirogyra sp. (Zygnematales).
Колония человеческих стволовых клеток в культуре с мышиными фибробластами.
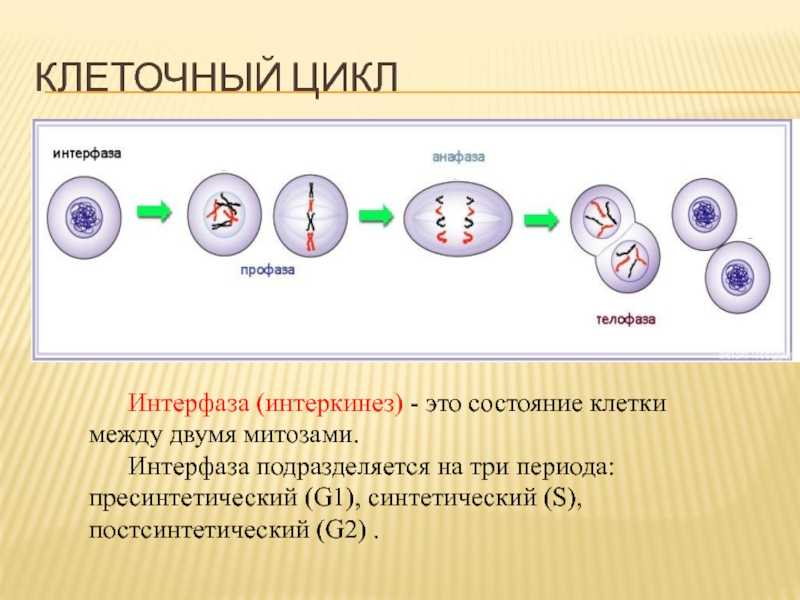
Стволовые клетки часто способны выполнять два типа деления клеток : первый, классический, он считается симметричным (клетка делится на 2 стволовые клетки) и асимметричным, который дает с одной стороны предшественника, более дифференцированную клетку и с другой — стволовая клетка. Таким образом, именно использование симметричного деления позволяет стволовой популяции поддерживать свое количество более или менее постоянным во время производства дифференцированных клеток.
Есть два шага в создании дифференцированной клетки:
- дифференциация, в течение которого клетка претерпевает качественное изменение в фенотипе . Например, появление новых мембранных белков из-за активации экспрессии данного гена. Следовательно, дифференциация stricto sensu — это разовое событие;
- созревание, при котором клетка претерпевает количественное изменение фенотипа. Это соответствует увеличению выработки определенных белков и, следовательно, обязательно дольше или короче.
Таким образом, мы можем выделить три фазы в процессе формирования дифференцированной ткани:
- Первый, при котором стволовые клетки делятся и либо обновляются, либо создают определенные клетки. Эта фаза включает только митотические деления .
- На следующей фазе, квалифицируемой как промежуточная, определенные клетки являются транзитными клетками, они претерпевают как митоз, так и созревание / дифференцировку. Поэтому они становятся все более зрелыми, продолжая делиться.
- Последняя фаза — фаза созревания: клетки больше не делятся, а только дифференцируются и созревают, пока не дадут зрелые клетки, оснащенные всем материалом, необходимым для их функции.
Между первой фазой (пролиферация без дифференциации) и третьей (дифференцировка без пролиферации) промежуточная фаза очень гибкая, позволяя более или менее длительные периоды созревания, которые различаются в зависимости от клеточных линий.
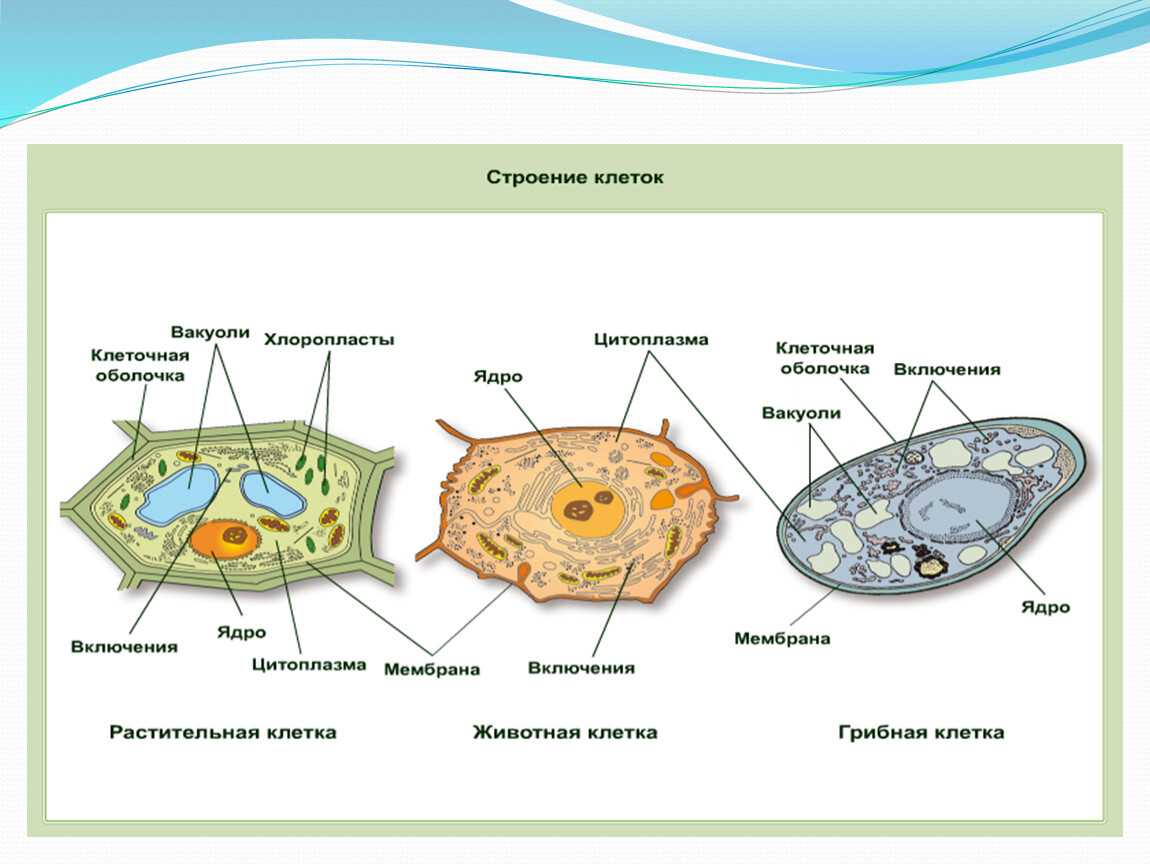
Стволовые клетки существуют на протяжении всей жизни организма, но мы можем различать, в частности, у млекопитающих эмбриональные стволовые клетки и взрослые стволовые клетки.
Также в разделе
Гинеколог для маленькой девочки Когда пора познакомиться? Имеет ли смысл посещать гинеколога
в детском возрасте, задолго до появления взрослых проблем? Родители девочки
должны понимать, что…
Грамотная контрацепция — залог здоровья женщины В последнее время появляется все больше и больше различных лекарственных средств. При этом главной целью их создания является уменьшение частоты побочных…
Гены шизофрении? Полученные данные и их патофизиологическое значение Харрисон П., Оуэн М.
Шизофрения наследуется, но неясно, какие гены вовлечены в этот процесс. Идентификация таких генов необходима для окончательного выяснения…
Есенціальна артеріальна гіпертензія у жінок у період постменопаузи: особливості кальцієвого обміну та стану мінеральної щільності кісткової тканини. Значення артеріальної гіпертензії (АГ) як фактора ризику серцево-судинних захворювань у жінок таке саме велике, як і у чоловіків , але серед великої…
Связь между геликобакторной инфекцией и некоторыми гастроинтестинальными симптомами и синдромами С. Постников
Существует много препятствий изучению возможной связи между инфекцией Helicobacter pylori и гастроинтестинальными симптомами. Так, клиническая картина…
Акне у лиц молодого возраста Как вы думаете, что самое страшное для современной молодежи? Отсутствие карманных денег? Проблемы с родителями или друзьями? Нет! Прыщи. И, конечно, абсолютно все…
Место b-блокаторов в лечении острого коронарного синдрома: какие препараты, у каких пациентов и когда следует применять? Профессор А.Л. Сыркин, к.м.н. А.В. Добровольский
ММА имени И.М. Сеченова
Введение
Острый коронарный синдром совокупность клинических и…
Вакцинация против гриппа в группе длительно и часто болеющих детей Т. П. Маркова, кандидат медицинских наук
Д. Г
Чувиров
Институт повышения квалификации ФУ «Медбиоэкстрем» МЗ РФ, Москва
В последние годы большое внимание…
Коррекция патологии сердца с помощью электрокардиостимуляции. Возможности программирования атриовентрикулярной задержки Хирманов В
Доктор медицинских наук, профессор, Юзвинкевич С. , кандидат медицинских наук, НИИ кардиологии Минздрава РФ, С.-Петербург
Внедрение в…
Лекарственные растения в комплексной терапии и профилактике простуды Современный пациент понимает, что при простудных заболеваниях для быстрого выздоровления необходим комплексный подход. Поэтому наряду с лекарственными…
Результаты цитологии при различных предраковых состояниях
| Предраковая патология | Характеристика | Цитологическая картина |
| Дисплазия | Патологическое состояние шейки матки, вызванное инфицированием папилломавирусом. Возбудитель попадает в эпителии шейки, влияет на процесс формирования и развития клеток, приводя к появлению неправильно развитых клеточных структур | Слабая степень (CINI). На этой стадии болезни поражается только верхний слой эпителия (1/3), поэтому в мазке обнаруживаются неправильно развитые клетки, принадлежащие к наружному слою шейки
В мазках обнаруживаются клетки с признаками койлоцитоза, появившиеся из-за инфицирования папиломавирусом. Обнаруживаются клетки с дискариозом, у которых ядра увеличены, имеют неправильные контуры и окраску. Видны другие клетки, отличающиеся строением и окраской, но количество неправильно развитых клеточных элементов невелико |
| Умеренная степень (CINII) поражения эпителия шейки матки затрагивает до 2/3 его толщины, поэтому в мазке появляются неправильно развитые клетки, принадлежащие более глубокоим слоям – помежуточному, а иногда и расположенному под ним парабазальному.
Отличительная черта таких клеток – большой размер и нарушение пропорций между размерами ядра и жидкой части – цитоплазмы. Количество атипичных клеток значительно выше, чем при легкой степени |
||
| Тяжёлая степень(CINIII). При этой патологии поражается вся толща эпителия. Поэтому в мазке обнаруживаются клетки всех его слоев – поверхностного, промежуточного, базального и парабазального с самыми разными признаками атипии.
Наблюдаются неправильно делящиеся клетки (атипичный митоз) |
||
| Лейкоплакия | Патологическое состояние, вызванное неправильным развитием клеток при котором они становятся плотными, ороговевшими | В мазках видны клетки с различной степенью ороговения (кератоза), безъядерные и другие неправильно развитые (атипичные). Чем выраженнее лейкоплакия, тем больше в мазке неправильно развитых клеток, и тем сильнее выражен в них процесс ороговения |
| Эритроплакия | Эритроплакия – истончение (атрофия) плоского эпителия, при котором он настолько истончается, что через поверхностный слой эпителия начинают проглядывать более глубокие красные внутренние слои | Из-за атрофических процессов слизистой в мазке обнаруживаются атипичные клетки всех слоёв эпителия. Могут обнаруживаться клеточные элементы с различными аномалиями строения, как при тяжёлой дисплазии.
В образцах много лейкоцитов за счёт постоянного вялотекущего воспалительного процесса, а ранимость шейки приводит к появлению примесей крови |
По мере утяжеления предрака клетки все больше напоминают злокачественные. Они сбиваются в комплексы, напоминающие сгустки, пчелиные соты, розетки, наслаиваются друг на друга, образуя пласты.
Соотношение классификаций по стадиям развития предраковых состояний шейки матки
В документе, выдаваемом по результатам цитологии, врач-цитолог перечисляет клеточные структуры, обнаруженные в мазке. Это позволит гинекологу-онкологу после расшифровки результатов анализа поставить правильный диагноз.
При обнаружении в анализах на цитологию клеток, характерных для дисплазии, указывается степень предрака:
- Лёгкая (LSIL) – результат, соответствующий первой стадии болезни (CINI)
- Тяжёлая (HSIL) – вторая-третья стадия болезни (CINII-CINIII)
Продолжение статьи
- Интерпретация (расшифровка) результатов цитологии
- Расшифровка цитологии: интерпретация лицевой стороны единого бланка
- Расшифровка цитологии: интерпретация данных по результатам цитологического анализа
- Расшифровка цитологии: интерпретация результатов цитологического анализа согласно их классификации по Папаниколау
- Интерпретация зарубежной терминологии, используемой для расшифровки цитологии
- Расшифровка цитологии: интерпретация протокола цитологического обследования при дисплазии шейки матки
- Расшифровка цитологии: что делать, если анализ на цитологию шейки матки выявил предрак
- Расшифровка цитологии: интерпретация протокола цитологического обследования при раке шейки матки
- Расшифровка цитологии: дальнейшие действия при плохой интерпретации анализов
Чем предраковые клетки, обнаруженные при цитологии шейки матки, отличаются от здоровых и злокачественных
Эти клетки отличаются от здоровых размерами, строением, наличием различных включений. Они не имеют столь разительных отличий, как злокачественные, но и здоровыми их назвать нельзя. То есть предрак – это переходное состояние между нормой и онкологией.
Существуют также клетки с атипией неясного значения, обозначаемые в результатах анализа ASC-US, ASC-H, AGC. AGUS-NOS. Хотя они имеют патологические изменения – увеличенные ядра и другие аномалии строения, это отклонения не столь явные, чтобы отнести их к предраку или раку. Например, такие клеточные элементы могут появляться при воспалении, а потом исчезать после проведенного лечения.
Со временем, при отсутствии лечения, предраковое состояние утяжеляется. По мере проникновения патологического очага внутрь тканей, клетки все больше напоминают раковые. В результате предрак переходит в злокачественную опухоль шейки матки.
Перерождение здоровых клеток в предраковые, а затем – в злокачественные, происходит постепенно, поэтому обнаружить границу между этими состояниями может только опытный врач-цитолог.
Осмотр материала под микроскопом
Этапы трансплантации стволовых клеток
Весь процесс пересадки проходит в несколько этапов
Шаг 1: Сбор стволовых клеток
Сбор стволовых клеток в костном мозге обычно проводится в операционной.
- Человеку предоставляется общая или эпидуральная (спинальная) анестезия.
- Врач делает несколько небольших проколов в коже на уровне тазовой кости.
- В этих отверстия к костному мозгу подводится специальная игла, прикрепленная к шприцу.
- Врач всасывает костный мозг и кровь из костей в шприц, пока у него не будет достаточно стволовых клеток для трансплантации. Процедура обычно длится от 1 до 2 часов. Конкретное количество удаленной крови и костного мозга изменяется и зависит от веса донора и концентрации стволовых клеток в костном мозге. У взрослого обычно берут от 3 до 5% от костного мозга.
- После процедуры врач накладывает повязку к местам проколов.
Донор восстанавливается после анестезии в реанимационной комнате. Медицинская команда наблюдает за любыми признаками кровотечения, боли или других побочных эффектов, вызванных этой процедурой. Донор обычно может покинуть больницу через несколько часов после процедуры. Иногда он должен остаться в больнице на ночь.
Область бедра донора может быть чувствительной в течение нескольких дней. Ему могут назначаться лекарства для облегчения боли.
Пожертвование костного мозга сопряжено с небольшими рисками. Организм обычно заменяет эти клетки через несколько недель. Врач может предложить принимать добавки железа до тех пор, пока количество клеток крови не увеличится.
Иногда донорскую кровь собирают за несколько недель до сбора костного мозга. Он сохраняется и затем возвращается донору после завершения сбора стволовых клеток. Это переливание крови помогает предотвратить анемию.
Шаг 3: Химиотерапия и лучевая терапия
Чтобы увеличить шансы на успех трансплантата, пациент получает химиотерапию, а иногда и высокодозную лучевую терапию. Их цель – устранить больной костный мозг, уничтожив как можно больше раковых клеток.
Шаг 4: Трансплантация стволовых клеток
Стволовые клетки вводятся через центральный катетер в кровь реципиента. Они поселяются в костном мозге, где начинают размножаться и развиваться.
Процедура может длиться от 1 до 2 часов. Продолжительность варьируется в зависимости от объема вводимых стволовых клеток. Их количество определяется в зависимости от веса получателя.
Пересадка обычно проводится через 1-3 дня после подготовительного или интенсивного лечения. До вливания стволовых клеток вводят препараты, которые помогают уменьшить побочные эффекты, такие как тошнота, озноб и лихорадка.
Во время инфузии команда специалиста следит за получателем, чтобы вовремя отреагировать в случае возникновения побочных эффектов, таких как озноб, лихорадка.
Если в стволовые клетки был добавлен консервант, у пациента может появиться неприятный запах изо рта и зуд во рту.
День, когда вводят стволовые клетки, обычно считается днем 0. Дни, следующие за трансплантацией, нумеруются в порядке возрастания (например, День 1, День 2). Эта система позволяет учесть момент, когда произошли определенные события, такие как появление новых клеток крови или осложнений.
Шаг 5: Медуллярная аплазия
После трансплантации необходимо дождаться восстановления костного мозга. За это время он еще не производит клетки крови. Это деликатный момент: у вас почти нет иммунной системы (лейкоцитов), а уровень тромбоцитов самый низкий. Поэтому остаются очень высокими риски заражения и кровотечения. Вот почему вы остаетесь изолированными в своей палате. Эта фаза длится от 10 до 15 дней.
Шаг 6: Регенерация костного мозга
Примерно через 15 дней после трансплантации костный мозг восстанавливается и начинает производить клетки крови, включая лейкоциты. Эти новые белые кровяные клетки распознают раковые клетки как ненормальные и устраняют их. Эта фаза регенерации длится от 2 до 3 недель.
Шаг 7: Обследование
Чтобы убедиться, что трансплантация костного клеток прошла успешно и что новые здоровые белые кровяные клетки удалили все раковые клетки, делают анализы крови, пункции костного мозга и пр. исследования.