Выступления в СМИ
- Известия. 21.08.2020. Бык-прародитель: генные инженеры создали Адама для мужского стада.https://iz.ru/1050551/anna-urmantceva/byk-praroditel-gennye-inzhenery-sozdali-adama-dlia-muzhskogo-stada
- Коммерсантъ. 07.10.2020. «Генетические ножницы» взяли Нобелевку.
- «Эксперт» №44 (1182). 26.10.2020. Человек отредактированный.https://expert.ru/expert/2020/44/chelovek-otredaktirovannyij/
- Агентство городских новостей Москва. 23.07.2020. Работа Медико-генетического научного центра имени академика Бочкова.https://www.mskagency.ru/materials/3025615
- Минобрнауки. 28.07.2020. Российские ученые разрабатывают метод геномного редактирования для лечения пациентов с муковисцидозом.https://www.minobrnauki.gov.ru/ru/press-center/card/?id_4=2869
- ТАСС Наука. 19.11.2020. Потенциальная методика для лечения муковисцидоза оказалась высокоэффективной.https://nauka.tass.ru/nauka/10046151
- Российский научный фонд. 20.11.2020. Приводящую к муковисцидозу мутацию удалось исправить в 5% клеток.https://rscf.ru/news/presidential-program/gennoy-terapii-dlya-lecheniya-mukovistsidoza/
- Такие дела. 22.11.2020. Российские ученые с помощью геномного редактора исправили мутацию, вызывающую муковисцидоз. https://takiedela.ru/news/2020/11/22/redaktor-mukoviscidoz/
- Медвестник. 22.11.2020. Российские ученые добились успеха в лечении муковисцидоза с помощью генной инженерии. https://medvestnik.ru/content/news/Uchenye-dobilis-uspeha-v-lechenii-mukoviscidoza-s-pomoshu-gennoi-injenerii.html
- Indicator. 22.11.2020. Приводящую к муковисцидозу мутацию удалось исправить в 5% клеток. https://indicator.ru/medicine/privodyashuyu-k-mukoviscidozu-mutaciyu-udalos-ispravit-v-5-kletok-22-11-2020.htm
- Пресс-центр ФГБНУ «МГНЦ». 28.11.2020. Исправить мутацию, приводящую к муковисцидозу, удалось в пяти процентах клеток. https://genetics-info.ru/news/ispravit-mutatsiyu-privodyashchuyu-k-mukovistsidozu-udalos-v-pyati-protsentakh-kletok/
- 03.04.2021 Международная медицинская панорама. Генетическое редактирование: как и зачем?https://www.youtube.com/watch?v=MI5RnrpFutg
- 10.04.2021 Телеканал «Доктор» Опечатка в ДНК: как вычислить будущее заболевание?https://www.youtube.com/watch?v=-ZspsJ53rIA
- 30.11.2021 Радио Спутник. Лекарства наступившего будущего. Что такое генная терапия https://radiosputnik.ria.ru/20211130/1761399633.html
- 31.03.2021 Ольга Левченко. Генетик: ученый или врач
- 13.04.2021 ТАСС Наука. Генетики локализовали причину нового психического расстройства https://nauka.tass.ru/nauka/11134105
- 02.06.2021 Минобрнауки России. Российские ученые обнаружили новую мутацию, которая приводит к умственной отсталости https://www.minobrnauki.gov.ru/press-center/news/?ELEMENT_ID=34892
В ожидании прорыва
Эксперты отмечают, что проведение генной терапии может быть небезопасно. Один из первых пациентов «генных инженеров», 18-летний Джесси Джелсинджер, умер в 1999 году через четыре дня с начала клинического испытания из-за масштабного иммунного ответа на вирусы, которые доставляли гены в его клетки.

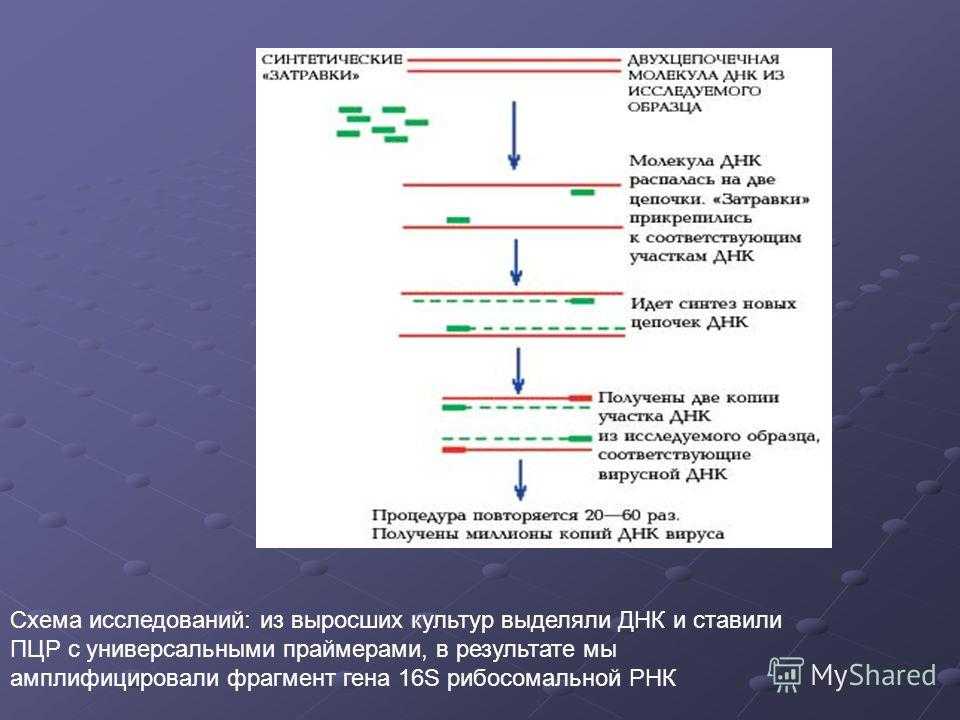
- Результаты анализа ДНК
- globallookpress.com
«Конечно, с тех пор медицина сильно шагнула вперед, — отметила в беседе с RT кандидат медицинских наук, врач-генетик Наталья Ветрова. — Учёные используют другие вирусы, доказавшие в ходе испытаний на животных свою безопасность».
«У пациентов, перенёсших генную терапию, уже известно несколько случаев лейкемии, — подчеркнула Ветрова. — К сожалению, исправлять подобные ошибки учёные пока не умеют. Но в новой операции исследователи смогли довольно точно задать место редактирования. Думаю, в случае успеха этого метода генную терапию ждёт прорыв, и, вероятно, белки с «цинковыми пальцами» в перспективе помогут вылечить и другие тяжёлые заболевания. Например, исправить дефективные клетки больного раком, избавив их от мутации».
Генетическое редактирование может изменить целые виды — навсегда
Ссылка: http://www.ted.com/talks/jennifer_kahn_gene_editing_can_now_change_an_entire_species_forever
Технология редактирования генов CRISPR позволяет учёным менять последовательности ДНК и гарантирует, что результаты отредактированных генетических особенностей будут наследоваться будущими поколениями, открывая возможность создания альтернативных видов.
Более того, эта технология ведёт нас к вопросам: как новая власть повлияет на человечество? Что мы собираемся менять? Мы теперь боги?
Присоединяйтесь к размышлениям журналиста Jennifer Kahn по поводу данных вопросов.
Запись выступления
Системы редактирования геномов TALEN и CRISPR/CAS инструменты открытий
Авторы: Немудрый А. А., Валетдинова К. Р., Медведев С. П., Закиян С. М.
Аннотация
Детальное изучение геномов растений, животных и человека открывает широчайшие возможности применения полученных знаний в биотехнологии и медицине. Однако только данных о нуклеотидных последовательностях геномов недостаточно для понимания функциональных взаимосвязей отдельных элементов геномов и их роли в формировании фенотипических признаков и патогенезе отдельных заболеваний. В постгеномную эпоху активно развиваются методы, позволяющие манипулировать с ДНК в геномах, а также визуализировать и управлять экспрессией генов и работой регуляторных элементов. Тем не менее далеко не все методы отвечают высоким требованиям к их эффективности, безопасности и доступности для широкого круга исследователей. В последние несколько лет появились новейшие методы редактирования геномов это системы TALEN (Transcription Activator-Like Effector Nucleases) и CRISPR (Clustered Regulatory Interspaced Short Palindromic Repeats)/Cas9. Эти появившиеся относительно недавно системы уже зарекомендовали себя как эффективные и надежные инструменты геномной инженерии. Данный обзор в основном посвящен применению указанных систем для редактирования геномов основных модельных объектов современной биологии, а также для функционального скрининга геномов, создания клеточных моделей наследственных заболеваний человека, изучения эпигеномов и визуализации клеточных процессов. Кроме того, рассмотрены основные методы конструирования подобных систем, проанализировано их действие, обсуждаются некоторые проблемы, которые ожидают сследователей при применении этих инструментов редактирования геномов.
Журнал: Acta Naturae, выпуск: № 3 (22) / том 6 / 2014
Редактирование генома CRISPR
Система CRISPR-Cas с точки зрения редактирование генома более простая и надежная. Главное только правильно синтезировать то, что укажет, в каком месте надо совершить разрез ДНК. Дальше запустится механизм восстановления и все сделается практически само собой. Тем более, если сделать много таких разрезов, то можно запрограммировать нужные изменения достаточно крупного участка ДНК.
Можно даже убирать целые участки ДНК, если это потребуется. При этом, на место удаленных фрагментов будут встроены те участки, которые будут нужны генетикам. Это позволит редактировать ”сломанные” последовательности, которые приводят к тяжелым заболеваниям. В теории надо будет просто заменить нужный фрагмент и все должно стать нормально.
Сами понимаете, что первым вопросом будет ”а можно ли встроить нужную часть кода?” Конечно, со временем и это станет возможно. Вот тогда и могут начать получаться целые новые народы. Но, скорее всего, дело ограничится небольшой группой узких специалистов, вроде людей, которые смогут выдержать полеты к другим планетам, или солдат, которые не будут уставать. Люди найдут, как извлечь из этого выгоду. Особенно правительства и инвесторы, которые вкладывают в разработки огромные деньги. И далеко не все из них делают это, чтобы избавить человечество от болезней. Увы, но реальность такова.
Генная инженерия
Сейчас все большее количество правительств разных стран готовится к тому, чтобы разрешить эксперименты по редактированию генома на эмбрионах человека. Некоторые страны уже даже разрешили это, например, Великобритания.
Справедливости ради, пока мы не говорим о полностью готовом человеке с измененными генами, но все к этому идет. Вы же понимаете? Пока Великобритания разрешает ставить эксперименты только над эмбрионами, выращенными в лабораторных условиях. При этом они обязательно должны быть уничтожены через 14 дней после начала эксперимента. То есть формально нам это ничем не угрожает. Вопрос только в том, для чего это нужно тому, кто это разрешил. Явно не из любопытства. Что-то подсказывает, что как и многие передовые разработки, сначала это будет применяться в военных целях, ведь именно так можно получить универсального солдата. Он не будет хотеть есть или пить. Он не будет уставать или бояться взрывов. Небольшая корректировка генов и супер-солдат готов.
Более того! Такой способ воздействия, если человечество ему научится, может выйти из-под контроля. Или просто ”не в тех руках” это может стать оружием геноцида. Как видим, мрачных последствий куда больше, чем радужных. Поэтому прежде, чем делать что-то подобное, надо основательно взвесить все за и против. Даже клонирование на фоне этого может показаться милой забавой. Хотя изначально все были против этого.
Может не надо это трогать?
Но может все же что-то положительное в этом есть и можно дать шанс ученым доказать, что они не зря открывали инструменты редактирования? Какие преимущества редактирование генов может принести человеку?
Технология редактирования генома и возможности ее применения в клеточной нейробиологии
Авторы: ВЕТЧИНОВА А.С. КОНОВАЛОВА Е.В., ЛУНЕВ Е.А., ИЛЛАРИОШКИН С.Н.
Аннотация
В настоящее время благодаря серии фундаментальных открытий в клеточной и молекулярной биологии появилось несколько высокотехнологичных подходов к моделированию неврологических (в первую очередь нейродегенеративных) заболеваний человека. Среди них направленное геномное редактирование с помощью искусственных нуклеазных систем (CRISPR/CAS9и др.), позволяющее осуществлять высокоспецифичное исправление генетических дефектов на уровне клеток. Особенно перспективным представляется применение технологии геномного редактирования на специализированных нейронах и индуцированных плюрипотентных стволовых клетках (ИПСК), получаемых из фибробластов больных с наследственными формами нейродегенерации в результате клеточного репрограммирования. В статье проводится краткий анализ систем программируемых нуклеаз, рассматриваются механизмы их работы, преимущества, недостатки и возможности применения в моделировании и коррекции нейродегенеративных заболеваний. Обобщен собственный опыт в клеточном моделировании PARK2формы болезни Паркинсона на культуре дофаминергических нейронов, дифференцированных из ИПСК. Представлены предварительные данные, связанные с возможностью редактирования генома клеток в мутантных сайтах PARK2.
Журнал: Анналы клинической и экспериментальной неврологии, выпуск: № 4 / том 9 / 2015
Технология процесса
«Мы разрезали его ДНК, вставили туда ген и сшили обратно. Теперь этот ген стал частью ДНК на всю оставшуюся жизнь», — в двух словах пояснил суть операции доктор Сэнди Макрай.
С помощью специальных вирусов учёные доставили в организм больного миллиарды «правильных» копий гена. Эта технология редактирования отличается большой точностью. В основе метода лежат белки нуклеазы (то есть режущие ДНК) с «цинковыми пальцами». Участок, называемый «цинковым пальцем», может быть спроектирован так, чтобы узнавать определённую последовательность в ДНК, а нуклеаза, как ножницы, аккуратно делает разрез в нужном месте.

Учёные и раньше обращались к этому методу. Так, несколько лет назад медики использовали «цинковые пальцы», чтоб вылечить людей, страдающих ВИЧ. Исследователи собрали клетки крови у двенадцати ВИЧ-инфицированных пациентов. Затем использовали «цинковые пальцы», чтобы редактировать мутированный ген в этих клетках. В процессе терапии специалисты разрушили ген в 25% культивированных клеток каждого участника. Затем вернули культивированные клетки крови в организм пациентов. После такой «трансплантации» у всех пациентов повысились в крови уровни Т-клеток, играющих важную роль в иммунном ответе. ВИЧ-клетки стали расти гораздо медленнее, чем раньше.
Также по теме

«Сухая кровь»: революционное открытие российских учёных
Учёные из Обнинска разработали препарат ПАМ-3 — сухой кровезаменитель. Он может применяться при большой кровопотере. ПАМ-3 заменяет…
В новом исследовании учёные впервые обратились к «цинковым пальцам», чтобы отредактировать геном непосредственно в организме человека. Учёные вставили правильную копию гена и два «цинковых пальца» в безобидный вирус, у которого предварительно вырезали его опасную для организма часть. Миллиарды таких копий ввели в вену пациента, чтобы они достигли печени. Чтобы вылечить больного, достаточно исправить геном хотя бы 1% клеток печени.
Технология, которую использовали авторы исследования, отличается от ставшего популярным в последнее время метода редактирования генома с помощью системы CRISPR/Cas9 — комплекса из белков и РНК. В основе CRISPR/Cas9 — система иммунитета бактерий, которую те используют для борьбы с вирусами. Так, в августе 2017 года с помощью CRISPR американские учёные впервые редактировали геном человеческого эмбриона. По заявлению медиков, им удалось исправить мутацию в геноме плода. Однако родится ли ребёнок здоровым, пока неизвестно.
Применение генной инженерии в промышленности
Более того, можно смело говорить о том, что генное модифицирование уже применяется на практике для достижения определенных результатов. Я говорю о генно-модифицированных организмах — ГМО.
Самым простым примером, как для понимания преимуществ метода, так и для самих генетиков является создание модифицированных кисломолочных бактерий. Дело в том, что когда на производстве вирусы бактериофаги попадают в закваску, они уничтожают культуру полезных микроорганизмов. В итоге это приводит к тому, что партия оказывается испорченной, а производитель несет огромные убытки. Именно поэтому устойчивые к бактериофагам микроорганизмы решают массу проблем.
Если бактериофаги попадают на производство, пропадают просто огромные объемы продукции.
«Редакторы» геномов. От цинковых пальцев до CRISPR
Авторы: Власов Валентин Викторович, Медведев Сергей Петрович, Закиян Сурен Минасович
Аннотация
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений Но чтобы успешно вторгаться в «святая святых» клетки — ее наследственный материал, необходимы технологии, позволяющие расщеплять и соединять молекулы ДНК в заданных участках. Поистине революционный прорыв в этой области произошел всего несколько лет назад, когда на основе механизмов «бактериального иммунитета» был разработан простой метод генетической инженерии CRISPR/Cas, обеспечивающий точное воздействие на заданные участки ДНК. Этот метод открыл принципиально новые возможности для манипуляций на уровне генома высших организмов, позволяя вносить точечные мутации, исправлять, встраивать или удалять фрагменты и даже целые гены.
Журнал: Наука из первых рук, выпуск: № 2 (56) / 2014
Несчастье помогло
Прижился ли новый ген у Мэддокса, можно будет сказать не раньше, чем через месяц. Сам пациент понимает, что терапия может не сработать. Более того, в его возрасте многие произошедшие в организме изменения уже необратимы. Однако и он, и лечащие его врачи надеются, что такой опыт будет полезен другим больным. При положительных результатах операции Мэддоксу не нужно будет каждую неделю получать инъекции дорогостоящего искусственного фермента и опасаться за свою жизнь в случае обычной простуды. Кроме того, вероятно, одно из главных событий в жизни Мэддокса уже произошло: во время терапии он познакомился с медсестрой, которая стала его невестой.
В случае успеха операции учёные планируют испытать метод ещё на 30 взрослых пациентах и перейти к редактированию геномов детей, чтобы успеть помочь им до того, как болезнь навредит организму.
Модификация метода анализа результатов редактирования генома с помощью системы CRISPR/CAS9 на предимплантационных эмбрионах мыши
Авторы: Димитриева Т.В., Решетов Д.А., Жерновков В.Е., Влодавец Д.В., Зотова Е.Д., Ермолкевич Т.Г., Дейкин А.В.
Аннотация
Генно-модифицированные животные важный инструмент биомедицинских исследований. Для их получения все чаще используют систему редактирования генома CRISPR/Cas9. С помощью микроинъекции комплекс РНК-гида и белка Cas9 доставляется в оплодотворенную яйцеклетку, из которой впоследствии развивается животное с модификацией в геноме. Как правило, анализ специфичности и эффективности системы в каждом случае проводят после получения потомства с вероятной мутацией. Однако анализ на предимплантационной стадии позволил бы сократить время эксперимента, а также понять причину рождения малого числа или даже отсутствия трансгенных особей в потомстве. В статье предложена модификация метода подготовки тотальной ДНК из бластоцист мыши, позволяющая проще и быстрее детектировать результаты микроинъекций комплекса CRISPR/Cas9 в зиготу. Применив описанный в статье метод, мы успешно идентифицировали короткие делеции в интроне 34 гена дистрофина (DMD) в 12 из 13 обработанных эмбрионов и вставку по месту разрыва в интроне 8 гена DMD в 11 из 21 проанализированных образцов. Используя приготовленную предложенным способом тотальную ДНК, можно анализировать до 20 различных сайтов в геноме мышиного эмбриона на стадии бластоцисты, не прибегая к полногеномной амплификации.
Журнал: Вестник Российского государственного медицинского университета, выпуск: № 3 /2016
Стоит ли запретить генетические исследования
Конечно, сейчас нельзя говорить о том, что уже завтра мы рискуем получить нежелательные последствия редактирования генома. Во-первых, исследования еще только ведутся и чего-то действительно серьезного не сделали. Во-вторых, даже когда начнется массовое применение технологий на людях, понять истинные последствия можно будет только через несколько поколений. К сожалению, такое положение дел может расслабить некоторых ученых, ведь по сути у них не будет никакой ответственности. Впрочем, это вряд ли, но вероятность этого все равно есть.
Главное не вестись на кажущуюся легкость редактирования генов. Неизвестно, во что потом это выльется.
Пока ученые с осторожность прогнозируют вероятность внесения таких изменений в геном человека, которые сделают из него кого-то другого, но в перспективе это все равно возможно. Если даже в этом не поможет CRISPR, найдется другой способ, но он будет
Тут уже можно поднимать вопросы этичности того, что одни люди изначально будут от рождения лучше других. Кроме этого, возникают вопросы, насколько это корректно — вмешиваться в геном человека без его ведома. Может быть, когда из модифицированного появится человек, который отличается от остальных, он сам будет не рад этому. Одно дело, когда у него от природы определенный цвет волос, разрез глаз и форма ушей, а другое — когда за него кто-то решил, каким он должен быть. Вот еще одна дилемма будущего. А решать, стоит ли запрещать редактирование генома, вам. Каждый имеет свое мнение, которым можно и нужно поделиться в нашем Telegram-чате.
Защита от вирусов на уровне ДНК
В основе редактирования генов и понимания того, зачем это вообще нужно, стояли исследования бактерий, которые показали, как они вырабатывали защиту от бактериофагов. Ученых особенно интересовало, как эта защита влияет на цепочки ДНК и при этом переносится на новые поколения бактерий.
Более того, определенные признаки изменения генов нашли изначально у бактерии кишечной палочки. Ученые заметили определенные повторяющиеся фрагменты, которые были разделены спейсерами, но тогда объяснить этого не смогли. Позже подобную структуру-кассету нашли и у других представителей прокариот. Тогда им и дали сокращенное название CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats). В переводе на русский это может звучать, как КППРРГ (короткие палиндромные повторы, регулярно расположенные группами). Такое сокращение выглядит просто ужасно и проще пользоваться емким словом CRISPR.
Позже выяснилось, что те самые спейсеры очень похожи на куски ДНК вирусов-бактериофагов и являются частью защитного механизма бактерий, выработанного в ходе эволюции. Ученые предложили механизм, при котором белок Cas, ассоциированный с CRISPR, позволяет находить чужеродную ДНК, когда вирус попадает в клетку бактерии. Если ДНК вируса соответствует информации, которая есть у бактерии, то в этом случае чужая ДНК разрезается и заражение предотвращается.
Бактериофаги не просто живут за счет бактерий, но и размножаются в них.
Ученые провели ряд экспериментов, в ходе которых меняли геном бактерий и наблюдали, как на них воздействуют другие бактериофаги. Результаты доказали, что механизм работает именно так, как они думали. Также они подтвердили, что когда бактерия сталкивается с новым для себя вирусом, она может вырезать часть его ДНК и вставлять их в свою CRISPR-кассету. После чего эти ”записи” передаются потомкам.
Генно-клеточная терапия наследственных заболеваний мышечной системы: современное состояние вопроса
Авторы: Деев Р.В., Мавликеев М.О., Бозо И.Я., Пулин А.А., Еремин И.И.
Аннотация
Генетические заболевания, приводящие к первичному поражению скелетной мышечной ткани, могут быть обусловлены дисфункцией более чем 30 генов. Сегодня не существует эффективных способов их этиотропного и патогенетического лечения. Исследователи сосредотачивают свои усилия на поиске новых терапевтических средств, относящихся к генным и клеточным технологиям, а также использованию малых молекул. В мире проведен большой пул доклинических исследований, а также выполнены несколько десятков клинических исследований. К сожалению, испытанные технологии пока не привели к существенному прогрессу в лечении пациентов с данными заболеваниями. Вместе с тем, полученные данные позволяют определить наиболее целесообразные направления дальнейших разработок – совмещение методик коррекции генома с клеточной доставкой исправленного генома в скелетную мышечную ткань. Настоящий обзор призван дать общие представления об этиологии генетических заболеваний мышц скелета, основных направлениях биотехнологических разработок и результатах выполненных клинических исследований.
Журнал: Гены и клетки, выпуск: № 4 / том 9 / 2014
Ретровирусные инфекции
Относительно недавно я уже рассказывал о том, как мы все являемся носителями ретровирусов или, как их еще называют, реликтовых вирусов. В том числе к ним относится и ВИЧ, который миллионы лет назад встроил свой геном в наши ДНК и мы продолжаем передавать его из поколения в поколение.
В журнале Scientific Reports даже была опубликована работа, которая показывает, как при помощи CRISPR-Cas9 можно избавиться от этого наследства и даже ликвидировать возможность повторного встраивания вируса в ДНК.
Китайские ученые даже проводили эксперименты в этом направлении и обеспечили рождение двух генно-модифицированных человек. Ими стали девочки близнецы, один из родителей которых был ВИЧ-положительным. В итоге, они родились с устойчивым иммунитетом к вирусу. Проблема в том, что эксперимент был за гранью законности, но в целом все получилось.
Также в другой работе, опубликованной в Nature Biotechnology, доказывается, что при помощи модифицированного белка Cas9 можно отключать гены, которые мешают нормальному перерождению клеток и приводят к злокачественным образованиям. То есть потенциально это может стать долгожданным лекарством от рака. Вот только не привело бы такое вмешательство к тому, что воспроизводство новых клеток станет еще хуже.
Альтернативные модели регулирования
В марте 2019 г. 17 ученых из 7 стран предложили создать международную систему регулирования, первым этапом которой должен стать пятилетний добровольный мораторий на клиническое применение редактирования генома человека. В рамках такой системы предусматривалось бы создание международного органа (при ВОЗ либо независимого), который осуществлял бы мониторинг за положением дел в данной области. Вместе с тем авторы не подразумевают заключения юридически обязывающего международного договора, который, по их мнению, был бы слишком жестким механизмом. Их модель предусматривает, что по истечении срока моратория, каждая страна, после определенных международных консультаций, сможет выбрать свой собственный подход к регулированию — от разрешения редактирования генома даже для усовершенствования способностей человека, вплоть до полного его запрета.
Вместе с тем большая группа специалистов считает, что в первую очередь необходима максимально широкая дискуссия на глобальном уровне о самых базовых этико-культурных вопросах, связанных с редактированием генома человека. Для содействия такой дискуссии предлагается создать «Глобальную обсерваторию», которая выполняла бы три задачи: 1) собирать информацию об этических оценках редактирования генома и о политических мерах, принимаемых для его регулирования в разных странах; 2) выявлять точки разногласий и консенсуса; 3) служить форумом для периодических обсуждений. Этот подход подразумевает, что пока не достигнут минимальный консенсус, может быть необходимо временно замедлить либо приостановить исследования по наследуемому редактированию генома.
Наконец, специалист по биоэтике Р. Альта Чаро предлагает в качестве альтернативы мораторию так называемый «экосистемный» подход. В рамках этого подхода широкий спектр уже существующих правовых инструментов — от патентного права до законодательства, регулирующего исследования на эмбрионах — может использоваться для контроля за развитием наследуемого редактирования генома. Задача регулирования и контроля ложится на плечи широкого круга уже существующих акторов — национальных регуляторных агентств (например, FDA в США), комитетов по контролю за исследованиями, фондов, финансирующих исследования. В качестве элемента общей «экосистемы» регулирования выступает и саморегулирование научного сообщества. Возможно, хотя и не обязательно, создание консультативного международного органа, который бы предоставлял техническую экспертизу и служил форумом для дискуссий.
Показательной для понимания того, какие из предложений научного сообщества с большей вероятностью будут претворены в жизнь, является работа «Экспертного консультативного комитета ВОЗ по разработке глобальных стандартов управления и надзора за редактированием генома человека», первое заседание которого состоялось 18–19 марта 2019 г. Комитет подтвердил своё согласие с ранее высказывавшимися взглядами о безответственности клинического применения наследуемого редактирования генома на данном этапе, однако не поддержал формулировку «моратория». Первой практической рекомендацией комитета стало создание международного реестра исследований по редактированию генома человека на базе ВОЗ. Комитет призвал всех учёных, проводящих соответствующие исследования, зарегистрировать их в реестре, как только он будет создан. Доноры средств, согласно рекомендациям комитета, не должны выделять финансирование на исследования, не внесённые в реестр, а научным журналам следует воздерживаться от публикации таких исследований. Данное предложение Комитета является реализацией «экосистемного» подхода, а формулировки доклада о первом заседании дают основания полагать, что и в ходе выработки дальнейших рекомендаций Комитет будет придерживаться данной модели регулирования.
Генетические эксперименты и «дизайнерские» дети: городской завтрак РСМД
«Я ждал этого 15 лет»
44-летний Брайан Мэддокс перенёс первую в мире операцию по редактированию генома непосредственно в организме. Этот эксперимент провела исследовательская группа калифорнийской детской больницы UCSF Benioff Children’s Hospital Oakland, уже несколько лет изучающая возможности технологии генного редактирования. Наблюдавшийся у них пациент страдал от редкого генетического заболевания, связанного с X-хромосомой.
Также по теме
Полтора часа жизни: как начиналось создание искусственного сердца
В марте 1952 года врачам одной из американских клиник удалось поддерживать жизнь пациента при помощи искусственного сердца в течение…
Болезнь наследуется рецессивно, то есть дефектный ген был у обоих родителей Мэддокса. В клетках печени пациента не синтезировался один из ферментов (идуронат-2-сульфатаза), из-за чего нарушилось расщепление гликозаминогликанов — веществ, связывающих клетки в тканях. В результате эти вещества накапливались в организме в большом количестве, и от этого страдали различные органы и ткани.
Признаки болезни проявились у Мэддокса уже на втором году жизни: искажённые черты лица, укрупнённая голова. Болезнь поразила нервную систему и дыхательные пути. Синдром Хантера считается неизлечимой болезнью. Медики борются с симптомами, облегчают страдания пациентов при помощи регулярного вливания искусственного аналога необходимого фермента или трансплантации костного мозга. Лечение с помощью искусственного фермента облегчает далеко не все симптомы и к тому же обходится довольно дорого (около $100 тыс. в год).
Мэддоксу пришлось перенести 26 операций по удалению грыж, прорастаний кости в спинной мозг, а также хирургических вмешательств на глазах, ушах и желчном пузыре.
Брайан согласился стать первым пациентом в мире, редактирование генов которого проводили непосредственно в теле, а не в клетках, выращенных отдельно или просто предварительно извлечённых из организма.