Вторая мировая и ядерное оружие
Когда в Германии ко власти пришёл Гитлер, многие учёные бежали из страны. Вместе с братом Бор помогал им обустроиться в Копенгагене. Под угрозой оказался и сам физик, ведь его мать имела еврейские корни. Но он решил оставаться в городе до последнего и защищать свой институт.
В 1941 у него состоялась встреча с Вернером Гейзенбергом, этот физик в то время сотрудничал в нацистской Германией по вопросам разработки ядерного оружия. Но Бор помогать не согласился .
В 1943 они вместе с сыном бежали в США, где до конца войны жили под другими именами и разрабатывали атомную бомбу.
Уже работая над проектом, он осознал опасность такого оружия, поэтому написал не одно письмо Черчиллю и Рузвельту, чтобы те с осторожностью относились к атомной энергии. Разработкой Бора заинтересовалась и другая сторона — СССР, его даже приглашали приехать туда для обмена опытом, что в США расценили как попытку шпионажа
Последние годы физик провёл, выступая с лекциями и в написании философских статей
Своё самое важное, как он считал, открытие — принцип дополнительности, он хотел применить в различных сферах: биологии, психологии и культуре
Умер в возрасте 77 лет от сердечного приступа. Прах Бора находится в Копенгагене в семейной могиле.
Загадки спектральных формул
У классической физики также имелись нерешенные проблемы с более почтенной историей, нежели радиоактивность и стабильность атома. К ним, в общем-то, привыкли и не считали чем-то катастрофическим, но они от этого не исчезали. Одна из них возникла в ходе развития спектроскопии. Еще в начале XIX века в спектре натрия были замечены яркие желтые линии. Позже множество отдельных линий нашли и в спектрах других веществ. Такую дискретность излучений классическая физика опять-таки не объясняла (если не считать отдельных экзотических гипотез, которые мало кто принимал всерьез).
Особенно ярко эта проблема высветилась в середине XIX века, когда швед Андерс Ангстрем (Anders Jonas Angstrom) и немец Юлиус Плюккер (Julius Plucker) с очень высокой для своего времени точностью измерили длины волн всех четырех линий водородного спектра, лежащих в оптическом диапазоне (то есть в видимом свете). Их результаты буквально заворожили Иоганна Бальмера (Johann Jakob Balmer), преподавателя физики в базельской женской гимназии и приват-доцента тамошнего университета. После многолетних поисков он подобрал формулу (см. также Balmer series), которой подчинялась эта четверка чисел. Она была очень простой, но для тогдашней физики несколько странноватой. Единственной переменной там служил квадрат целого числа m, большего двух. При подстановке значений m, равных 3, 4, 5 и 6, формула непонятно почему выдавала длины волн линий, измеренных Ангстремом и Плюккером. И чудеса на этом не закончились. Знакомый профессор физики сообщил Бальмеру, что астрономы промерили еще десяток водородных линий, лежащих в ультрафиолетовой части спектра. Их длины волн послушно встали в строй — им соответствовали значения m в диапазоне от 7 до 16.
Бальмер опубликовал свои результаты в 1885 году (к слову, в том же году родился Бор). Вскоре было показано, что его формулу нетрудно обобщить, если ее записать не для длин волн, а для частот. Тогда она выглядит как ω=R(1/n12–1/n22), где n1 и n2 — целые числа, причем второе больше первого, ω — частота излучения, а константа R имеет размерность 1/сек. Это соотношение называют формулой Ридберга (см. также Rydberg formula) (иногда Бальмера–Ридберга), а R — постоянной Ридберга (Rydberg constant). Частоты линий видимого спектра, вычисленные самим Бальмером, получаются из нее при n1 = 2, и n2 от 3 до 16. При n1=1 она рождает частоты линий ультрафиолетового диапазона, выявленные в 1906–14 годах американским спектроскопистом Теодором Лайманом (Theodore Lyman). При n1=3 формула выдает линии инфракрасного спектра водорода, которые в 1908 году открыл профессор Тюбингенского университета Фридрих Пашен (Louis Karl Heinrich Friedrich Paschen). Известны также спектральные серии водорода (см. также Hydrogen spectral series), соответствующие еще большим значениям n1, которые тоже прекрасно описываются формулой Ридберга.
К началу прошлого века эта формула вошла в учебники на правах чисто эмпирической зависимости. Ее объяснение стало ключевым успехом модели Бора.
6.2. Квантовые постулаты Бора window.top.document.title = «6.2. Квантовые постулаты Бора»;
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 6.2.1).
| Рисунок 6.2.1.Неустойчивость классического атома |
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра, т. е. происходит ионизация. Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
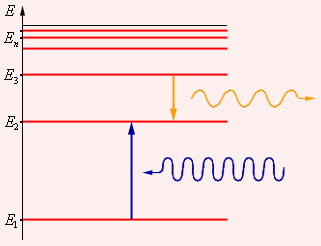 |
| Рисунок 6.2.2.Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов |
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
h
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
 |
|
Модель. Постулаты Бора |
Книги (3)
Избранные научные труды. В двух томах. Том 1. Статьи 1909-1925Раздел библиотеки: Физика
Научное наследие датского ученого Нильса Бора содержит более ста статей по различным вопросам физики.
Настоящее двухтомное издание представляет собой первое собрание избранных научных трудов знаменитого ученого.
В первый том включены все основные работы Бора до 1925 г., т.е. до возникновения квантовой механики. Большинство статей тома посвящено первоначальной квантовой теории атома, прежде всего теории спектра атома водорода, теории периодической системы элементов, влиянию электрических и магнитных полей на спектральные линии, теории излучения.
Читать »
Избранные научные труды. В двух томах. Том 2. Статьи 1925-1961Раздел библиотеки: Физика
Во втором томе помещены работы Нильса Бора, опубликованные после 1925 г. Они охватывают в основном вопросы квантовой механики, квантовой электродинамики и теории атомного ядра. Кроме того, в том вошел ряд статей по общим вопросам современного естествознания, по истории физики и несколько очерков о выдающихся физиках — современниках Бора. В совокупности публикуемые работы в достаточно полной мере характеризуют научное творчество выдающегося датского ученого после создания квантовой механики.
Как и в первом томе, краткие комментарии имеют в основном исторический и библиографический характер (составители М.Э. Омельяновский, У.И. Франкфурт, А.М. Френк, С.И. Ларин, А.Я. Ильин).
Читать »
 Три статьи о спектрах и строении атомовРаздел библиотеки: Физика
Три статьи о спектрах и строении атомовРаздел библиотеки: Физика
Первоначальная гипотеза квантов Планка получила свое дальнейшее развитие, главным образом в замечательных работах датского физика Н. Бора.
Предлагаемый читателю перевод книги Бора содержит подробное изложение развития теории автора с 1913 г. по сие время. Необходимо указать на некоторое своеобразие характера этой книги.
В первой статье излагается начальное состояние теории она опирается на ряд мемуаров, появившихся в специальных журналах, и вполне популярна.
Главным предметом второй статьи служит загадочный эмпирический принцип соответствия между законами квантов и классическими принципами. Статья также является обзором содержания уже напечатанных работ автора, но содержит кроме того значительный новый материал.
Наконец, третья статья заключает в себе, главным образом, изложение новой теории периодической системы элементов. Эта статья является уже оригинальным мемуаром, в котором впервые излагается названная теория. Вопрос находится в самой бурной стадии развития, некоторые основные пункты и частности безусловно спорны и уже оказались неверными. Потому не-избежными явились дополнения, которые пришлось внести, учитывая новые опытные результаты и разлитие теории за время от выхода оригинала до появления перевода. Дополнения не претендуют на полноту и являются довольно случайными. Текст книги переведен полностью, без всяких изменений названные дополнения помещены отдельно.
Таким образом настоящая книга предназначена не только для довольно широкого круга физически образованных читателей, но и для специалистов, работающих в данной области. Книга написана достаточно популярно, однако требует самого внимательного чтения, так как автор иногда весьма лаконичен.
Читать »
Добавить отзыв
Возвращение домой и смерть
В конце Второй мировой войны Бор вернулся в Копенгаген, где он снова стал директором Северного института теоретической физики и всегда выступал за применение атомной энергии с полезными целями, всегда добиваясь эффективности в различных процессах.
Эта склонность объясняется тем фактом, что Бор осознавал огромный ущерб, который может нанести то, что он обнаружил, и в то же время он знал, что у этого типа мощной энергии есть более конструктивное применение. Итак, с 1950-х годов Нильс Бор посвятил себя чтению лекций, посвященных мирному использованию атомной энергии.
Как мы упоминали ранее, Бор не упускал из виду величину атомной энергии, поэтому, помимо защиты ее правильного использования, он также оговорил, что именно правительства должны гарантировать, что эта энергия не используется деструктивно.
Это понятие было введено в 1951 году в манифесте, подписанном более чем сотней известных исследователей и ученых того времени.
Как следствие этого действия и его предыдущей работы в пользу мирного использования атомной энергии, в 1957 году Фонд Форда наградил его премией «Атом для мира», присуждаемой личностям, которые стремились способствовать позитивному использованию этого типа энергии.
Нильс Бор умер 18 ноября 1962 года в своем родном городе Копенгагене в возрасте 77 лет.
Открытие теоремы Бора-ван Левена
Теорема Бора-ван Левена — это теорема, применяемая в области механики. Эта теорема, впервые разработанная Бором в 1911 году, а затем дополненная ван Левеном, помогла отделить классическую физику от квантовой физики.
Теорема утверждает, что намагниченность, возникающая в результате применения классической механики и статистической механики, всегда будет равна нулю. Бору и ван Леувену удалось получить представление о некоторых концепциях, которые можно было разработать только с помощью квантовой физики.
Сегодня теорема обоих ученых успешно применяется в таких областях, как физика плазмы, электромеханика и электротехника.
Эфир
Последние полтора года шла работа над видеофильмами и сопроводительными текстами по Проблемам египтологии . С дидактической точки зрения видеоформа представляется более удачной, чем форма текстовая; надеемся ее использовать и в дальнейшем. Не доведя египетскую тему до конца (всё ещё не снят важный видеофильм «Эхнатон не был вероотступником»), я переключился на другой большой интернет-проект под названием «Эфир». Последний термин является определяющим, но проект в целом касается не столько проблем мировой среды, сколько истории и методологии физики вообще.
Дело всё в том, что наука об окружающей нас природе постоянно вращалась вокруг вопроса о характере наполнения Вселенной. Модель абсолютной пустоты, в которой пребывают элементарные частицы, атомы, планеты и звезды, во многом исчерпала себя. Однако предлагаемые модели мировой среды столь примитивны, что впору напомнить критикам современной спекулятивной физики те скромные достижения, которые были получены исследователями предшествующих эпох.
На сайте Sceptic-Ratio по общим мировоззренческим темам говорилось немало, в том числе, и по вопросам физической картине мира в Старые и Новые времена. Тем не менее, удалось сказать далеко не всё, что хотелось — это, во-первых, а во-вторых, не была выбрана подходящая точка обзора ранее полученных знаний о материальной среде в противовес абсолютной геометрической пустоте. Сейчас, кажется, удалось занять удачную позицию и выбрать нужный ракурс, которые, наконец, позволят заглянуть не только далеко в прошлое, но и наметить пути ближайшего развития физической науки.
19 сентября 2014 года
1. Эфирный ветер обнаружить нельзя
видео 1 |
текст 1
2. Модель атома Томсона и пылевая плазма
видео 2 |
текст 2
3. Становление физики
видео 3 |
текст 3
4. Учения Декарта и Ньютона
видео 4 |
текст 4
5. Космические вихри
видео 5 |
текст 5
6. Эффект Доплера
видео 6 |
текст 6
7. Искривление пространства не подтвердилось
видео 7 |
текст 7
8. Мир — трехмерен: многомерные миры не существуют
видео 8 |
текст 8
9. Дуализм волны-частицы. Физика Дж. Дж. Томсона
видео 9 |
текст 9
10. Черные дыры и белые пятна нашего познания мира
видео 10 |
текст 10
11. Теория водородных струй Владимира и Николая Лариных
видео 11 |
текст 11
12. Взрыв в Сасово, Патомский кратер и лунный кратер Тихо
видео 12 |
текст 12
13. Космические струи
видео 13 |
текст 13
14. Парадокс штриха (Критика теории относительности)
видео 14 |
текст 14
15. Почему нет пространства Минковского (Критика ТО)
видео 15 |
текст 15
16. Физика Дж. Дж. Томсона
видео 16 |
текст 16
17. Дуализм волны-частицы в понимании В.А. Фока
видео 17 |
текст 17
Бор и Резерфорд
Осенью 1911 Бор приезжает в Кембридж. Ему дали стипендию на 2 500 крон для стажировки за рубежом. Поэтому он выбирает Англию для своих исследований, конкретно — Кавендишскую лабораторию, в которой главным был Нобелевский лауреат по физике сэр Джон Томсон. Но сотрудничество не сложилось. Томсону не понравился Бор, который открыто указывал на просчёты и ошибки маститого физика, к тому же датчанин плохо говорил по-английски. Поэтому, несмотря не гениальность выбранного им наставника, Бору пришлось искать другой университет. И спустя полгода он переезжает в Манчестер, к «отцу» ядерной физики Эрнесту Резерфорду, тоже Нобелевскому лауреату. Вместе они работали над моделями атома и их изменениями в ходе радиоактивного распада. В лице Резерфорда Бор нашёл не только наставника и коллегу, но и очень близкого друга. Когда в 1912 учёный женился, то часть свадебного путешествия они с женой провели в Манчестере, навестив Резерфорда.
В 1913 выходит статья Бора о «Теории торможения заряженных частиц при их прохождении через вещество».
После возвращения в Копенгаген, Бор преподаёт в университете, а также активно работает над квантовой теорией строения атома. Весной 1913 он ещё раз едет в Манчестер — на консультацию с Резерфордом. После выходит его статья «О строении атомов и молекул» в журнале Philosophical Magazine. Её публикуют по частях, растягивают теоретическую часть от июля до декабря. В ней Бор описывает квантовую теорию водородоподобного атома.
Эта работа стала настоящей революцией того времени. Даже годы спустя физики признавали, что исследования Бора были величайшим шагом в изучении атомов и их строения.
Ядерная физика (1930-е годы)
В 1932 году Бор с семьёй переехал в так называемый «Дом чести», резиденцию самого уважаемого гражданина Дании, выстроенную основателем пивоваренной компании «Карлсберг». Здесь его посещали знаменитости не только научного (например, Резерфорд), но и политического мира (королевская чета Дании, английская королева Елизавета, президенты и премьер-министры различных стран).
В 1934 году Бор пережил тяжёлую личную трагедию. Во время плавания на яхте в проливе Каттегат штормовой волной был смыт за борт его старший сын — 19-летний Христиан; обнаружить его так и не удалось. Всего у Нильса и Маргарет было шестеро детей. Один из них, Оге Бор, также стал выдающимся физиком, лауреатом Нобелевской премии (1975).
В 1930-е годы Бор увлёкся ядерной тематикой, переориентировав на неё свой институт: благодаря своей известности и влиянию он сумел добиться выделения финансирования на строительство у себя в Институте новых установок — циклотрона, ускорителя по модели Кокрофта — Уолтона, ускорителя ван де Граафа. Сам он внёс в это время существенный вклад в теорию строения ядра и ядерных реакций.
В 1936 году Бор, исходя из существования недавно наблюдавшихся нейтронных резонансов, сформулировал фундаментальное для ядерной физики представление о характере протекания ядерных реакций: он предположил существование так называемого составного ядра («компаунд-ядра»), то есть возбуждённого состояния ядра с временем жизни порядка времени движения нейтрона через него. Тогда механизм реакций, не ограничивающийся лишь нейтронными реакциями, включает два этапа: 1) образование составного ядра, 2) его распад. При этом две эти стадии протекают независимо друг от друга, что обусловлено равновесным перераспределением энергии между степенями свободы компаунд-ядра. Это позволило применить статистический подход к описанию поведения ядер, что позволило вычислить сечения ряда реакций, а также интерпретировать распад составного ядра в терминах испарения частиц, создав по предложению Якова Френкеля капельную модель ядра.
Однако такая простая картина имеет место лишь при больших расстояниях между резонансами (уровнями ядра), то есть при малых энергиях возбуждения. Как было показано в 1939 году в совместной работе Бора с Рудольфом Пайерлсом и Георгом Плачеком, при перекрытии резонансов компаунд-ядра равновесие в системе не успевает установится и две стадии реакции перестают быть независимыми, то есть характер распада промежуточного ядра определяется процессом его формирования. Развитие теории в этом направлении привело к созданию в 1953 году Виктором Вайскопфом, Германом Фешбахом и К. Портером так называемой «оптической модели ядра», описывающей ядерные реакции в широком диапазоне энергий.
Одновременно с представлением о составном ядре Бор (совместно с Ф. Калькаром) предложил рассматривать коллективные движения частиц в ядрах, противопоставив их картине независимых нуклонов. Такие колебательные моды жидкокапельного типа находят отражение в спектроскопических данных (в частности, в мультипольной структуре ядерного излучения). Идеи о поляризуемости и деформациях ядер были положены в основу обобщённой (коллективной) модели ядра, развитой в начале 1950-х годов Оге Бором, Беном Моттельсоном и Джеймсом Рейнуотером.
Велик вклад Бора в объяснение механизма деления ядер, при котором происходит освобождение огромных количеств энергии. Деление было экспериментально обнаружено в конце 1938 года Отто Ганом и Фрицем Штрассманом и верно истолковано Лизой Мейтнер и Отто Фришем во время рождественских каникул. Бор узнал об их идеях от Фриша, работавшего тогда в Копенгагене, перед самым отъездом в США в январе 1939 года. В Принстоне совместно с Джоном Уилером он развил количественную теорию деления ядер, основываясь на модели составного ядра и представлениях о критической деформации ядра, ведущей к его неустойчивости и распаду. Для некоторых ядер эта критическая величина может быть равна нулю, что выражается в распаде ядра при сколь угодно малых деформациях. Теория позволила получить зависимость сечения деления от энергии, совпадающую с экспериментальной. Кроме того, Бору удалось показать, что деление ядер урана-235 вызывается «медленными» (низкоэнергетичными) нейтронами, а урана-238 — быстрыми.
Проблемы планетарной модели атома
В начале XX в. Дж. Томсон установил, что атом имеет сложное строение. Сам он заряжен положительно, и некоторые силы удерживают в нем отрицательно заряженные электроны (в целом атом получается нейтрален).
Оставался вопрос о распределении положительного заряда по атому. Для его решения Э. Резерфорд в 1906 г. предложил зондирование атома альфа-частицами. Такой опыт был поставлен и дал неожиданный результат. Большинство альфа-частиц беспрепятственно пролетали сквозь атом. И только небольшая часть отклонялись и даже «отскакивали» в противоположном направлении. Это означало, что практически весь положительный заряд атома сосредоточен в компактной области порядка $ {10}^{-15} $м, которую назвали ядром. Э. Резерфорд предположил, что электроны вращаются по орбитам вокруг ядра на расстоянии порядка $ {10}^{-10} $м.
Рис. 1. Планетарная модель атома.
Такая модель атома была названа планетарной, но она входила в противоречие с классической электродинамикой Дж. Максвелла, которая к тому времени была уже многократно проверена и подтверждена.
Дело в том, что, согласно законам электродинамики, известным в 11 классе, заряды, движущиеся с ускорением, должны излучать электромагнитное излучение и при этом терять энергию. Электрон, двигающийся по орбите вокруг ядра, испытывает постоянное центростремительное ускорение, следовательно, он должен излучать электромагнитные волны, терять энергию, приближаться к ядру, и в конце концов за время порядка десятка микросекунд слиться с ним.
Интересные факты
Один из гостей Бора, увидев на дверях его дома прибитую подкову, спросил, неужели учёный может верить в то, что подкова над дверью приносит счастье. Бор с улыбкой ответил:
В нацистской Германии запретили принятие Нобелевской премии. Немецкие физики Макс фон Лауэ и Джеймс Франк доверили хранение золотых медалей Нильсу Бору. Когда в 1940 году немцы оккупировали Копенгаген, Бор растворил эти медали в царской водке. После окончания войны извлек спрятанное в царской водке золото и передал его Шведской королевской академии наук, где изготовили новые медали и повторно вручили.
Embed from Getty ImagesНильс Бор с женой и внуком
На родине Бор был настолько уважаемым человеком, что специально для него пивоваренная компания «Карлсберг» провела в дом трубопровод, по которому круглосуточно и бесплатно поставлялось свежее пиво. Дом Бора всегда был полон гостей.
В 1997 году 107-й элемент таблицы Менделеева получил официальное название борий в честь Нильса Бора. До 1997-го в СССР и России название в честь великого физика — нильсборий — носил 105-й элемент таблицы Менделеева, позже переименованный в дубний.
Молодость. Теорема Бора — ван Лёвен (1885—1911)
В школе Нильс проявлял явную склонность к физике и математике, а также к философии. Этому способствовали регулярные визиты коллег и друзей отца — философа Харальда Гёффдинга, физика Кристиана Кристиансена, лингвиста Вильгельма Томсена. Близким другом и одноклассником Бора в этот период был его троюродный брат (по материнской линии), известный в будущем гештальт-психолог Эдгар Рубин (Edgar John Rubin, 1886—1951; среди предложенных им оптических иллюзий т. н. «ваза Рубина» (1915), англ.). Рубин привлёк Бора к изучению философии.
Другим увлечением Бора был футбол. Нильс и его брат Харальд (впоследствии ставший известным математиком) выступали за любительский клуб «Академиск» (первый — на позиции вратаря, а второй — полузащитника). В дальнейшем Харальд успешно играл в сборной Дании и выиграл в её составе «серебро» на Олимпиаде-1908, где датская команда уступила в финале англичанам.
В 1903 году Нильс Бор поступил в Копенгагенский университет, где изучал физику, химию, астрономию, математику. Вместе с братом он организовал студенческий философский кружок, на котором его участники поочерёдно выступали с докладами. В университете Нильс Бор выполнил свои первые работы по исследованию колебаний струи жидкости для более точного определения величины поверхностного натяжения воды. Теоретическое исследование в 1906 году было отмечено золотой медалью Датского королевского общества. В последующие годы (1907—1909) оно было дополнено экспериментальными результатами, полученными Бором в физиологической лаборатории отца, и опубликовано по представлению корифеев тогдашней физики Рамзая и Рэлея.
В 1910 году Бор получил степень магистра, а в мае 1911 года защитил докторскую диссертацию по классической электронной теории металлов. В своей диссертационной работе Бор, развивая идеи Лоренца, доказал важную теорему классической статистической механики, согласно которой магнитный момент любой совокупности элементарных электрических зарядов, движущихся по законам классической механики в постоянном магнитном поле, в стационарном состоянии равен нулю. В 1919 году эта теорема была независимо переоткрыта Йоханной ван Лёвен и носит название теоремы Бора — ван Лёвен. Из неё непосредственно следует невозможность объяснения магнитных свойств вещества (в частности, диамагнетизма), оставаясь в рамках классической физики. Это, видимо, стало первым столкновением Бора с ограниченностью классического описания, подводившим его к вопросам квантовой теории.
Эксперименты и подтверждение постулатов
В 1914 году немецкие ученые Густав Герц и Джеймс Франк стали авторами экспериментального исследования, подтверждающего существование дискретных энергетических уровней атома. Впоследствии в 1925 году за эту работу они получили Нобелевскую премию. Опыт Франкаи Герца считается классическим случаем подтверждения квантовой теории.
Перед началом исследования учеными был выдвинут тезис, что электроны, которые проходят через пары ртути, передают энергию дискретно и что это сопровождается эмиссией ультрафиолетовой спектральной линии ртути (λ = 254 нм). В последующем эксперименте немецкие ученые использовали лампу, поместив туда каплю ртути, и измеряли критический потенциал ее атомов.
Ход эксперимента
Чтобы определить критические потенциалы возбуждения атомов, Франком и Герцем был использован метод задерживающего потенциала. Чтобы давление насыщенных паров ртути в лампе достигло нужного уровня, прибор поместили внутрь электрической печи и нагрели до необходимой температуры.
Трубка из стекла, откуда откачали воздух, имела катод накал, сетку и электрод. Электроны, вылетая из катода, ускорялись напряжением U в направлении сетки. Они проходили через нее и достигали электрода, внося вклад в ток мишени I, в том случае, когда их кинетическая энергия была достаточной преодоления замедляющего напряжения UСA между сеткой и мишенью.
Имея малую величину, ток в анодной цепи мог быть зарегистрирован только с помощью системы, состоящий из усилителя постоянного тока и вольтметра. Усилитель поднимал величину падения напряжения, а вольтромер эту величину фиксировал. Падение напряжение измерялось в момент прохождения анодного тока по входному сопротивлению усилителя.
Выводы
В соответствии с теорией Бора любой атом ртути может получить лишь вполне определенную энергию при переходе в одно из возбужденных состояний. В связи с этим при наличии в атомах стационарных состояний электроны при столкновении с атомами ртути должны терять энергию дискретно, определенными порциями, равными разности энергии соответствующих стационарных состояний атома.
Из эксперимента можно заключить, что в случае увеличения ускоряющего потенциала до 4,86 В, анодный ток возрастает монотонным образом, его значение достигает максимума (4,86 В), затем следует резкое уменьшение и вновь рост. Впоследствии максимумы можно наблюдать при 2 ⋅ 4, 86 В и 3 ⋅ 4, 86 В.
До тех пор, пока значение разности потенциалов между катодом и сеткой меньше 4,86 В, при встрече атома ртути и электрона происходит только упругое соударение. При \( e\phi\) = 4,86 эВ энергия электрона достигает необходимого уровня, чтобы спровоцировать неупругий удар, вследствие чего электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального состояния в возбужденное.
Электроны, лишившиеся своей кинетической энергии, более не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при
\(e\phi\) = 4,86 эВ. Если значения энергии кратны 4,86, электроны могут испытывать с атомами ртути 2, 3 и более неупругих соударения.
Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями. Наименьшей порцией будет 4,86 эВ. Это минимум, который может быть поглощен атомом ртути в основном энергетическом состоянии. Из этого следует, что тезис Бора о существовании в атомах стационарных состояний выдержала проверку экспериментом.
Атомы ртути, которые при соударении с электронами получили энергию \(\triangle E\), переходят в возбужденное состояние и должны вернуться в основное, излучая при этом, согласно второму постулату Бора, квант света, имея частоту \(\nu = \triangle E /h\).
Произвести вычисление длины волны светового кванта при известном значении \(\triangle E = 4,86\) можно с помощью формулы:
\(\lambda = hc/ \triangle E \approx 255 нм.\)
Так, в опытах обнаружилась правильность теории о том, что атомы ртути, подвергающиеся бомбардировке электронами с энергией 4,86 эВ, являются источником ультрафиолетового излучения с \(\lambda = 255\ нм.\)
Копенгагенская интерпретация
С помощью ученых Макса Борна и Вернера Гейзенберга Нильс Бор разработал эту интерпретацию квантовой механики, которая позволила выяснить некоторые элементы, которые делают механические процессы возможными, а также их различия. Сформулированный в 1927 году, он считается традиционной интерпретацией.
Согласно копенгагенской интерпретации, физические системы не обладают определенными свойствами до того, как они будут подвергнуты измерениям, а квантовая механика способна только предсказывать вероятности, с помощью которых сделанные измерения дадут определенные результаты.
Примеры задач
Задача №1
Вам нужно определить скорость и ускорение электрона на первой боровской орбите, радиус которой можно рассчитать с помощью формулы
\(r_{1} = \frac{ħ^{2}}{a_{э}m_{b}e^{3}}\)
Где me и \(e\) — масса и заряд электрона, а \(k_{э} = 9 ⋅ 10 \frac{H_{2}m^{2}}{Kл^{2}}.\)
В задаче дано:
\(r_{1} = \frac{ħ^{2}}{a_{э}m_{b}e^{3}}\) — формула радиуса первой боровской орбиты;
\(r_{1} = \frac{ħ^{2}}{a_{э}m_{e}e^{3}}\)— коэффициент пропорциональности закона Кулона;
\(m_{b} = 9,1 ⋅ 10^{-31}кг \) — масса электрона;
\(e = 1,6 ⋅ 10^{-19} Кл \) — заряд электрона.
Решение
В формуле радиуса первой боровской орбиты: \(ħ = 1,0546 ⋅ 10^{-34}\) Дж ⋅ с — квантовая постоянная Планка. Радиус окружности, по которому происходит движение, равен:
\(r_{1} = \frac{ħ^{2}}{k_{э}m_{b}e^{2}}\) = \(0,53 ⋅ 10^{-10} м\)
В соответствии с моделью Бора вокруг ядра атома водорода, заряд которого +e, вращается электрон, заряд которого \(-e\) . Вращение происходит за счет силы элекического притяжения электрона к ядру. Эта сила, по закону Кулона, равна:
\(F_{э} = k_{э} ⋅ \frac{b^{2}}{r_1^2} \)
Эта сила в том числе является центростремительной, чему соответствует формула
\(F_{э} = k_{э} ⋅ \frac{b^{2}}{r_1^2} = m_{b} ⋅ a\)
В таком случае ускорение можно определить по формуле
\(a = \frac{k_{э}e^{2}}{m_{e}c_1^2} = \frac{9 ⋅ 10^{-9}(1,6 ⋅ 10^{-19})^{2}}{9,1 ⋅ 10^{-31}(0,53 ⋅ 10^{-10})^{2}} \approx 9 ⋅ 10^{22} \frac{м}{с^{2}}\)
И если центростремительное ускорение равно \(a = \frac{v^{2}}{r_{1}}\), то скорость можно найти следующим образом:
\(v = \sqrt{a ⋅ r_{1}} = \sqrt{9 ⋅ 10^{22} ⋅ 0,53 ⋅ 10^{-10}} \approx 2,185 ⋅ 10^{6} \frac{м}{с}\)
Задача №2Найдем силу электрического тока , который вызывает электрон, двигаясь по первой боровской орбите.
В задаче дано:\( e = 1,6 ⋅ 10^{-19} Кл\) – заряд электрона;
\(r_{1} = 0,53 ⋅ 10^{-10} м\) — радиус орбиты;
\(v \approx 2,2 ⋅ 10^{6} \frac{м}{с}\) — скорость электрона (мы нашли ее в первой задаче).
Если сила тока равна
\(I = \frac{\triangle q}{\triangle t}\)
То в данной задаче\( {\triangle q}= e, {\triangle t} = T\) (период обращения электрона). Период обращения электрона равен:
\(T = \frac{2\pi r_{1}}{v}\)
Таким образом, сила тока, возникающего при движении электрона по орбите радиусом r1 со скоростью v, равна:
\(I = \frac{b}{\frac{2\pi r_{1}}{v}} = \frac{bv}{2\pi r_{1}}\)
Если подставить в эту формулу известные данные, то получим решение: