Атом и субатомные частицы
Материя Вселенной состоит из маленьких частиц, которые называются атомами. Эта концепция была выдвинута греческим математиком и философом Демокритом еще в V веке до нашей эры. С древнегреческого языка слово «атом» переводится как «неделимый». Ввиду технической невозможности проверить, что представляет собой атом, эта гипотеза существовала вплоть до XIX века, когда достижения науки и технологий позволили изучить атом более тщательно. Благодаря изучению атома в конце XIX века было установлено, что он не является элементарной единицей материи и состоит из более мелких частиц, которые были названы субатомными. К этим частицам принято относить электрон, протон и нейтрон, поскольку они образуют атомы всего вещества.
В настоящее время в вопросе изучения элементарных частиц наука продвинулась далеко вперед. Так, было установлено, что даже субатомные частицы тоже имеют свою внутреннюю структуру. Кроме того, существует так называемая антиматерия, образованная атомами, состоящими из античастиц, которые тоже являются субатомными. Тем не менее начало ядерной физики и ядерной истории человечества положило именно открытие электронов, протонов и нейтронов. Кто открыл эти субатомные частицы, рассматривается в этой статье.
3.2. Опыт Резерфорда
Эрнест РЕЗЕРФОРД, Барон Резерфорд Нельсонский I Ernest Rutherford, First Baron Rutherford of Nelson, 1871–1937 Новозеландский физик. Родился в Нельсоне, в семье фермера-ремесленника. Выиграл стипендию для получения образования в Кембриджском университете в Англии. После его окончания получил назначение в канадский университет Мак-Гилл (McGill University), где совместно с Фредериком Содди (Frederick Soddy, 1877–1966) установил основные закономерности явления радиоактивности, за что в 1908 году был удостоен Нобелевской премии по химии. Вскоре ученый перебрался в Манчестерский университет, где под его руководством Ханс Гейгер (Hans Geiger, 1882–1945) изобрел свой знаменитый счетчик Гейгера, занялся исследованиями строения атома и в 1911 году открыл существование атомного ядра. В годы Первой мировой войны занимался разработкой сонаров (акустических радаров) для обнаружения подводных лодок противника. В 1919 году был назначен профессором физики и директором Кавендишской лаборатории Кембриджского университета и в том же году открыл распад ядра в результате бомбардировки тяжелыми частицами высоких энергий. На этом посту Резерфорд оставался до конца жизни, одновременно являясь на протяжении многих лет президентом Королевского научного общества. Похоронен в Вестминстерском аббатстве рядом с Ньютоном, Дарвином и Фарадеем.
3.1. Опыт Томсона
Джозеф Джон ТОМСОН Joseph John Thomson, 1856–1940 Английский физик, более известный просто как Дж. Дж. Томсон. Родился в Читем-Хилле (Cheetham Hill), пригороде Манчестера, в семье букиниста-антиквара. В 1876 году выиграл стипендию на обучение в Кембридже. В 1884-1919 годах — профессор кафедры экспериментальной физики Кембриджского университета и по совместительству — руководитель Кавендишской лаборатории, которая усилиями Томсона превратилась в один из самых известных научно-исследовательских центров мира. Одновременно в 1905-1918 годах — профессор Королевского института в Лондоне. Лауреат Нобелевской премии по физике 1906 года с формулировкой «за исследования прохождения электричества через газы», которая, естественно, включает и открытие электрона. Сын Томсона Джордж Паджет Томсон (George Paget Thomson, 1892-1975) также со временем стал Нобелевским лауреатом по физике — в 1937 году за экспериментальное открытие дифракции электронов на кристаллах.
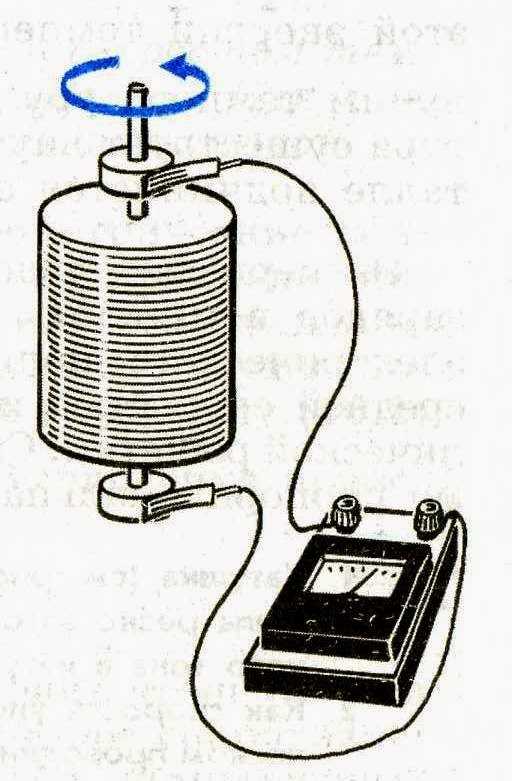
В 1897 году молодой английский физик Дж. Дж. Томсон прославился в веках как первооткрыватель электрона. В своем опыте Томсон использовал усовершенствованную катодно-лучевую трубку, конструкция которой была дополнена электрическими катушками, создававшими (согласно закону Ампера) внутри трубки магнитное поле, и набором параллельных электрических конденсаторных пластин, создававших внутри трубки электрическое поле. Благодаря этому появилась возможность исследовать поведение катодных лучей под воздействием и магнитного, и электрического поля.
Используя трубку новой конструкции, Томсон последовательно показал, что: (1) катодные лучи отклоняются в магнитном поле в отсутствие электрического; (2) катодные лучи отклоняются в электрическом поле в отсутствие магнитного; и (3) при одновременном действии электрического и магнитного полей сбалансированной интенсивности, ориентированных в направлениях, вызывающих по отдельности отклонения в противоположные стороны, катодные лучи распространяются прямолинейно, то есть действие двух полей взаимно уравновешивается.
Томсон выяснил, что соотношение между электрическим и магнитным полями, при котором их действие уравновешивается, зависит от скорости, с которой движутся частицы. Проведя ряд измерений, Томсон смог определить скорость движения катодных лучей. Оказалось, что они движутся значительно медленнее скорости света, из чего следовало, что катодные лучи могут быть только частицами, поскольку любое электромагнитное излучение, включая сам свет, распространяется со скоростью света (см. Спектр электромагнитного излучения). Эти неизвестные частицы. Томсон назвал «корпускулами», но вскоре они стали называться «электронами».
Сразу же стало ясно, что электроны обязаны существовать в составе атомов — иначе, откуда бы они взялись? 30 апреля 1897 года — дата доклада Томсоном полученных им результатов на заседании Лондонского королевского общества — считается днем рождения электрона. И в этот день отошло в прошлое представление о «неделимости» атомов (см. Атомная теория строения вещества). Вкупе с последовавшим через десять с небольшим лет открытием атомного ядра (см. Опыт Резерфорда) открытие электрона заложило основу современной модели атома.
Описанные выше «катодные», а точнее, электронно-лучевые трубки стали простейшими предшественницами современных телевизионных кинескопов и компьютерных мониторов, в которых строго контролируемые количества электронов выбиваются с поверхности раскаленного катода, под воздействием переменных магнитных полей отклоняются под строго заданными углами и бомбардируют фосфоресцирующие ячейки экранов, образуя на них четкое изображение, возникающее в результате фотоэлектрического эффекта, открытие которого также было бы невозможным без нашего знания истинной природы катодных лучей.
Глава I. Предыстория открытия
Открытие электрона явилось результатом многочисленных экспериментов. К началу XX в. существование электрона было установлено в целом ряде независимых экспериментов. Но, несмотря на колоссальный экспериментальный материал, накопленный целыми национальными школами, электрон оставался гипотетической частицей, ибо опыт еще не ответил на ряд фундаментальных вопросов. В действительности «открытие» электрона растянулось более чем на полстолетия и не завершилось в 1897 году; в нем принимало участие множество ученых и изобретателей.
Прежде всего не было ни одного опыта, в котором участвовали бы отдельные электроны. Элементарный заряд вычислялся на основании измерений микроскопического заряда в предположении справедливости ряда гипотез.
Неопределенность была в принципиально важном пункте. Сначала электрон появился как результат атомистического истолкования законов электролиза, затем он был обнаружен в газовом разряде
Было не ясно, имеет ли физика в действительности дело с одним и тем же объектом. Большая группа скептически настроенных естествоиспытателей считала, что элементарный заряд представляет собой статистическое среднее зарядов самой разнообразной величины. Тем более что ни один из опытов по измерению заряда электрона не давал строго повторяющихся значений.Были скептики, которые вообще игнорировали открытие электрона. Академик А.Ф. Иоффе в воспоминаниях о своем учителе В.К. Рентгене писал: «До 1906 — 1907 гг. слово электрон не должно было произноситься в физическом институте Мюнхенского университета. Рентген считал его недоказанной гипотезой, применяемой часто без достаточных оснований и без нужды».
Не был решен вопрос о массе электрона, не доказано, что и на проводниках, и на диэлектриках заряды состоят из электронов. Понятие «электрон» не имело однозначного толкования, ибо эксперимент не раскрыл еще структуры атома (планетарная модель Резерфорда появится в 1911 г., а теория Бора — в 1913г.).
Электрон не вошел еще и в теоретические построения. В электронной теории Лоренца фигурировала непрерывно распределенная плотность заряда. В теории металлической проводимости, развитой Друде, речь шла о дискретных зарядах, но это были произвольные заряды, на значение которых не накладывалось никаких ограничений.
Электрон еще не вышел из рамок «чистой» науки. Напомним, что первая электронная лампа появилась только в 1907 г. Для перехода от веры к убеждению необходимо было прежде всего изолировать электрон, изобрести метод непосредственного и точного измерения элементарного заряда.
Решение этой задачи не заставило себя ждать. В 1752 г была впервые высказана мысль о дискретности электрического заряда Б. Франклином. Экспериментально дискретность зарядов была обоснована законами электролиза, открытыми М. Фарадеем в 1834 г. Числовое значение элементарного заряда ( наименьшего электрического заряда, встречающегося в природе ) было теоретически вычислено на основании законов электролиза с использованием числа Авогадро. Прямое экспериментальное измерение элементарного заряда было выполнено Р. Милликеном в классических опытах, выполненных в 1908 — 1916 гг. Эти опыты дали также неопровержимое доказательство атомизма электричества. Согласно основным представлениям электронной теории заряд какого-либо тела возникает в результате изменения содержащегося в нём количества электронов ( или положительных ионов, величина заряда которых кратна заряду электрона ). Поэтому заряд любого тела должен изменяться скачкообразно и такими порциями, которые содержат целое число зарядов электрона. Установив на опыте дискретный характер изменения электрического заряда, Р. Милликен смог получить подтверждение существования электронов и определить величину заряда одного электрона ( элементарный заряд ) используя метод масляных капель. В основу метода положено изучение движения заряженных капелек масла в однородном электрическом поле известной напряжённости Е .
Классификация частиц
Чтобы упростить себе жизнь, физики сгруппировали все частицы в зависимости от особенностей их строения и прочих характеристик. Классификация бывает по следующим признакам:
- Время жизни.
- Стабильные. В их числе протон и антипротон, электрон и позитрон, фотон, а также гравитон. Существование стабильных частиц не ограничено временем, до тех пор, пока они находятся в свободном состоянии, т.е. не взаимодействуют с чем-либо.
- Нестабильные. Все остальные частицы спустя некоторое время распадаются на свои составные части, потому называются нестабильными. Например, мюон живет всего лишь 2,2 микросекунды, а протон — 2,9•10*29 лет, после чего может распасться на позитрон и нейтральный пион.
- Масса.
- Безмассовые элементарные частицы, которых всего три: фотон, глюон и гравитон.
- Массивные частицы – все остальные.
- Значение спина.
- Целый спин, в т.ч. нулевой, имеют частицы, которые называются бозоны.
- Частицы с полуцелым спином — фермионы.
- Участие во взаимодействиях.
- Адроны (структурные частицы) – субъядерные объекты, что принимают участие во всех четырех типах взаимодействий. Ранее упоминалось, что они складываются с кварков. Адроны делятся на два подтипа: мезоны (целый спин, являются бозонами) и барионы (полуцелый спин — фермионы).
- Фундаментальные (бесструктурные частицы). К ним относятся лептоны, кварки и калибровочные бозоны (читайте ранее – «Стандартная модель..»).
Ознакомившись с классификацией всех частиц, можно, к примеру, точно определить некоторые из них. Так нейтрон является фермионом, адроном, а точнее барионом, и нуклоном, то есть имеет полуцелый спин, состоит из кварков и участвует в 4-х взаимодействиях. Нуклон же – это общее название для протонов и нейтронов.
История открытия первых частиц
О наименьших частицах, составляющих всю материю, было известно еще в древности. Однако, основоположниками так званого «атомизма» принято считать философа Древней Греции Левкиппа и его более известного ученика — Демокрита. Предполагается, что второй и ввел термин «атом». С древнегреческого «atomos» переводится как «неделимый», что определяет взгляды древних философов.
Позднее стало известно, что атом все же можно разделить на два физических объекта – ядро и электрон. Последний впоследствии и стал первой элементарной частицей, когда в 1897-м году англичанин Джозеф Томсон провел эксперимент с катодными лучами и выявил, что они представляют собой поток одинаковых частиц с одинаковыми массой и зарядом.
Параллельно с работами Томсона, занимающийся исследованием рентгеновского излучения Анри Беккерель проводит опыты с ураном и открывает новый вид излучения. В 1898 году французская пара физиков – Мария и Пьер Кюри изучают различные радиоактивные вещества, обнаруживая то же самое радиоактивное излучение. Позже будет установлено, что оно состоит из альфа (2 протона и 2 нейтрона) и бета-частиц (электроны), а Беккерель и Кюри получат Нобелевскую премию. Проводя свои исследования с такими элементами как уран, радий и полоний, Мария Склодовская-Кюри не предпринимала никаких мер безопасности, в том числе не использовала даже перчатки. Как следствие в 1934 году ее настигла лейкемия. В память о достижениях великого ученого, открытый парой Кюри элемент, полоний, был назван в честь родины Марии – Polonia, с латинского – Польша.

Фотография с V Сольвеевского конгресса 1927 год. Попробуйте найди всех ученых из этой статьи на данном фото.
Начиная с 1905-го года, Альберт Эйнштейн посвящает свои публикации несовершенству волновой теории света, постулаты которой расходились с результатами экспериментов. Что впоследствии привело выдающегося физика к идее о «световом кванте» — порции света. Позже, в 1926-м году, он был назван как «фотон», в переводе с греческого «phos» («свет»), американским физиохимиком — Гилбертом Н. Льюисом.
В 1913 году Эрнест Резерфорд, британский физик, основываясь на результатах уже проведенных на то время экспериментов, отметил, что массы ядер многих химических элементов кратны массе ядра водорода. Поэтому он предположил, что ядро водорода является составляющей ядер других элементов. В своем эксперименте Резерфорд облучал альфа-частицами атом азота, который в результате излучил некую частицу, названную Эрнестом как «протон», с др. греческого «протос» (первый, основной). Позже было экспериментально подтверждено, что протон – это ядро водорода.
Очевидно, протон, не единственная составная часть ядер химических элементов. К такой мысли приводит тот факт, что два протона в ядре отталкивались бы, и атом мгновенно распадался. Поэтому Резерфорд выдвинул гипотезу о наличии еще одной частицы, которая имеет массу, равную массе протона, но является незаряженной. Некоторые опыты ученых по взаимодействию радиоактивных и более легких элементов, привели их к открытию еще одного нового излучения. В 1932-м году Джеймс Чедвик определил, что оно состоит из тех самых нейтральных частиц, которые назвал нейтронами.
Таким образом, были открыты наиболее известные частицы: фотон, электрон, протон и нейтрон.
Далее открытия новых субъядерных объектов становились все более частым событием, и на данный момент известно около 350 частиц, которые принято полагать «элементарными». Те из них, которые до сих пор не удалось расщепить, считаются бесструктурными и называются «фундаментальными».
Краткая история открытия протона и нейтрона
Протон является ядром водородного атома. Водород — элемент с максимально простым строением.
Характерные черты протона:
- Имеет положительный заряд.
- Является одной из самых стабильных частиц в мире.
- Образовались во время Большого Взрыва и так и не распались до сих пор.
- Масса протона — 1,6726×10-27 килограмм или же 938,272 МэВ.
- Часто протоны выражают в виде электронвольт.
Именно Резерфордом была выдвинута теория о том, что все атомные ядра у всех химических элементов складываются из протонов, потому что по своей массе все они превышают ядро водородного атома в несколько раз.
Резерфордом был поставлен опыт. В его время было уже известно о естественной радиоактивности некоторого числа химических элементов. При помощи альфа-излучения Резерфорд пытался облучить атомы азота. В конце облучения появлялась частица. Резерфордом была выдвинута мысль о том, что данная частица — протон. В пузырьковой камере Вильсона были проведены еще опыты по выявлению протона. В итоге предположение Резерфорда подтвердилось.
Резерфорд, рассмотрев свои опыты, нашел в них ошибки. Так была выдвинута еще одна идея — о существовании в ядре еще одной элементарной частицы с практически такой же массой, что и у протона. Но в результате экспериментов он не смог ее обнаружить.
Им был поставлен опыт, в ходе которого происходила бомбардировка атомов бериллия сильно заряженными альфа-частицами. В процессе атомной реакции из ядра элемента бериллий вылетела частица, которую потом назвали нейтроном. Через три года после своего опыта Джеймс Чедвик получил Нобелевскую премию.
Масса нейтрона ненамного отличается от индекса массы протона. Масса составляет 1,622×10-27
Однако важной особенностью нейтрона является то, что эта частица абсолютно не обладает никаким зарядом. Нейтрон является нейтральной частицей, но, тем не менее, вызывает деление самых тяжелых ядер
Как раз-таки из-за того, что у нейтрона нет заряда, эта частица обладает способность проходить высокий потенциальный барьер Кулона, а также внедряться в состав ядра. Нейтрон является крайне нестабильной частицей и живет всего 900 секунд. Нейтрон распадается на электрон, протон и нейтрино электронное.
Условное обозначение, характеристики протона и нейтрона
Протон
В физике принято обозначать протон буквой «p». В химии протон обозначается как H+, а в астрофизике как HII.
Немного об особенностях протона:
- Масса протона составляет 1,6726×10-27 килограмм или же 938,272 МэВ. Это в 1800 раз больше, чем масса электрона.
- Спин протона равен 12, на основании этого факта протон можно отнести к фермионам.
- Четность внутренняя протона является положительной.
- В типологии простейших частиц протон занимает место среди адронов.
- Обладает возможностью вступать во все фундаментальные реакции (взаимодействия) — электромагнитное, сильное, гравитационное, слабое.
- Электрический протонный заряд является положительным. Он равен по модулю заряда электрона e=+16022×10-19Кл.
- Не является частицей точечной, имеет уникальную структуру внутреннюю, а также точные размеры.
- На протоне построены такие фундаментальные частицы как глюоны и кварки.
- Величина протона составляет порядка 1 фм.
- Радиус протона — 0,841 фм.
- Протон является стабильной частицей. Большое количество экспериментов с протоном не показало никаких следов его распада.
- Название частицы предложил ее создатель в 1920 году.
Нейтрон
Немного об особенностях нейтрона в физике:
- Масса нейтрона составляет 1,622×10-27, что ненамного превышает массу протона.
- Электрический заряд нейтрона равен нулю. В результате экспериментов было выявлено, что его электрический заряд равен (-,2±,8)×10-21 элементарного электрического заряда.
- Спин нейтрона равен 12. Является фермионом.
Какие бывают элементарные частицы
После открытия электрона ученые ввели в картину мира фотон и остальные бозоны, дополнили список лептонов и открыли кварки.
С каждым витком развития науки люди стремились поделить вещество на мельчайшие части, чтобы понять, как оно устроено. Оказалось, что вся материя, которая нас окружает, похожа на матрешку с четырьмя оболочками:
- то, что мы видим невооруженным глазом;
- молекулярная структура;
- атомная структура;
- элементарный уровень.
Да, их очень много — но так даже интереснее. Со времен открытия электрона ученые обнаружили огромное количество фундаментальных частиц и разделили их на две большие группы: фермионы (от фамилии итальянского физика Энрико Ферми) и бозоны (в честь индийского физика Сатьендры Нат Бозе).
Все частицы Стандартной модели, собранные в подобие системы Менделеева. Справа — бозоны, слева — фермионы
Развитие электронной теории и ее успехи
Электронная теория объяснила также открытое в 1896 г. нидерландским физиком Питером Зееманом (1865–1943) явление расщепления спектральных линий под действием внешнего магнитного поля.
Итак, электронная теория была значительным шагом вперед по сравнению с теорией Максвелла и имела целый ряд важных успехов еще до открытия электрона, существование которого было одним из исходных положений электронной теории. Идеи о строении электричества уже высказывались М. Фарадеем, В. Вебером, Дж. Максвеллом и др.
В 1874 г. ирландский физик Джордж Джонстон Стоней (1826–1911) в докладе «О физическихединицах природы» в Белфасте указал на существование атомарного заряда электричества и, исходя из законов электролиза, впервые рассчитал заряд одновалентного иона.
Аналогичная идея была высказана Г. Гельмгольцем в 1881 г. Наконец в 1891 г. Д. Стоней не только теоретически нашел числовое значение атомарного заряда электричества, но и впервые предложил называть его «электроном».
Большая роль в истории открытия электрона принадлежит исследованиям электрических явлений в разреженных газах.В 1869 г. немецкий физик Йоганн-Вильгельм Гитторф (1824–1914) обнаружил катодные лучи, которые вызвали сильную люминесценцию и смещались под воздействием магнитного поля.
Открытие электронов
Но это было лишь предгрозовое затишье. И гром грянул… Английский ученый Вильям Крукс, изучавший катодные лучи, серией блестящих экспериментов доказал, в 1879 году сложное строение вещества. Под действием электричества из недр атома вылетел его крохотный полпред — электрон. Репутации «неделимого» был нанесен первый чувствительный удар.
В устоявшейся физической картине мира, составленной учеными на протяжении столетий, обнаружились и другие досадные бреши. Французский физик Анри Беккерель установил, что уран посылает из своих глубин таинственные «депеши» — невидимые, обладающие колоссальной проникающей способностью лучи. Атомы некоторых других элементов почему-то исчезали, как бы таяли. Свет вдруг обнаружил свойства, никак не присущие волнам…
Что это означало? Кризис науки? Непознаваемость природы? Нашлись люди, которые сделали именно такой вывод. Яростным нападкам подвергли они атомы. «Их нет вообще!» — твердили они.
В течение многих столетий наука имела дело со сравнительно простыми явлениями, с какими человек сталкивался повседневно, которые он мог наблюдать во всех подробностях. Поэтому нет ничего удивительного в том, что ею были даны вполне разумные, довольно глубокие и логически стройные объяснения таким процессам, как движение тел, доступных осязанию, измерению, взвешиванию, притяжение их Землей, распространение волн в воздухе, на воде и т. д. С этой точки зрения классическая физика непогрешима. Но кто сказал, что ее законы должны быть универсальными? Почему свет должен быть похожим на звук, а атомы — на бильярдные шары? Разве можно сравнивать Солнце, величественное и грандиозное, с вязанкой горящих дров?
Пока ученые с обычной меркой подходили ко всем этим фактам и явлениям, они терпели неудачу за неудачей. Ведь в разных условиях и масштабах физические закономерности неодинаковы. Природа неисчерпаемо многообразна. Она ни когда не повторяет самое себя. В мире бесконечно больших величин и в атоме бесполезно искать дубликаты наших земных понятий и представлений.
Как уже говорилось, опыты Крукса поколебали веру в незыблемость «неделимого». Но скептики не сдавались.
— Может быть, это вовсе не электрон, а «атомы электричества?» — говорили они.
Исследования, проведенные в 1897 году руководителем знаменитой Кавендишской лаборатории английским профессором Джозефом Джоном Томсоном, развеяли последние иллюзии. По предложению Джонстона Стонея первая элементарная частица была названа электроном. А через несколько лет американец Роберт Милликен взвесил его. Масса электрона оказалась ничтожно маленькой и равнялась 910*10-30 грамма. Измерения показали также, что электрон обладает и наименьшим отрицательным электрическим зарядом.
Свободный электрон
Именно поток свободных электронов образует электрический ток. Больше всего не связанных с атомами электронов в металлах, чем и объясняется их высокая электропроводимость.
Впервые предположение о том, что электрический разряд состоит из отдельных частиц, еще в середине XVIII века высказал Бенджамин Франклин (1706-1790)
Сходные идеи в той или иной форме развивались на протяжении всего XIX столетия: так, важной вехой стало открытие Майклом Фарадеем (1791-1867) ионов – переносчиков электрического заряда в растворах солей. Ионы, как сейчас известно, представляют собой атомы с неравным количеством протонов и электронов, но их структура оставалась загадкой вплоть до рубежа веков
Проводя эксперименты с так называемыми «катодными лучами» (отрицательно заряженным излучением, возникающим в разреженном газе), британский физик Джозеф Томсон (1856-1940) обнаружил их дискретную природу. Лучи искривлялись под воздействием магнитных полей, а их скорость была значительно меньше скорости света. Следовательно, лучи – точнее, их составляющие – имели массу, которая при этом составляла лишь тысячные доли от массы любого известного иона. Томсон назвал новые частицы «электронами» (от греческого слова «янтарь»: с древности было известно, что от трения янтарь начинает притягивать мелкие предметы и испускать искры – эффекты, которые в современных терминах объясняются через идею статического электричества). Вскоре они стали важнейшим элементом всех новых моделей атомов.
Чтобы вырваться за пределы атома и стать свободным, электрону требуется некоторое количество энергии, разное для разных элементов. Её электрон может получить, например, за счёт поглощения фотонов света или любого другого электромагнитного излучения.
Другой способ образования свободных электронов – так называемый «бета-минус-распад», то есть превращение нейтрона внутри атомного ядра в протон. В ходе этого процесса из высвобожденных энергии и электрического заряда возникают пучки быстрых электронов и других частиц, антинейтрино.
5 Физика 21 века: Электрон (элементарная частица) — итог
Перед Вами открылся новый мир — мир дипольных полей, о существовании которых физика 20 века и не подозревала. Вы увидели, что у электрона имеются не один, а два электрических заряда (внешний и внутренний) и соответствующие им два электрических радиуса. Вы увидели, что линейные размеры электрона значительно превышают линейные размеры протона. Вы увидели, из чего складывается масса покоя электрона и что воображаемый бозон Хиггса оказался не у дел (решения Нобелевского комитета — это еще не законы природы …). Более того, величина массы зависит от полей, в которых находится электрон. Все это выходит за рамки представлений, господствовавших в физике второй половины двадцатого века. — Физика 21 века — Новая физика переходит на новый уровень познания материи.
Владимир Горунович