Гипоксия вызывает экспрессию PGC-1α в клеточной линии H9c2 и в культивируемых первичных миоцитах сердца
Для дальнейшего изучения механизма, лежащего в основе повышенной экспрессии PGC-1α в миокарде пациентов с TOF, мы определили влияние гипоксии на экспрессию PGC-1α в культивируемых клетках H9c2 и первичных сердечных миоцитах. Как показано на фиг.4А, уровень мРНК PGC-1α в клетках H9c2, культивируемых в условиях гипоксии, увеличился более чем в 3 раза по сравнению с контрольной группой. Увеличение уровней мРНК PGC-1α сопровождалось значительным увеличением уровня белка PGC-1α (фиг. 4B). Эта тенденция была отражена в первичных культурах миоцитов сердца. В условиях гипоксии экспрессия мРНК PGC-1α увеличивалась в 1, 6 раза (фиг.4C), а уровень белка повышался в 2 раза (фиг.4D). Эти результаты показывают, что гипоксия увеличивает экспрессию PGC-1α в миоцитах сердца и, вероятно, способствует повышению уровня PGC-1α в миокарде у пациентов с TOF.
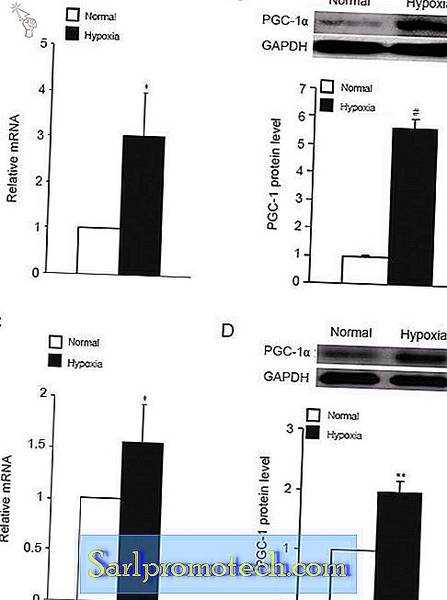
Гипоксия вызывает экспрессию PGC-1α в культивируемых миоцитах сердца. Клетки H9c2 ( A и B ) и первичные миоциты сердца ( C, D ) культивировали в нормальных или гипоксических условиях, и экспрессию PGC-1α определяли с помощью ПЦР в реальном времени ( A, C ) и вестерн-блоттингом с анти-PGC- 1α-антитело по сравнению с анти-GAPDH-антителом ( B, D ). Для вестерн-блотов показан денситометрический анализ PGC-1α. Столбцы представляют среднее значение ± SE ( n = 6). * Р <0, 05, ** Р <0, 01, # Р <0, 001 по сравнению с контролем.
Изображение в полном размере
Увеличение митохондриального числа в ткани сердца пациентов с TOF
TOF является сложным заболеванием сердца с нарушением энергетического обмена, вызванным хронической гипоксией и длительной перегрузкой давлением. Учитывая жизненно важную роль митохондрий в энергетическом обмене, мы исследовали митохондриальную ультраструктуру в мышечной ткани миокарда пациентов с TOF с помощью просвечивающей электронной микроскопии. Митохондриальные срезы миокарда TOF проявляли вакуолярную дегенерацию и разрушение митохондриальных крист. Поразительно, что увеличилось количество митохондрий в миокарде TOF по сравнению с контролем (рис. 1А). Количественная оценка объема митохондрий показала, что миокард пациентов с TOF увеличился в 1, 6 раза по сравнению с контрольной группой (Рисунок 1B, P <0, 05). Измерение содержания митохондриальной ДНК с помощью ПЦР в реальном времени дополнительно подтвердило усиление митохондриального биогенеза в миокарде пациентов с TOF. Как показано на рисунке 1C, относительное медианное число копий мтДНК было в 1, 44 раза выше в миокарде у пациентов с TOF, чем у контрольных субъектов ( P <0, 05).
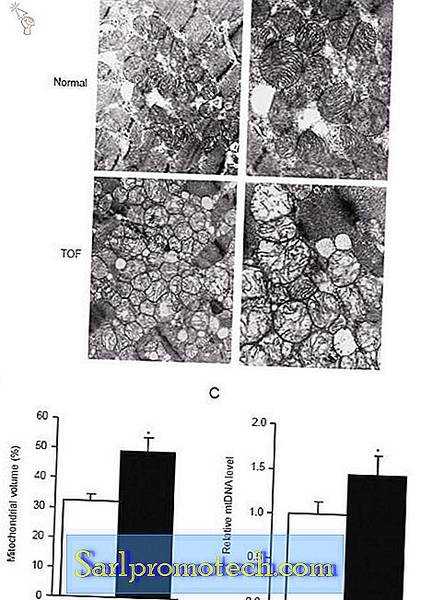
Электронно-микроскопические изображения продольных передних отделов мышцы миокарда контрольных (верхние панели) и TOF (нижние панели) субъектов. Случайно выбранные области были сфотографированы с увеличением 10 000 × (левые панели) или 20 000 × (правые панели) (A) . Показано морфометрическое количественное определение объема митохондрий по 12 контрольным и 17 электронным микрофотографиям TOF (B) . Относительное количество копий митохондрий определяли с помощью ПЦР в реальном времени (C) . * Р <0, 05 по сравнению с контролем.
Изображение в полном размере
Старение – это болезнь
Оказывается, понимание цивилизацией процесса старения человеческого тела и изучение приостановления этого процесса продвигаются быстрее, чем кто-либо из нас ожидал. Некоторые ведущие биологи планеты считают, что мы можем сдерживать течение старения, начиная уже с сегодняшнего дня при помощи современных лекарств, добавок, диет и упражнений. Медицинское сообщество начинает рассматривать процесс старения, как поддающуюся лечению болезнь.
Но в обычном обществе идея о том, чтобы прожить без проблем больше века, все еще воспринимается как абсурд. А библейские истории о долгожителях продолжают восприниматься как сказки. Если вы дожили до 70 или 80 лет, это уже считается удачным стечением обстоятельств. Вы везунчик. А после этого возраста начинается естественный процесс увядания, подогреваемый тяжелой болезнью. С хорошими генами, правильным питанием и достаточно глубокими карманами вы можете достичь 90 лет. А уж дальше вы просто станете героем новостей, который с язвительной ухмылкой будет рассказывать потомкам о делах давно ушедших дней, делиться опытом долгожителя с вековым стажем.
В 110 лет вы просто легенда, миф, строчка в книге рекордов Гиннесса. В 2019 году старейшему в мире человеку Кейну Танаке из Японии исполнилось 116. Текущий мировой рекорд был установлен Джин Калмент, которая умерла в 1997 году в возрасте 122 лет. Хотя один геронтолог выступил с разоблачением, что дочь Калмента тайно заняла ее место во время хаоса Второй мировой войны.
Люди давно одержимы желанием увидеть как можно больше событий будущего. Но самое оптимистичное наше желание связано с дожитием до 100-летнего возраста. Профессор-биолог Дэвид Синклер считает, что к концу столетия дожить до 120 лет будет считаться не таким уж и серьезным результатом, примерно как сейчас до 50-55 лет.
Синклер отмечен наградами не только как ученый, но и как автор книги «Продолжительность жизни: почему мы стареем и почему нам это не нужно». Профессор, который недавно стал знаменитостью благодаря одному из подкастов Джо Рогана, едва ли является первооткрывателем долголетия в нашей цивилизации. В 2004 году изобретатель Рэй Курцвейл начал пропагандировать идею о том, что мы могли бы жить вечно, если бы мы только продержались до середины 2020-х годов. К тому времени продвинутая биотехнология вместе с возможностями искусственного интеллекта возьмет на себя решение проблем старения.
Вскоре Курцвейл стал известен в Силиконовой долине своими гигантскими пакетами витаминов и добавок, которые он принимал несколько раз в день в надежде остаться наедине с сингулярностью. Он любил цитировать исследователя долголетия Обри Де Грэя, который занимается регенеративной медициной и который однажды сделал дикое заявление: «К 2100 году ожидаемая продолжительность жизни будет в районе 5000 лет».
Синклер не такой. Тихий австралиец очень тщательно подбирает слова, он не утверждает, что мы можем жить вечно или увидеть 7100 год. Но считает, что многие из нас должны быть в состоянии преодолеть 122-летний барьер и жить до 150 лет.
В отличие от Курцвейла и де Грея Синклер получил реальное признание в области биологии. Большая часть его наград была получена за выявление механизма старения дрожжей, но он также расширил свои познания в этой области посредством лабораторных мышей. В одном из своих любимых экспериментов гериатрическая мышь бегала без остановки так долго, что сломала лабораторную беговую дорожку, которая была рассчитана на пройденное расстояние в районе 3 километров – ультрамарафон для грызунов.
Поэтому, когда Синклер говорит, что «старение лечить легче, чем рак» и что если мы лечим старение, мы минимизируем вред от рака, стоит его послушать. Первая треть его книги – это обширная история о генетической науке и его «информационная теория старения», в которой в основном говорится о том, что наши клетки разрушаются, потому что делают все более и более плохие аналоговые копии самих себя. Как кассеты, записывающие записи с других кассет.
Сокультивирование с другими типами клеток
Подобно прочим ведущим клеточным элементам тканей и органов, кардиомиоциты составляют далеко не всю массу сердца. Помимо них в сердце присутствует большое число фибробластов, эндотелиальных клеток и т.д. Чтобы получить условия, наиболее близкие к физиологическим, необходимо воссоздать все компоненты микроокружения клеток сердечно-сосудистой системы. В многочисленных исследованиях было показано, что микроокружение и ниша стволовой клетки играет определяющую роль в ее судьбе. Это справедливо и для незрелых кардиомиоцитов. Поэтому добавление даже 1–2 типов клеток к культуре кардиомиоцитов позволяет добиться более быстрого и полного созревания .
В исследовании Абекасиса с соавт. индуцированные плюрипотентные кардиомиоциты культивировали совместно с мезенхимными стволовыми клетками (МСК) и эндотелиальными клетками . МСК секретируют во внеклеточное пространство ряд факторов для обеспечения дифференцировки и связи с ИПСК, а эндотелиальные клетки экспрессируют компоненты внеклеточного матрикса, взаимодействие с которыми способствует увеличению длины саркомеров. Благодаря этим молекулам совместное культивирование с МСК и эндотелиоцитами усиливает созревание индуцированных плюрипотентных кардиомиоцитов.
Вступление
Тетралогия Фалло (TOF) является одним из наиболее распространенных типов цианотических поражений сердца и встречается у 8–9, 7% детей с врожденным пороком сердца 1, 2 . TOF представляет собой коновентрикулярную аномалию, которая состоит из четырех анатомических пороков развития: (1) дефект межжелудочковой перегородки; (2) стеноз легочной артерии; (3) аортальный клапан, который перекрывает межжелудочковую перегородку; и (4) гипертрофия правого желудочка, которая может не наблюдаться до периода новорожденности 3, 4 . Пациенты с TOF страдают от системной хронической гипоксии и длительной перегрузки правого желудочка. Выживание зависит от многих адаптивных механизмов, включая измененную экспрессию защитных ангиогенных, метаболических и антиоксидантных генов в миокарде, которые улучшают доставку O 2 и выработку энергии и сводят к минимуму повреждение при повторной оксигенации 5, 6, 7 . Пациенты с TOF обычно подвергаются хирургическому вмешательству в молодом возрасте, чтобы исправить свои неисправности; однако отсроченное лечение TOF связано с дезадаптивными изменениями, которые приводят к снижению показателей миокарда 6, 8 .
Важность митохондрий в производстве энергии сердечной мышцы была хорошо документирована в последние два десятилетия. Большой объем работ был установлен, чтобы предположить, что врожденные и приобретенные пороки сердца связаны с митохондриальными аномалиями 9, 10, 11
Сообщалось, что в сердцах пациентов с TOF обнаружена сниженная митохондриальная ферментативная активность 12, 13 и митохондриальные аномалии 14, 15 . PGC-1α, мощный транскрипционный коактиватор многих ядерных рецепторов и факторов транскрипции, служит основным регулятором митохондриального биогенеза и активности 16, 17, 18, 19 . PGC-1α регулирует экспрессию многих генов, которые кодируют митохондриальные белки. Он широко экспрессируется в тканях сердца и, как было показано, играет критическую роль в экспрессии генов, участвующих в митохондриальном АТФ-генерирующем пути в сердце, работая через группу молекул, включая PPAR, эстроген-связанные рецепторы, ядерные респираторные факторы. (NRFs) и другие факторы, такие как фактор усиления мышц-2 20, 21, 22 . Кроме того, было показано, что принудительная экспрессия PGC-1α в мутантных миоцитах сердца предотвращает апоптотический фенотип этих клеток 23 .
Учитывая важность PGC-1α в энергетическом метаболизме сердца, экспрессия PGC-1α в сердечной мышце строго модулирована 20. Экспрессия PGC-1α индуцируется перинатально и постепенно увеличивается до высокого уровня во взрослом сердце, сопровождая физиологический рост сердца 21, 24
Патологическая гипертрофия сердца, вызванная аортальной полосой на мышиных моделях хронической перегрузки давлением, приводит к снижению экспрессии миокарда как PGC-1α 25, 26, так и его генов-мишеней, которые участвуют в окислении жирных кислот и окислительном фосфорилировании 21, 25 . Эти результаты показывают, что экспрессия PGC-1α очень важна для развития сердца и заболеваний сердца.
Поскольку двумя основными факторами риска у пациентов с TOF являются системная хроническая гипоксия и устойчивая перегрузка давлением в правом желудочке, важно изучить уровень экспрессии PGC-1α в правом желудочке пациентов с TOF. В этом исследовании мы показываем, что как экспрессия PGC-1α, так и число митохондрий значительно повышаются в миокарде пациентов с TOF
Кроме того, экспрессия PGC-1α увеличивается в первичных клетках миокарда и клеточных линиях миокарда, культивируемых в условиях гипоксии, и это сопровождается повышенным биогенезом митохондрий. Механистические исследования показывают, что вызванная гипоксией экспрессия PGC-1α регулируется с помощью сигнального пути AMPK. Таким образом, наши результаты свидетельствуют о том, что гипоксия индуцирует экспрессию PGC-1α и митохондриальный биогенез через сигнальный путь AMPK.
Источники
1. Evans A., Neuman N. The Mighty Mitochondria. Molecular Cell. 2016, March, 3, 61 (5): 641.
2. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
3. Gaston D., Tsaousis A.D., Roger A.J. Predicting proteomes of mitochondria and related organelles from genomic and expressed sequence tag data. Methods in Enzymology. 2009, 457: 21-47.
4. Al Rawi S., Louvet-Vallée S., Djeddi A., Sachse M., Culetto E., Hajjar C., Boyd L., Legouis R., Galy V. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 2011, 334: 1144-1147.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R., et al. A revised timescale for human evolution based on ancient mitochondrial genomes. Current Biology. 21 March 2013, 23 (7): 553–59.
6. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
7. Bock F.J., Tait S.W.G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 2020, February, 21 (2): 85-100.
8. Kornmann B. The endoplasmic reticulum-mitochondria encounter structure: coordinating lipid metabolism across membranes. Journal of Biological Chemistry. 2020, May, 26, 401 (6-7): 811-820.
9. Liu X., Hajnóczky G. Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex. International Journal of Biochemistry and Cell Biology. 2009, 41: 1972-1976.
10. Murphy M.P. How mitochondria produce reactive oxygen species. Biochemistry Journal. 2009, 417: 1-13.
11. Clark A., Mach N. The crosstalk between the gut microbiota and mitochondria during exercise. Frontiers of Physiology. 2017, May 19, 8: 319.
12. Annesley S.J., Fisher P.R. Mitochondria in Health and Disease. Cells. 2019. July, 5, 8 (7): 680.
13. van der Giezen M., Tovar J. Degenerate mitochondria. Reports of European Molecular Biology Organization. 2005, June, 6, (6): 525-30.
14. Duchen M.R. Mitochondria in health and disease: perspectives on a new mitochondrial biology. Molecular Aspects of Medicine. 2004, August, 25 (4): 365-451.
15. Youle R.J., van der Bliek A.M. Mitochondrial fission, fusion, and stress. Science (New York, N.Y.), 2012, 337(6098), 1062–1065.
16. Ashrafi G., Schwarz T.L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death & Differentiation. 2013, January, 20 (1): 31-42.
17. Johanningsmeier S.D., Harris G.K. Pomegranate as a functional food and nutraceutical source. Annual Review of Food Science and Technology. 2011-02-28, 2 (1): 181–201.
18. Selma M.V., Beltrán D., Luna M.C., Romo-Vaquero M., García-Villalba R., Mira A., et al. Isolation of Human Intestinal Bacteria Capable of Producing the Bioactive Metabolite Isourolithin A from Ellagic Acid. Frontiers in Microbiology. 2017, 8: 1521.
19. D’Amico D., Andreux P.A., Valdés P., Singh A., Rinsch C., Auwerx J. Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, May 2021, S1471491421001180.
20. Ryu D., Mouchiroud L., Andreux P.A., Katsyuba E., Moullan N., Nicolet-Dit-Félix A.A., et al. «Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents». Nature Medicine. August 2016, 22 (8): 879–88.
21. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 2006, October, 19, 443 (7113): 787-95.
22. Михайлова Е.А., Локошко Д.В., Большакова Е.М. Полипренолы и долихолы, как важный компонент антиоксидантной защиты фосфолипидных мембран. Обзор данных современной научной литературы. Современная Российская наука: актуальные вопросы, достижения и инновации: сборник статей II Всероссийской научно-практической конференции, Пенза, 07 мая 2021 года. С. 97-101.
Как улучшить работу митохондрий?
На настоящий момент предложены две стратегии того, как улучшить функции митохондриального пула. Первая связана с тем, что митохондрии, как органеллы, не статичны. Они могут сливаться, делиться, увеличиваться и уменьшаться в размерах, а также обмениваться своим генетическим материалом . Это тоже своеобразное «наследие» их бактериального прошлого. В ходе таких слияний и делений поврежденные участки митохондрий и мтДНК отсеиваются и распадаются. Итогом становится образование новых, полноценных митохондрий, которые намного лучше выполняют все свои функции. То есть, благодаря этим процессам происходит обновление всего митохондриального пула клетки .
Мы имеем возможность ускорить это обновление. В частности, таким действием обладает функциональный продукт здорового питания под названием T8 ERA MIT UP, который недавно выпустила на рынок компания VILAVI INT LTD. В этом продукте содержится концентрат гранатового сока, который богат веществами под названием эллаготаннины . Попадая в наш желудок, они быстро распадаются с образованием эллаговой кислоты, а ее, в свою очередь, перерабатывают кишечные бактерии, производя уролитин А . Это соединение как раз и стимулирует митохондрии активнее обновляться путем слияния и деления. Уже есть исследования, которые показывают, что дефицит уролитина А – важный фактор преждевременного старения . Помимо этого, доказано, что приток этого вещества увеличивает сопротивляемость физическим и умственным нагрузкам как раз за счет улучшения выработки энергии в митохондриях .

Вторая стратегия основана на защите митохондрий от разрушающего воздействия оксидативного стресса. Как мы уже говорили, в ходе выработки энергии они также синтезируют активные формы кислорода. Это молекулы-суперокислители (они же – свободные радикалы), которые играют сигнальную роль. Но, помимо этого, они обладают и немалой химической агрессивностью, являясь основной причиной оксидативного клеточного стресса . А еще один действующий компонент активной формулы T8 ERA MIT UP – комплекс SibXP, содержащий полипренолы, клеточный сок пихты и хвойную пасту CGNC. При этом полипренолы – это многоатомные спирты растительного происхождения, которые обладают выраженной антиоксидантной активностью
Именно это их свойство и важно для улучшения функции митохондрий. Полипренолы химически связывают свободные радикалы, не давая им повреждать митохондриальные мембраны и ферменты
Благодаря этому выработка энергии в клетке и поддерживается на необходимом уровне .
Культура клеток
Клетки H9c2, полученные из желудочка эмбриона крысы (приобретены у банка клеток Шанхайского института биохимии и клеточной биологии, Китай), культивировали в DMEM с добавлением 10% эмбриональной бычьей сыворотки, 100 ед / мл пенициллина и 100 мкг / мл стрептомицина в атмосфере 95% воздуха, 5% CO 2 при 37 ° C. Первичные неоциатальные сердечные миоциты крысы получали от однодневных крыс Harlan Sprague-Dawley, как описано 43, 44, и культивировали в среде DMEM F12. Первичные миоциты сердца и клетки H9c2 подвергались нормоксическим или гипоксическим условиям при слияниях 70-80% в течение 24 часов. Гипоксическая среда создавалась путем инфузии предварительно проанализированной газовой смеси 95% N 2 и 5% CO 2 в воздухонепроницаемую модульную камеру (Billups-Rothenberg, Inc.), как описано ранее 45, 46 . Соединение C (Sigma, P5499), ингибитор AMPK, растворяли в ДМСО и затем дополнительно разбавляли в среде для культивирования клеток до различных концентраций. Все животные были обработаны в соответствии с установленными руководящими принципами обращения с животными. Это исследование было проведено в соответствии с Руководством по уходу и использованию лабораторных животных, опубликованным Национальными институтами здравоохранения США (публикация NIH № 85-23, пересмотренная в 1996 году).
Переключение клеточного источника энергии
В незрелом состоянии клетки используют в качестве источника энергии аэробный гликолиз вместо наиболее эффективного митохондриального окислительного фосфорилирования. У ученых возникла гипотеза, что переключение незрелого пути получения АТФ на зрелый способствует созреванию кардиомиоцитов, а также изменяет их физико-химические свойства, адаптируя к внешним условиям.
Переключить путь метаболизма возможно с помощью белка PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha). В исследовании Лиу с соавт. было показано, что активатор ZLN005 усиливает экспрессию PGC-1α, тем самым индуцируя характерный для зрелых клеток энергетический обмен, что вызывает созревание кардиомиоцитов. Такие кардиомиоциты являются наиболее идентичными естественным кардиомиоцитам человека.
Более простым способом является переключение метаболизма с гликолиза на окисление жирных кислот , что тоже достоверно способствует созреванию кардиомиоцитов. Для этого глюкозу в культуре клеток заменяют на галактозу и жирные кислоты — в частности пальмитиновую, олеиновую, линоленовую кислоты и карнитин.
Аннотация
PGC-1α, мощный транскрипционный коактиватор, является основным регулятором митохондриального биогенеза и активности в сердечной мышце. Сообщалось, что нарушение регуляции PGC-1α и его генов-мишеней связано с врожденными и приобретенными пороками сердца. Изучая образцы миокарда от пациентов с тетралогией Фалло, мы показываем здесь, что уровни экспрессии PGC-1α заметно повышены у пациентов по сравнению со здоровыми контролями и положительно коррелируют с тяжестью цианоза. Кроме того, гипоксия значительно индуцировала экспрессию PGC-1α и митохондриальный биогенез в культивируемых миоцитах сердца. Механистические исследования показывают, что вызванная гипоксией экспрессия PGC-1α регулируется с помощью сигнального пути AMPK. Вместе наши данные указывают на то, что гипоксия может стимулировать экспрессию PGC-1α и митохондриальный биогенез в миоцитах сердца, и этот процесс может обеспечить потенциальный адаптивный механизм для сердечных миоцитов, чтобы увеличить выработку АТФ и минимизировать гипоксическое повреждение сердца.
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Термин «митохондрия» произошел от сочетания двух греческих слов: «митос», что означает «нить» или «волокно», и «хондрос» — «зерно» или «крупица». Конечно, такое название вообще не отражает функции митохондрий. Связано это с тем, что впервые их описали еще в 1850 году. Исследователи увидели в мышечных клетках хорошо различимые овальные органеллы – отдельные, явно отграниченные включения в цитоплазме. Также была видна и их внутренняя структура, состоящая из каких-то полос и точек. Но что это такое и зачем оно нужно, тогда никто не знал, потому и название дали исключительно по внешнему виду
А понимание критически важной роли митохондрий для жизни клетки и всего нашего организма появилось только спустя почти столетие – в 1948 году
Сигнальный путь AMPK участвует в гипоксии-индуцированной экспрессии PGC-1α
AMPK представляет собой гетеротример, состоящий из каталитической α-субъединицы и регуляторных β- и γ-субъединиц. Он активируется связыванием AMP с двумя сайтами на γ-субъединице, что приводит к аллостерической активации AMPK и фосфорилированию α-субъединицы в Thr-172 27, 28 . Общепринято, что AMPK функционирует для поддержания снабжения АТФ во всех эукариотических клетках. Чтобы определить, участвует ли сигнальный путь AMPK в вызванной гипоксией экспрессии PGC-1α, мы проверили уровни фосфорилирования AMPK в первичных миоцитах сердца, культивируемых в нормальных и гипоксических условиях. Результаты показали, что гипоксия заметно активировала AMPK (фиг. 5B), и это было связано с 1, 8-кратным увеличением уровня мРНК PGC-1α и приблизительно в 1, 5-кратным увеличением уровня белка PGC-1α (фиг. 5A и 5C)., В присутствии 10 мкМ ингибитора AMPK фосфорилирование AMPK было слегка блокировано. Однако, когда концентрация соединения C была увеличена до 40 мкМ, активация AMPK была в значительной степени отменена (фиг.5B). Интересно, что в образцах, обработанных соединением C, экспрессия как мРНК PGC-1α, так и белка была снижена до уровня, который был даже ниже, чем у нормальных условий (фиг. 5A и 5C). Чтобы дополнительно проверить роль пути AMPK в индуцированной гипоксией экспрессии PGC-1α, мы сбили экспрессию α-субъединицы AMPK интерференцией siRNA. Для достижения максимальной эффективности сайленсинга генов в клетки была введена комбинация двух олигонуклеотидных последовательностей siРНК, полученных из двух изоформ α-субъединицы. Как показано на фиг. 5E, комбинированные миРНК значительно снижают экспрессию αAMPK. После нокдауна AMPK стимулирующее влияние гипоксии на экспрессию PGC-1α было отменено (фиг.5D и 5F). Вместе эти результаты показывают, что сигнальный путь AMPK участвует в гипоксии-индуцированной экспрессии PGC-1α.
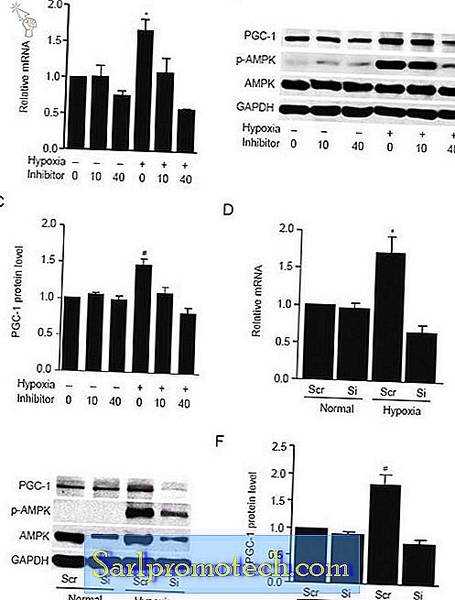
Вызванная гипоксией экспрессия PGC-1α опосредуется через сигнальный путь AMPK. Первичные сердечные миоциты культивировали в нормальных или гипоксических условиях в отсутствие и в присутствии различных доз ингибитора AMPK (10 или 40 мкМ). Затем клетки H9c2, трансфицированные siРНК (Si) или скремблированной последовательностью (Src), культивировали в нормальных или гипоксических условиях. Уровни экспрессии PGC-1α определяли с помощью ПЦР в реальном времени ( A, D ) и вестерн-блоттинга ( B, E ). Активность AMPK определяли вестерн-блоттингом с фос-AMPK-антителом и сравнением с блоттингом с общим антителом AMPK. Денситометрический анализ PGC-1α ( C, F ) показан. * Р <0, 05, # Р <0, 001 по сравнению с контрольной группой.
Изображение в полном размере
Жесткие субстраты
Увеличение жесткости субстрата обычно позволяет кардиомиоцитам приобрести более зрелый фенотип. Это связано с тем, что во время эмбрионального развития базальные мембраны и внеклеточный матрикс претерпевают изменения и накапливают больше коллагена. Таким образом, добавление к подложке культивируемых кардиомиоцитов различных жестких субстратов повторяет условия созревания этих клеток in vivo. Кроме того, механически напряженный субстрат (например, из фибрилл коллагена) облегчает ориентировку кардиомиоцитов в пространстве — в результате они вытягиваются вдоль волокон, что ведет и к другим физиологическим изменениям .
Похожие патенты RU2559779C1
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭКСПРЕССИЮ ГЕНА КОАКТИВАТОРА PGC-1A | 2011 |
|
RU2460524C1 |
| СПОСОБ ОЦЕНКИ ЭКСПРЕССИИ ГЕНОВ ТРИПТОФАНИЛ-ТРНК-СИНТЕТАЗЫ КАК МАРКЕРА ПЕРЕГРУЗОК В ХОДЕ ТРЕНИРОВКИ СПОРТСМЕНОВ — СОСТОЯНИЯ ПЕРЕТРЕНИРОВАННОСТИ | 2013 |
|
RU2521655C1 |
| ПРИМЕНЕНИЕ КОМПЛЕКСА-ТРИС-(2-ГИДРОКСИЭТИЛ)АМИНА С БИС-(2-МЕТИЛФЕНОКСИАЦЕТАТОМ) ЦИНКА (ЦИНКАТРАНА) ДЛЯ СТИМУЛЯЦИИ ЭКСПРЕССИИ МАТРИЧНОЙ РНК ТРИПТОФАНИЛ-тРНК-СИНТЕТАЗЫ | 2014 |
|
RU2540469C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АМИНОКИСЛОТЫ, ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С МИТОХОНДРИАЛЬНЫМИ ДИСФУНКЦИЯМИ | 2018 | RU2770660C2 | |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭКСПРЕССИЮ МАТРИЧНОЙ РНК ТРИПТОФАНИЛ-тРНК-СИНТЕТАЗЫ | 2010 |
|
RU2429836C1 |
| Применение протатран 4-хлор-2-метилфеноксиацетата (хлоркрезацина) для стимуляции экспрессии матричной РНК триптофанил-тРНК-синтетазы | 2016 |
|
RU2623035C1 |
| ГЕРМАТРАНОЛ-ГИДРАТ, СТИМУЛИРУЮЩИЙ ЭКСПРЕССИЮ МАТРИЧНОЙ РНК ТРИПТОФАНИЛ-ТРНК-СИНТЕТАЗЫ | 2014 |
|
RU2553986C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ПОСЛЕРОДОВОГО ЭНДОМЕТРИТА | 2011 |
|
RU2477861C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ ОНКОМАРКЕРА TFDP1 (ВАРИАНТЫ) И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2463354C1 |
| СПОСОБ ОЦЕНКИ ВРОЖДЕННОГО ИММУНИТЕТА У ДЕТЕЙ С БРОНХИАЛЬНОЙ АСТМОЙ | 2016 |
|
RU2618410C1 |
Гипоксия вызывает экспрессию ключевых генов, связанных с митохондриальным биогенезом
Существует несколько ключевых генов, таких как митохондриальный фактор транскрипции ДНК A (TFAM), аминолевулинатсинтаза (ALAS) и цитохром c (Cyto c ), которые играют критическую роль в биогенезе и функции митохондрий 19, 29 . Чтобы проверить, связано ли повышение экспрессии PGC-1α с гипоксией с повышением регуляции экспрессии этих генов, мы исследовали уровни их мРНК в первичных миоцитах сердца, культивированных в условиях гипоксии. Как показано на фиг.6А, мы обнаружили, что уровень мРНК TFAM в клетках, культивируемых в условиях гипоксии, повышался в 5 раз по сравнению с таковыми в клетках, культивируемых в нормальных условиях через 12 часов. В условиях гипоксии уровни мРНК ALAS и Cytoc в миоцитах сердца увеличивались в 2, 1 раза и в 1, 6 раза соответственно по сравнению с таковыми в нормальных условиях (фиг.6А). Более того, количество копий мтДНК было в 1, 3 раза выше в клетках, культивируемых в условиях гипоксии (фиг.6В).
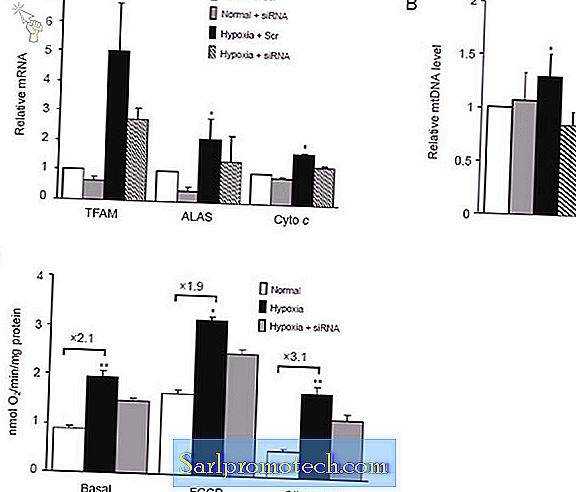
Гипоксия вызывает митохондриальный биогенез in vitro . Миоциты сердца, трансфицированные скремблированной последовательностью (Src) или миРНК PGC-1α (миРНК), культивировали в нормальных или гипоксических условиях. Уровни мРНК TFAM, ALAS и цитохрома с (Cytoc) определяли с помощью ПЦР в реальном времени (A) . Относительные уровни мтДНК определяли с помощью ПЦР в реальном времени (B) . Определяли базальное, максимальное и несвязанное дыхание этих клеток (C) . Каждое измерение проводили трижды и нормировали на содержание белка в клетках. * P <0, 05, ** P <0, 01, # P <0, 001 по сравнению с нормальной группой.
Изображение в полном размере
Для дальнейшего изучения того, увеличивает ли повышенная экспрессия PGC-1α функциональную способность к митохондриальному дыханию в сердечных миоцитах, культивируемых в условиях гипоксии, были определены скорости потребления кислорода. После 12 ч инкубации в гипоксических условиях базальное потребление кислорода миоцитами сердца было примерно в 2, 1 раза выше, чем потребление клеток, культивируемых в нормальных условиях (рис. 6С). FCCP-стимулированное потребление кислорода отражает количество и активность переноса электронов митохондриями. На рисунке 6C показано, что стимулированное FCCP потребление кислорода увеличилось в 1, 9 раза в группе с гипоксией. Олигомицин позволяет дышать только через протон. При наличии этого препарата потребление кислорода в группе с гипоксией было в 3, 1 раза выше. Эти результаты, вместе с увеличением митохондриального числа, наблюдаемого в миокардиальной мышце пациентов с TOF (Рисунок 1), позволяют предположить, что гипоксия активирует программу митохондриального биогенеза в миоцитах сердца.
Чтобы проверить, участвует ли PGC-1α в стимулированной гипоксией экспрессии митохондриального гена и репликации мтДНК, мы использовали миРНК для подавления экспрессии PGC-1α. Эффективность использованной нами миРНК была описана ранее 30, 31 и также показана в дополнительной информации, рисунок S1. После нокдауна PGC-1α вызванная гипоксией экспрессия TFAM, ALAS и Cytoc была частично отменена (фиг. 6A). Между тем, уровни мтДНК вернулись к уровням, аналогичным уровням клеток, культивируемых в нормальных условиях (фигура 6В). Как показано на фиг.6С, повышенные базальные, максимальные и несвязанные уровни дыхания митохондрий, наблюдаемые в условиях гипоксии, также частично возвращаются. Эти результаты показывают, что повышенная экспрессия PGC-1α участвует, но не требуется, в наблюдаемой стимуляции митохондриального биогенеза посредством гипоксии.