Press release
2020-10-05
has today decided to award
the 2020 Nobel Prize in Physiology or Medicine
jointly to
Harvey J. Alter, Michael Houghton and Charles M. Rice
for the discovery of Hepatitis C virus
SUMMARY
This year’s Nobel Prize is awarded to three scientists who have made a decisive contribution to the fight against blood-borne hepatitis, a major global health problem that causes cirrhosis and liver cancer in people around the world.
Harvey J. Alter, Michael Houghton and Charles M. Rice made seminal discoveries that led to the identification of a novel virus, Hepatitis C virus. Prior to their work, the discovery of the Hepatitis A and B viruses had been critical steps forward, but the majority of blood-borne hepatitis cases remained unexplained. The discovery of Hepatitis C virus revealed the cause of the remaining cases of chronic hepatitis and made possible blood tests and new medicines that have saved millions of lives.
Key publications
Alter HJ, Holland PV, Purcell RH, Lander JJ, Feinstone SM, Morrow AG, Schmidt PJ. Posttransfusion hepatitis after exclusion of commercial and hepatitis-B antigen-positive donors. Ann Intern Med. 1972; 77:691-699.
Feinstone SM, Kapikian AZ, Purcell RH, Alter HJ, Holland PV. Transfusion-associated hepatitis not due to viral hepatitis type A or B. N Engl J Med. 1975; 292:767-770.
Alter HJ, Holland PV, Morrow AG, Purcell RH, Feinstone SM, Moritsugu Y. Clinical and serological analysis of transfusion-associated hepatitis. Lancet. 1975; 2:838-841.
Alter HJ, Purcell RH, Holland PV, Popper H. Transmissible agent in non-A, non-B hepatitis. Lancet. 1978; 1:459-463.
Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science. 1989; 244:359-362.
Kuo G., Choo QL, Alter HJ, Gitnick GL, Redeker AG, Purcell RH, Miyamura T, Dienstag JL, Alter CE, Stevens CE, Tegtmeier GE, Bonino F, Colombo M, Lee WS, Kuo C., Berger K, Shuster JR, Overby LR, Bradley DW, Houghton M. An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis. Science. 1989; 244:362-364.
Kolykhalov AA, Agapov EV, Blight KJ, Mihalik K, Feinstone SM, Rice CM. Transmission of hepatitis C by intrahepatic inoculation with transcribed RNA. Science. 1997; 277:570-574.
Illustrations: The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
The Nobel Assembly, consisting of 50 professors at Karolinska Institutet, awards the Nobel Prize in Physiology or Medicine. Its Nobel Committee evaluates the nominations. Since 1901 the Nobel Prize has been awarded to scientists who have made the most important discoveries for the benefit of humankind.
Nobel Prize is the registered trademark of the Nobel Foundation
Рекомендуемые статьи на сайте:
«Биологические часы»
Нобелевская премия троим американским ученым – Джеффри Холлу, Майклу Росбашу и Майклу Янгу – была присуждена «за открытие молекулярных механизмов контроля циркадных ритмов».
Циркадные ритмы (от лат. circa – около, кругом и лат. dies – день), которые описывают циклические колебания интенсивности различных биологических процессов, связанные со сменой дня и ночи, открыл в конце XVIII века французский геофизик, астроном и хронобиолог Жан-Жак Дорту де Меран.
Ученый обратил внимание на то, что если орхидею поместить в затемненное помещение, то ее листья еще несколько дней продолжают разворачиваться и сворачиваться в суточном периоде точно так же, как если бы растение находилось на свету и реагировало на восход и закат солнца. Позже ученые выяснили, что подобные проявления периодичности наблюдаются и у других живых организмов
Природа этих «биологических часов» была не понятна, инструментария для исследования этого феномена в то время не было, и интерес к нему угас. Вновь вернулись к этой теме уже в XX столетии. Часть ученых считала, что за циркадные ритмы ответственны внешние факторы, другие полагали, что все механизмы кроются внутри организма и от внешней среды работа «биологических часов» никак не зависит.
Точка в этом споре была поставлена в начале 80-х годов, когда было доказано, что за работу «биочасов» отвечают гены. Калифорнийские ученые Рональд Конопка и Сеймур Бензер определили у мушек-дрозофил ген, названный ими period, который определяет время бодрствования и сна. Этих ученых уже нет в живых, Джеффри Холл и Майкл Росбаш являются их учениками. Холл, Росбаш и Янг (последний свои результаты получил в Рокфеллеровском институте независимо от Холла и Росбаша) описали механизм работы гена period.
Выводы ученых были подтверждены также опытами на грызунах. Было установлено, что колебания активности выделенных генов (выяснилось, что их несколько), отвечающих за биоритмы, зависят только от времени суток и наличие или отсутствие света на этот процесс не влияет. В то же время Янг определил белок (позже оказалось, что этих белков несколько), который реагирует на освещенность и корректирует работу «внутренних часов». Проще говоря, если живой организм оказался в темном помещении, то его «биологические часы» продолжают «тикать» практически в прежнем ритме и в то же время организм человека, сменившего часовой пояс, постепенно адаптируется к смене дня и ночи в новых условиях.
Сбылись ли пророчества?
Имена лауреатов Нобелевской премии по физиологии и медицине стали известны сегодня во время прямой трансляции на канале «Наука». Собеседник Алексея Семихатова — кандидат физико-математических наук, старший научный сотрудник Института биоорганической химии РАН, сооснователь и главный редактор проекта «Биомолекула» Антон Чугунов — прокомментировал это событие в режиме реального времени.
«Мне очень приятно услышать эти результаты, — сказал эксперт, — потому что я знаком с этими рецепторами, работаю с ними, изучаю. Интересно, что Clarivate Analytics (компания, которая ежегодно пытается предсказывать результаты Нобелевской премии, составляя список самых цитируемых ученых. — Прим. ред.) хотя и не угадала в очередной раз, но все-таки первый кандидат тоже был рецепторный
Стало быть, вопрос рецепторов привлекает довольно большое внимание»
Чугунов отметил, что и другой эксперт, мнение которого мы публиковали недавно в обзоре «Кто получит Нобелевскую премию — 2021?», тоже почти угадал — правда, он говорил о практическом применении открытых рецепторов. «В материале сайта канала «Наука» я увидел, что научный журналист Алексей Паевский высказал одно из предположений о том, что Нобелевскую премию должны дать за оптогенетику. И как раз с рецептором ТRP, который открыл Джулиус, связана другая область, которую разрабатывают в нашем институте, — она называется «термогенетика». Ее разрабатывает Всеволод Белоусов (я уверен, что ему сегодня много раз позвонят), он работает с этим самым рецептором ТRP: встраивает его в те нейроны, в которых его нет. Зачем? Чтобы можно было их активировать температурой, в том числе с медицинскими целями.
Есть способы нагревать очень прицельно отдельные участки внутри тела — микроволнами, или ультразвуком, или еще чем-нибудь. И тогда можно заставить работать некоторые нейронные контуры, которые функционируют не так, как нужно. В перспективе это поможет в лечении разных неврологических заболеваний, до которых сейчас не добраться. Потому что, чтобы до них добраться, надо что-то сделать с нейронами, которые у нас спрятаны где-то в мозгах или глубоко внутри тела. При помощи генетических технологий можно эти рецепторы доставить в эти нейроны, а при помощи физических технологий заставить их работать так и тогда, как нам нужно, и разработать новый протокол лечения. Так что фундаментальные изучения рецепторов обязательно находят или найдут в будущем практические применения».
Чугунов отметил, что изучение рецепторов, представляющих собой в большинстве случаев мембранный белок, стало возможным только в новейшее время — в связи с развитием технологий. «Мы существа многоклеточные, у нас 100 трлн клеток (грубо говоря), и в каждой клетке есть обязательно мембрана, то есть это то, куда она заключена, — объяснил эксперт. — В этой мембране находятся рецепторы, которые отвечают за все межклеточные коммуникации. В том числе за все чувства, которые у нас есть. Размеры белка очень маленькие — это 5–10 нанометров, его невозможно увидеть глазом и даже в микроскоп. В микроскоп мы можем увидеть 200 нанометров в лучшем случае, а молекула — в 10–20 раз меньше.
Поэтому, чтобы его изучать, потребовались очень сложные современные технологии, которые появились только в последние несколько десятков лет: это и рентгеноструктурный анализ, и ядерный магнитный резонанс, и криоэлектронная микроскопия… Все эти методики позволили изучить эти рецепторы, и благодаря им в том числе были сделаны эти достижения, которые сегодня отметил Нобелевский комитет. Также понадобилось компьютерное моделирование — пусть оно не изучает молекулы напрямую, но зато позволяет моделировать то, что не будет доступно экспериментальным методом, скорее всего, никогда».
Напоминаем, что завтра состоится объявление лауреатов по физике. Смотрите прямую трансляцию на канале «Наука» в 12:25!
Практическое применение
Биологических ритмов, которые управляют жизнью организма, довольно много – годичные, сезонные, месячные, суточные и так далее. Процессы, происходящие в живых организмах, синхронизированы с вращением Земли вокруг оси и вокруг Солнца; влияют на биоритмы также и другие периодические явления в природе. Циркадные ритмы сказываются на выработке инсулина в организме в течение суток, влияют на метаболизм, кровяное давление, умственную активность, сердечный ритм так далее.
Считается доказанным, что регулярное нарушение циркадных ритмов повышает риск заболевания сахарным диабетом. Есть гипотеза, что сбой биоритмов ответственен (повышает вероятность заболевания) за онкологию и инсульты, есть и противники таких предположений, которые утверждают, что подобная взаимосвязь ничем не подтверждена.
Открытие, которое сделали Холл, Росбаш и Янг, описывает общую схему действия механизма циркадных ритмов, однако есть еще множество деталей в работе этого механизма, которые на сегодняшний день не понятны. Ученые говорят о том, что, возможно, в будущем управление циркадными ритмами позволит регулировать активность людей, которые вынуждены работать в ночную смену, будут придуманы эффективные фармпрепараты для людей с нарушением сна и тому подобное. Предвидеть какие-либо более глобальные применения этому открытию пока не берется никто.
Удивительного в этом нет ничего. К примеру, в начале тридцатых годов прошлого века Эйнштейн и Резерфорд не верили в то, что можно получать энергию из расщепляемого атома и публично заявляли об этом. А примерно через десять лет был построен первый ядерный реактор, а через 20 лет была пущена первая в мире АЭС.
Тем не менее, факт присуждения кому-либо Нобелевской премии отнюдь не означает, что лауреат добился каких-то выдающихся результатов в науке или общественной жизни. Ученые говорят, что основания, по которым присуждается «Нобель», последние десятилетия носят не только научный характер.
Присуждение премий сопровождается повышенным информационным «шумом», открытия и заслуги лауреатов объявляются выдающимися, а сами лауреаты – едва ли не гениями. И что любопытно, в области экономических наук, например, о таких «гениях» по большей части забывают почти сразу же после вручения «Нобеля», а их экономические прогнозы перестают «попадать в цель». Что вызывает вопросы по поводу критериев, на основании которых Нобелевский комитет выбирает будущих лауреатов.
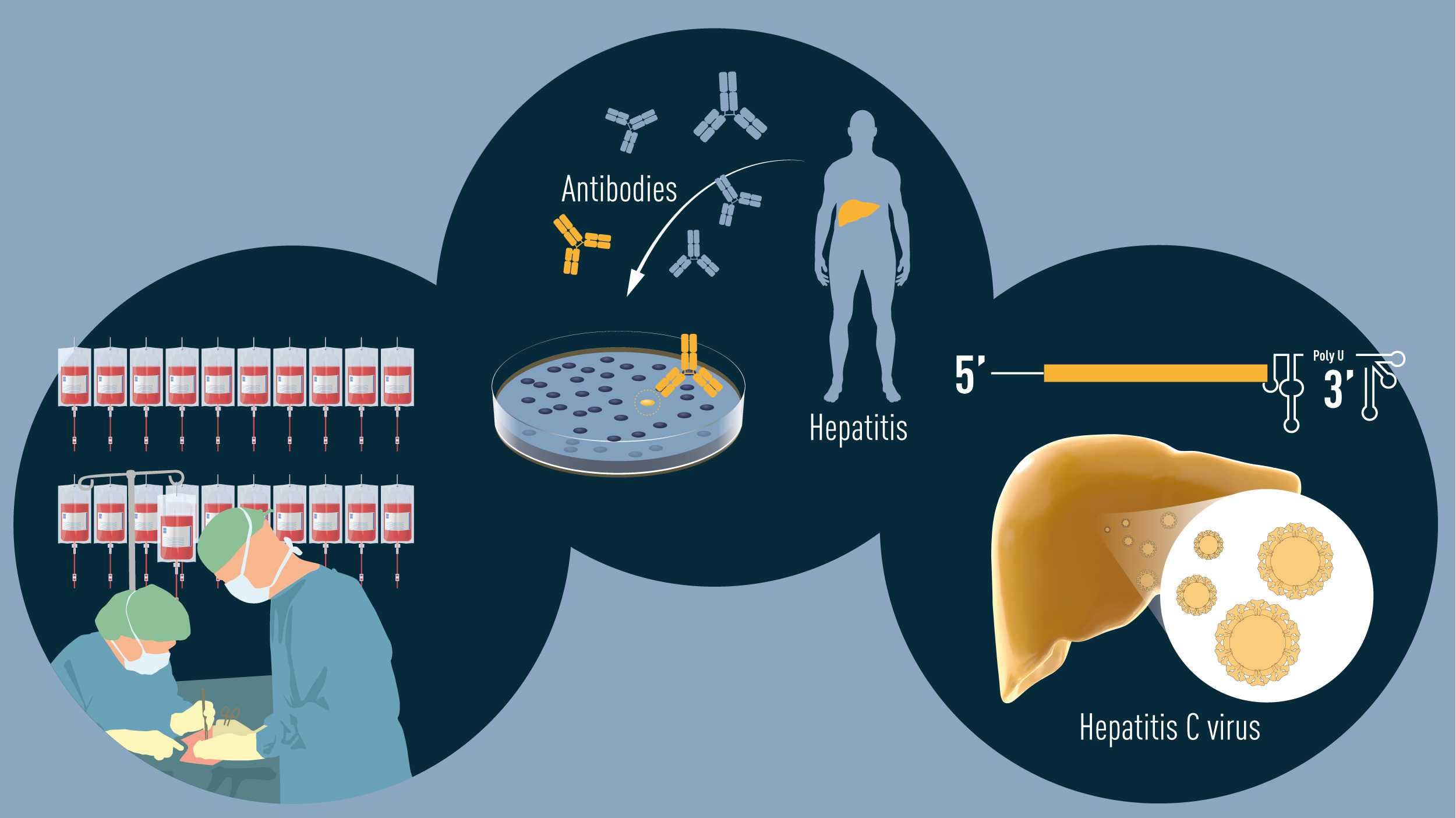
Identification of Hepatitis C virus
Identification of the novel virus was now a high priority. All the traditional techniques for virus hunting were put to use but, in spite of this, the virus eluded isolation for over a decade. Michael Houghton, working for the pharmaceutical firm Chiron, undertook the arduous work needed to isolate the genetic sequence of the virus. Houghton and his co-workers created a collection of DNA fragments from nucleic acids found in the blood of an infected chimpanzee. The majority of these fragments came from the genome of the chimpanzee itself, but the researchers predicted that some would be derived from the unknown virus. On the assumption that antibodies against the virus would be present in blood taken from hepatitis patients, the investigators used patient sera to identify cloned viral DNA fragments encoding viral proteins. Following a comprehensive search, one positive clone was found. Further work showed that this clone was derived from a novel RNA virus belonging to the Flavivirus family and it was named Hepatitis C virus. The presence of antibodies in chronic hepatitis patients strongly implicated this virus as the missing agent.
Figure 2 Summary of the discoveries awarded by this year’s Nobel prize. The methodical studies of transfusion-associated hepatitis by Harvey J. Alter demonstrated that an unknown virus was a common cause of chronic hepatitis. Michael Houghton used an untested strategy to isolate the genome of the new virus that was named Hepatitis C virus. Charles M. Rice provided the final evidence showing that Hepatitis C virus alone could cause hepatitis.
The discovery of Hepatitis C virus was decisive; but one essential piece of the puzzle was missing: could the virus alone cause hepatitis? To answer this question the scientists had to investigate if the cloned virus was able to replicate and cause disease. Charles M. Rice, a researcher at Washington University in St. Louis, along with other groups working with RNA viruses, noted a previously uncharacterized region in the end of the Hepatitis C virus genome that they suspected could be important for virus replication. Rice also observed genetic variations in isolated virus samples and hypothesized that some of them might hinder virus replication. Through genetic engineering, Rice generated an RNA variant of Hepatitis C virus that included the newly defined region of the viral genome and was devoid of the inactivating genetic variations. When this RNA was injected into the liver of chimpanzees, virus was detected in the blood and pathological changes resembling those seen in humans with the chronic disease were observed. This was the final proof that Hepatitis C virus alone could cause the unexplained cases of transfusion-mediated hepatitis.
Клеточные войны
Среди традиционных способов лечения рака наиболее распространены химио- и лучевая терапии. Однако существует и «естественные» методы лечения злокачественных образований, в том числе иммунотерапия. Одно из её перспективных направлений занимается использованием ингибиторов «контрольных точек иммунитета», расположенных на поверхности лимфоцитов (клеток иммунной системы).
Дело в том, что активация «контрольных точек иммунитета» подавляет развитие иммунного ответа. Такой «контрольной точкой» является, в частности, белок CTLA4, изучением которого Эллисон занимался на протяжении многих лет.
Также по теме
«Неизлечимые болезни можно победить»: как открытия нобелевского лауреата Джеймса Уотсона изменили медицину
90 лет назад родился биолог Джеймс Уотсон, один из первооткрывателей структуры молекулы ДНК. В 1962 году он удостоился Нобелевской…
Клетки опухоли научились использовать CTLA4, чтобы избежать атаки иммунной системы. Они вырабатывают большое количество активаторов белка, которые распознают «контрольные точки» и таким образом подавляют иммунитет. Ингибиторы, которые предложил использовать учёный, блокируют эти активаторы и не дают опухолевым клеткам избежать иммунной реакции. Итогом исследования учёного стала разработка препаратов, ингибирующих «контрольные точки».
Тасуку Хондзё исследовал аналогичный белок иммунных клеток (PD1) и выяснил, что он работает как тормоз, не давая опухоли развиваться. Это открытие также возможно использовать при лечении рака.
Как был пойман «ласковый убийца»?
Гепатит C, или, как его иногда называют, «ласковый убийца», — очень распространенная инфекция. По данным ВОЗ, хроническая форма этой болезни печени есть у 71 млн людей на планете. Тем не менее еще полвека назад об этом заболевании не было известно практически ничего. В 1960-е годы ученые стали подозревать, что бывает гепатит «не А», то есть не острая, быстро проходящая инфекция, именуемая в народе желтухой, которая передается через пищу и воду, а некий тяжелый хронический вирус, убивающий за одно-три десятилетия. В 1964 году был выделен вирус гепатита B, передающийся через кровь. За это открытие американский врач и вирусолог Барух Блумберг получил Нобелевскую премию по физиологии и медицине в 1976 году.
Но эти два гепатита не объясняли природу еще одной болезни печени, которая возникала у людей после переливания крови. Американский вирусолог Харви Альтер уже в 1960-е знал, что существует неизвестная форма вирусного гепатита — за ним закрепилось название «гепатит не А и не В». Альтер методично собирал образцы крови больных людей, у которых не обнаруживался гепатит В, но имелись все признаки заболевания. Вместе с коллегой Эдвардом Табором из Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США он ставил опыты над шимпанзе, заражая их этой неизвестной болезнью, и наблюдал, как животные умирают от разрушения печени. К 1975 году он уже не сомневался в существовании гепатита C, но нужны были доказательства. Они собирались как пазл в течение следующих десяти лет.
Британец Майкл Хьютон занялся выделением неизвестного вируса в 1980-х, когда работал в фармацевтической компании Chiron. Он кропотливо собирал ДНК из крови шимпанзе и пытался определить, на какие из ее фрагментов среагируют антитела крови больных людей, страдавших от неизвестной формы гепатита. С помощью своих молекулярных ловушек он смог, наконец, выследить виновника болезни — РНК-вирус из семейства флавивирусов. Этот возбудитель получил название «вирус гепатита С» и стал сенсацией 1989 года.

Открытие гепатита C в конце 1980-х знаменательно тем, что оно было сделано до того, как стали доступны высокопроизводительные молекулярные методы. Чарльз Райс из Университета Вашингтона в Сент-Луисе сумел определить и выделить участок генома, который казался ему более важным для размножения вируса гепатита С, чем другие. Он смог собрать экспериментальный вирус, который содержал эти участки, и ввести его в печень шимпанзе. В результате у животных развились симптомы, характерные для гепатита. Благодаря этой работе ученые узнали, как именно вирус поражает клетки печени, как он в них размножается и как можно его лечить.
Исследования Харви Альтера, Майкла Хьютона и Чарльза Райса привели в конечном итоге к созданию эффективной терапии, которая сегодня излечивает 95% больных. Если раньше для лечения использовались иммуностимуляторы, то в наши дни против гепатита C применяются препараты прямого действия, которые влияют непосредственно на вирус. Благодаря противовирусным препаратам миллионы людей смогли избавиться от своей болезни навсегда.
До открытия вируса гепатита C любое переливание крови было подобно русской рулетке. Шансы получить этот вирус были велики, а тестов и лечения не существовало. Хотя ученые стали нобелевскими лауреатами лишь в 2020 году, они уже много десятилетий спасают людей от инфекции. Благодаря им можно без боязни делать переливание крови и соглашаться на инвазивное медицинское вмешательство.
Майкл Хоутон
МАЙКЛ ХОУТОН– 70-летний британский ученый, биолог. В 1972-м окончил Университет Восточной Англии по специальности «биологические науки», а в 1977-м получил степень доктора философии по биохимии в Королевском колледже Лондона.
В 1989-м году Хоутон вместе с другими учеными, независимо от своего американского коллеги по Нобелевской премии Альтера, открыл вирус гепатита C. Он также соавтор открытия генома гепатита D. Сейчас ученый занят исследованиями по созданию вакцины от коронавируса. Хоутон работает в канадском Университете Альберты с 2010 года и возглавляет кафедру вирусологии.
Многие учёные принялись искать новый вирус, но традиционные методы не дали результата. Тогда Хотон и его коллеги разработали и применили новый подход.
Они кропотливо выделяли из крови инфицированного шимпанзе фрагменты ДНК и РНК. Разумеется, почти все они принадлежали самому животному. Но биологи надеялись, что рано или поздно наткнутся на генетический след таинственного вируса.
Но как его опознать? Дело происходило в 1980-х годах, современных методов анализа ДНК и РНК, мощных компьютеров и обширных баз данных тогда не было.
Лауреат предположил, что в крови пациентов с «гепатитом не А и не B» должны быть антитела к вирусу. Учёные выделили из крови добровольцев разные антитела и принялись методично проверять, не среагирует ли какое-нибудь из них на фрагменты генома из крови шимпанзе. Это была очень трудоёмкая работа.
После долгих исследований команда Хотона действительно обнаружила антитело, которое реагировало на фрагмент РНК. Дальнейшие изыскания показали, что он принадлежит вирусу из рода флавивирусов. Его назвали вирусом гепатита C. Флавивирусы — это группа вирусов, общими особенностями которых является наличие генома в виде одноцепочечной РНК, сферическая форма и небольшие размеры (40–60 нм) вирусных частичек. Снаружи вирусные частички одеты в оболочку — липидную мембрану. Репродукция вируса проходит в цитоплазме зараженной клетки — флавивирусы не проникают в ядро.
Майкл Хаутон задался целью во что бы то ни стало определить, что же вызывает гепатит C, и найти «виновника» этого заболевания. Работа в основном велась в лаборатории фармацевтической компании Chiron, где тогда начал работать ученый, c 1982 по 1988 год. Майкл Хаутон добился успеха, применив совершенно новый тогда подход — молекулярное клонирование фрагментов генома вируса в бактериях.
Суть методики состоит в следующем. Из образцов крови или ткани печени, полученных от больных людей или от инфицированных шимпанзе, выделяли нуклеиновые кислоты (ДНК и РНК). Далее при помощи обратной транскрипции получали копии ДНК, которые встраивали в бактериальные плазмиды. Эти плазмиды размножали в бактериях, получая множество изолированных колоний. Каждая колония в итоге содержала копию какого-то одного вида молекул из всего их множества, присутствовавшего в исходных образцах (то есть либо молекулы клеток хозяина, либо молекулы, происходящие из вируса). Из бактериальных клонов можно было выделять и анализировать собственно ДНК. Также можно было выделить полипептиды, синтезируемые в процессе трансляции на клонированных фрагментах.
Далее ученые из группы Хаутона анализировали фрагменты ДНК методом гибридизации нуклеиновых кислот (проводя гибридизацию ДНК из бактериальных клонов с помеченными радиоактивными метками образцами кДНК из крови пациентов). Успешную гибридизацию можно ожидать, если бактериальный клон содержит в себе нуклеотидную последовательность, схожую с последовательностями, присутствующими в анализируемых образцах крови. Целью при этом было обнаружить в библиотеке клонированных фрагментов вирусные геномы или хотя бы какие-то их части. Однако эти попытки не увенчались успехом: не обнаружилось ни одного клона, который бы стабильно гибридизовался с кДНК из крови больных, но не гибридизовался с кДНК из крови здоровых людей.
Синтезированные в бактериальных клонах пептиды проверяли на способность связываться с антителами из сыворотки пациентов. Публикация с сообщением об успешном раскрытии «преступника» вышла в 1989 году. Ученым пришлось проанализировать сотни миллионов бактериальных клонов, полученных на основе образцов крови и фрагментов печени большого числа пациентов, прежде чем удалось обнаружить одну положительную пробу. Метод гибридизации ДНК подтвердил, что клон действительно содержал генетический материал, присутствующий исключительно в образцах от больных пациентов или инфицированных шимпанзе.