Новый принцип иммунотерапии
В 1990-х Джеймс П. Эллисон в своей лаборатории Калифорнийского университета в Беркли изучал белок Т-клеток CTLA-4. Он оказался одним из многих ученых, чьи наблюдения позволили установить, что CTLA-4 работает в качестве «тормоза» Т-клеток. Другие научные группы использовали этот «тормоз» в качестве мишени при лечении аутоиммунных заболеваний. Но у Эллисона была совершенно иная идея. Он уже разработал антитела, которые могли связываться с CTLA-4 и блокировать его функцию (рис. 1). Теперь он мог попробовать посмотреть, сможет ли блокада CTLA-4 выключить «тормоз» Т-клеток и заставить иммунную систему атаковать раковые клетки. Эллисон и соавторы провели первый эксперимент в конце 1994 года, и, к их восторгу, его удалось успешно повторить уже после Рождества. Больная раком мышь была вылечена с помощью антител, которые ингибировали «тормоз» и открывали возможность для противоопухолевой активности Т-клеток. Несмотря на почти полное равнодушие фармацевтических компаний, Эллисон продолжил свои труды в попытке создать новые методы лечения онкологических заболеваний у человека
Многообещающие результаты вскоре были представлены разными научными группами, а в 2010 году было проведено важное клиническое испытание, в котором была продемонстрирована чрезвычайно высокая эффективность лечения у пациентов с меланомой. У некоторых пациентов полностью исчезли клинические признаки меланомы
Такие выдающиеся результаты никогда ранее не были выявлены у таких пациентов.
Рисунок
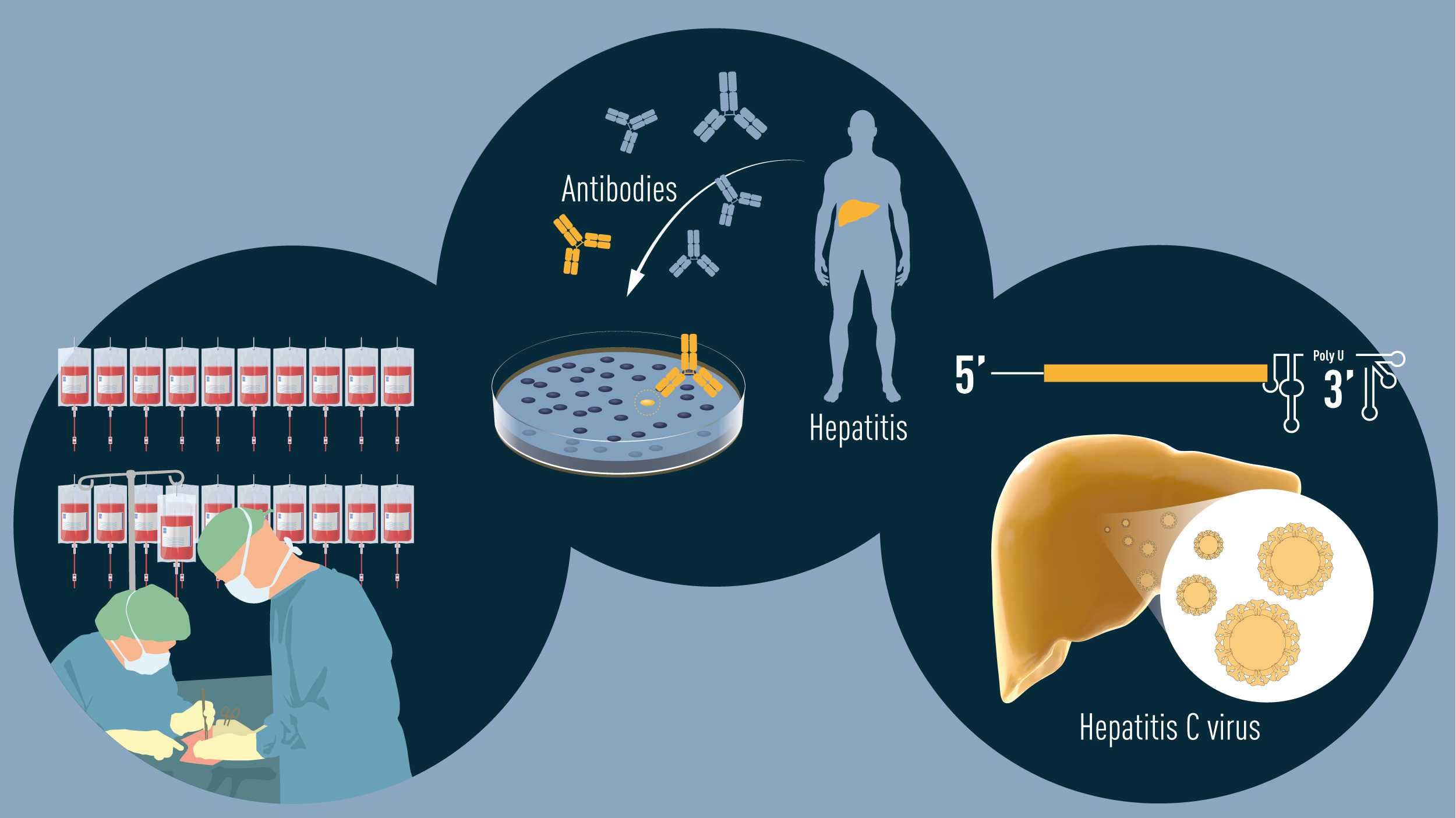
Вверху слева: для активации Т-клеток требуется, чтобы Т-клеточный рецептор связывался со структурами на других иммунных клетках, чтобы распознать объект как «не свой». Белок, функционирующий в качестве «акселератора» Т-клеток, также необходим для активации Т-клеток. CTLA-4 служит «тормозом» Т-клеток и ингибирует функции «акселератора».
Внизу слева: антитела (зеленые) против CTLA-4 блокируют функцию «тормоза», что приводит к активации Т-клеток и вынуждает их нападать на опухолевые клетки.
Вверху справа: PD-1 является еще одним «тормозом» Т-клеток, который ингибирует их активацию.
Внизу справа: антитела против PD-1 ингибируют функцию «тормоза», что позволяет Т-клеткам с высокой эффективностью уничтожать опухолевые клетки.
Немного истории
Итак, премия за аутофагию стала 107-й премией за открытия или изобретения в области физиологии или медицины с 1901 года по 2016 годы включительно. Первым же стал Эмиль Беринг, создатель сывороточной терапии и победитель дифтерии.
С тех пор лауреатами уже успело стать 211 человек. Самым молодым из них стал Фредерик Бантинг: он получил ее в 1923 году в возрасте 32 лет за открытие инсулина; cамым пожилым стал ПейтонРоус, лауреат 1966 года за открытие онкогенных вирусов. Кстати, о возрасте: лауреаты стремительно стареют. Если в декаде с 1951 по 1960 года лауреаты были в среднем 51-летние, то в последнее десятилетие этот возраст уже составил 67 лет. Воистину, до своей нобелевской премии надо дожить. Между прочим, ни современная Россия, ни СССР так и не дожили (в случае с Россией – надеемся, что «пока») до своего нобелиата по медицине. Оба российских лауреата – Иван Павлов и Илья Мечников получили свою премию еще «при царе».
Кстати, если судить по сайту Нобелевского комитета, самым популярным лауреатом всех времен и народов по-прежнему остаётся первый российский нобелевский лауреат вообще, Иван Павлов. Интересно, что он имел реальный шанс стать первым российским дважды лауреатом. Потому что уже после вручения премии за изучение пищеварения, его неоднократно номинировали на премию — уже за условные рефлексы.
А мы с вами, дорогие читатели, прощаемся до завтра: в 11.45 по стокгольмскому времени будет объявлен лауреат премии по физике.
Эксперименты с дрожжами и выделение генов, участвующих в аутофагии
Состав клеток, из которых состоят живые организмы, постоянно меняется. Аутофагия (самопоедание) – это работа клеток по расщеплению и утилизации ненужных соединений для поддержания жизнедеятельности. Эти механизмы были открыты в 1960-е годы, но они долгое время оставались малоизученными.
Осуми Ёсинори в 1988 году, когда он был доцентом Токийского университета, в ходе эксперимента по изучению процессов, происходящих в дрожжах в условиях недостаточного питания, наблюдал через микроскоп аутофагию в вакуолях клеток дрожжей. Потом он сравнивал клетки, в которых в условиях голодания не происходила аутофагия, с нормальными клетками, и в 1993 году выделил гены, которые участвуют в процессах аутофагии.
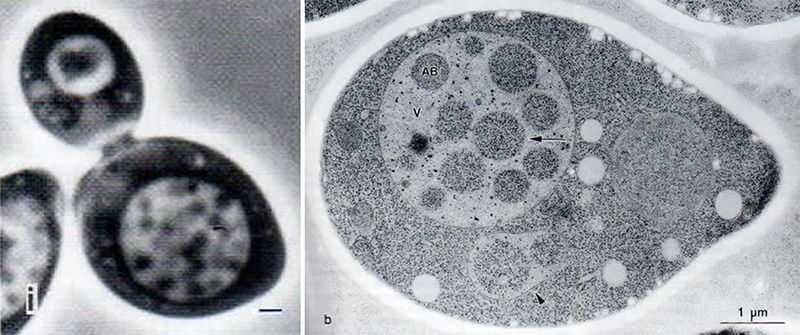 Аутофагия у дрожжей, которую впервые наблюдал при помощи оптического микроскопа Осуми Ёсинори (слева); аутофагия, видимая в электронный микроскоп (справа) (фотографии Токийского технологического института, предоставлены агентством Jiji Press)
Аутофагия у дрожжей, которую впервые наблюдал при помощи оптического микроскопа Осуми Ёсинори (слева); аутофагия, видимая в электронный микроскоп (справа) (фотографии Токийского технологического института, предоставлены агентством Jiji Press)
Осуми Ёсинори родился в преф. Фукуока в 1945 г. Окончил факультет искусств и наук Токийского университета, работал исследователем в Рокфеллеровском университете, с 1988 года стал доцентом факультета искусств и наук Токийского университета. Работал в различных исследовательских и образовательных учреждениях, в том числе в Институте общей биологии (преф. Тиба), Университете перспективных исследований. В 2014 г. стал почётным профессором Токийского технологического института.
Он уже получал различные награды как в Японии, так и за её пределами, в том числе Международную премию Гайрднера
3 октября 2016 г., когда стало известно о присуждении ему Нобелевской премии, в Токийском технологическом институте была организована пресс-конференция, во время которой он выразил свою радость в связи с получением за фундаментальные исследования настолько важной в научном мире премии
От наших чувств к рецепторам
Когда мы идем босиком по росе, то ощущаем одновременно тепло солнца, дыхание ветра, чувствуем текстуру травы, ее температуру и влажность. Когда залезаем в ванную с температурой выше 43 °C, то тут же выскакиваем из воды — горячо! От леденца с ментолом во рту становится холодно, а еда с перцем всегда согревает. Почему так происходит? Каким образом наш организм реагирует на окружающую среду? Это одна из великих загадок, с которой сталкивается человечество, отмечается в пресс-релизе Нобелевского комитета.
Дэвид Джулиус и Ардем Патапутян проводили свои исследования в США независимо друг от друга и ответ искали в области молекулярной биологии. Джулиус из Калифорнийского университета сосредоточился на реакции человеческих клеток на температуру и после продолжительных экспериментов с острым перцем чили (а точнее, веществом капсаицин) отыскал в мембране клеток человека своеобразный «датчик тепла» — рецептор TRPV1, особый чувствительный белок, который похожим образом реагирует на повышенную температуру и жгучий вкус. В опытах было установлено, что мыши-мутанты с дефицитом TRPV1 меньше реагируют на горячее и, кроме того, у них снижена способность воспринимать боль, вызванную воспалениями и онкологическими болезнями.
Дэвид Джулиус посвятил около 20 лет жизни изучению этих рецепторов: исследовал их механизмы, трехмерное устройство, определил 3D-структуру и указал на применение. Сегодня рецептор TRPV1 — один из самых знаменитых в этой области. Он сам и связанные с ним ионные каналы уже сегодня могут служить в медицине: они являются целями для разработки новых обезболивающих препаратов.
Другой нобелевский лауреат — уроженец Ливана армянского происхождения Ардем Патапутян, который много лет работает в Калифорнии в Институте Скриппса, — исследовал рецепторы осязания. Он и его команда провели долгие поиски и отсмотрели большой список генов-кандидатов, ответственных за механическое воздействие, прежде чем смогли идентифицировать единственный ген, чье подавление сделало клетки нечувствительными к прикосновениям. Так был открыт новый и совершенно неизвестный механочувствительный ионный канал, получивший название Piezo1 (от греческого слова, обозначающего давление). Благодаря сходству с Piezo1 был открыт второй ген, названный Piezo2.
Позже выяснилось, что Piezo2 играет также ключевую роль в критически важном восприятии положения и движения тела. Оба открытых канала Piezo регулируют такие важные физиологические процессы, как артериальное давление, дыхание и контроль мочевого пузыря
Впоследствии независимо друг от друга Дэвид Джулиус и Ардем Патапутян использовали ментол для идентификации TRPM8 — рецептора, который, как было доказано, активируется холодом. Проще говоря, они нашли ответ на вопрос, почему мятные конфетки имеют прохладный вкус.
В целом революционные открытия рецепторов TRPV1, TRPM8 и каналов Piezo позволили нам понять, как тепло, холод и механическая сила рождают нервные импульсы, через которые человек имеет возможность воспринимать окружающий мир и адаптироваться к нему. Эти знания станут фундаментом для разработки новых методов лечения широкого спектра заболеваний. В том числе это может помочь людям с редкой мутацией, которые не ощущают боль и не реагируют на температуру.
Победу Дэвида Джулиуса и Ардема Патапутяна можно было предугадать, так как в 2020 году они получили еще одну авторитетную награду — премию Кавли, которую часто называют «преднобелевской премией».
Тормоз и газ иммунной системы
Фундаментальным свойством нашей иммунной системы является наличие системы, которая отличает «своих» от «чужих», что позволяет уничтожать вторгающиеся бактерии, вирусы или иные опасности. Т-клетки — это тип лейкоцитов, являющихся ключевыми участниками в этой защите. У Т-клеток были обнаружены рецепторы, которые связываются с определенными структурами, опознанными как чужеродные, а затем через различные взаимодействия происходит активация иммунной системы, чтобы «поднять тревогу». Но для запуска полноценного иммунного ответа этого мало, нужны также дополнительные белки, которые служат «акселераторами» для Т-клеток (рис. 1)
Множество ученых, участвующих в этом важном фундаментальном исследовании, определили другие белки, которые работают в качестве «тормоза» Т-клеток, ингибируя иммунный ответ. Этот сложный баланс между «акселератором-газом» и «тормозом» иммунной системы необходим для точного контроля иммунного ответа
Это позволяет иммунной системе успешно уничтожать чужеродные микроорганизмы и в тоже время избегать чрезмерной активации, которая привела бы к аутоиммунному поражению здоровых тканей и органов.
Нобелевская премия по литературе
Лауреатом Нобелевской премии по литературе в этом году стал американский певец и автор песен Боб Дилан «за создание нового поэтического языка в великой американской песенной традиции».
О лауреате: Боб Дилан – американский музыкант, автор и исполнитель песен, художник, писатель и киноактёр. Родился 24 мая 1941 года в Дулуте, штат Миннесота. Дедушка и бабушка музыканта в 1905 году переехали в США из Одессы. Дилан является культовой фигурой в мире рок-музыки на протяжении последних 50 лет. 75-летний Дилан является девятикратным обладателем премии Грэмми. В 2000 и 2001 году он удостоился Оскара и Золотого глобуса за саундтрек к фильму «Вундеркинды». В 2008 году Боб Дилан получил Пулитцеровскую премию «за выдающееся влияние на популярную музыку и американскую культуру, отмеченное лирическими композициями исключительной поэтической силы». А теперь и Нобелевская премия – полный комплект!
Почему он: Почему не Мураками, например? Почему не Филипп Рот? Постоянный секретарь Нобелевского комитета по литературе Сара Даниус назвала Дилана в интервью, последовавшем за церемонией, «великим поэтом английской традиции». По её словам, Дилана «можно и нужно читать». Боб Дилан стал 259-м американцем, получившим Нобелевскую премию.
Нобелевская премия по химии
Лауреатами Нобелевской премии по химии стали Жан-Пьер Соваж, сэр Фрэзер Стоддарт и Бернард Феринга за проектирование и синтез молекулярных машин.

Фото Reuters и Wikipedia, коллаж informburo.kz
Жан-Пьер Соваж, Бернард Феринга и Фрэзер Стоддарт
О лауреатах: Саваж является почётным профессором Страсбургского университета и директор по исследованиям во французском Национальном центре научных исследований. Стоддарт работает в Северо-Западном университете США, а Феринга – профессор в области органической химии в Университете Гронингена, Нидерланды.
Почему они: Исследователи освоили управление движением на молекулярном уровне, а созданные ими машины в тысячу раз тоньше волоса.
«С точки зрения развития науки, молекулярные двигатели сейчас на том же этапе, что и электрический двигатель в 1830-е годы. Тогда учёные показали работу кривошипных механизмов и колец, не зная, что это приведёт к созданию поездов, стиральных машин, вентиляторов и кухонных комбайнов», – рассказали в Нобелевском комитете.
Ритм жизни
Циркадные ритмы — это суточные изменения деятельности организма. Они включают регуляцию сна и бодрствования, выделения гормонов, температуры тела и других параметров, которые изменяются в соответствии с суточным ритмом, поясняет врач-сомнолог Александр Мельников. Он отметил, что исследователи вели разработки в этом направлении несколько десятков лет.
«Прежде всего, нужно отметить, что это открытие не вчерашнего и не сегодняшнего дня. Эти исследования велись многие десятилетия — с 80-х годов прошлого века до настоящего времени — и позволили открыть один из глубинных механизмов, регулирующих природу организма человека и других живых существ. Механизм, которые открыли учёные, очень важен для влияния на суточный ритм организма», — рассказал Мельников.
По словам эксперта, эти процессы происходят не только из-за смены дня и ночи. Даже в условиях полярной ночи суточные ритмы будут продолжать действовать.
«Эти факторы очень важны, но очень часто у людей они нарушены. Эти процессы регулируются на генном уровне, что подтвердили лауреаты премии. В наше время люди очень часто меняют часовые пояса и подвергаются разным стрессам, связанным с резкими изменениями циркадного ритма. Напряжённый ритм современной жизни может влиять на правильность регулировки и возможности для отдыха организма», — заключил Мельников. Он уверен, что исследование Янга, Холла и Росбаша даёт возможность разработать новые механизмы воздействия на ритмы человеческого организма.
Можем ли мы вовлечь нашу иммунную систему в борьбу с раком?
Злокачественные новообразования представляют из себя неоднородную группу заболеваний, но все они характеризуются неконтролируемой пролиферацией атипичных клеток, а также их способностью проникать в здоровые органы и ткани. Существует множество методов терапии онкологических заболеваний, в том числе хирургическое вмешательство, лучевая терапия и другие стратегии лечения, многие из которых были отмечены предыдущими Нобелевскими премиями. В их числе гормональная терапия рака простаты (Хаггинс, 1966 год), химиотерапия (Элион и Хитчинс, 1988), а также трансплантация костного мозга при лейкемии (Томас, 1990). Однако запущенные опухоли все еще тяжело поддаются лечению, и разработка новых терапевтических стратегий является первостепенной задачей.
В конце XIX и начале XX вв. возникла идея, согласно которой активация иммунной системы и последующая атака опухолевых клеток может быть стратегией лечения рака. Предпринимались попытки заражения пациентов бактериями, чтобы активировать защитные системы организма. Результаты были весьма посредственными, но в сильно измененном виде этот подход дошел до наших дней в виде методики лечения рака мочевого пузыря. Тогда исследователям стало ясно, что имеющихся знаний недостаточно. Множество ученых были вовлечены в исследования фундаментальных принципов, лежащих в основе регулирования иммунной системы, и это помогло понять механизмы обнаружения опухолевых клеток иммунной системой. Несмотря на значительный научный прогресс, разработка новых методов лечения рака оставалась сложной задачей.
Почему это важно
Что же такое аутофагия? Дословно это слово переводится на русский язык как «самоедство». Если говорить совсем просто, это способность клетки «поедать» саму себя, а точнее – собственные компоненты. Существует несколько разновидностей аутофагии, которые по-разному влияют на судьбу клетки.
Например, при одном из этих вариантов, аутофагия помогает клетке пережить голод. При нехватке питательных веществ клетка может «съесть» часть своих органелл и продолжить жить, потом восстановившись.
Механизмы аутофагии задействуются, когда какие-то органеллы клетки повреждены – и их нужно уничтожить. То же самое происходит, когда в клетке появляются «неправильные» белки.
Очень важна аутофагия при нейродегенеративных заболеваниях. Например, именно процесс аутофагии мешает скапливаться мутантным белкам хантингтину (при болезни Хантингтона) и альфа-синуклеину (при болезни Паркинсона). Если нормальный процесс нарушен, то начинается болезнь: скопления белков разрушают нейроны.
Разновидность аутофагии, которая получила название каспаза-независимый апоптоз помогает удалять разрушенные «неудачные» клетки эмбриона, смерть которых была запрограммирована. Если этот процесс нарушается, скорее всего, эмбрион не разовьётся.
Фон
Нобель интересовался экспериментальной физиологией и создал собственные лаборатории.
Альфред Нобель родился 21 октября 1833 года в Стокгольме , Швеция, в семье инженеров. Он был химиком, инженером и изобретателем, сколотившим состояние при жизни, большую часть которого он получил благодаря 355 изобретениям, самым известным из которых является динамит . Он интересовался экспериментальной физиологией и создал собственные лаборатории во Франции и Италии для проведения экспериментов по переливанию крови. Будучи в курсе научных открытий, он был щедр на пожертвования лаборатории Ивана Павлова в России и с оптимизмом смотрел на прогресс, достигнутый в результате научных открытий, сделанных в лабораториях.
В 1888 году Нобель с удивлением прочитал во французской газете собственный некролог под названием «Торговец смертью мертв». Так случилось, что умер брат Нобеля Людвиг , но Нобель, недовольный содержанием некролога и обеспокоенный тем, что его наследие плохо отразится на нем, был вдохновлен изменить свое завещание. В своем последнем завещании Нобель просил, чтобы его деньги были использованы для создания серии премий для тех, кто приносит «наибольшую пользу человечеству» в физике , химии , мире , физиологии или медицине и литературе . Хотя Нобель написал несколько завещаний при жизни, последнее было написано чуть более чем за год до его смерти в возрасте 63 лет. Поскольку его завещание оспаривалось, оно не было одобрено стортингом (парламентом Норвегии) до 26 апреля 1897 года.
После смерти Нобеля был создан Нобелевский фонд для управления завещанными активами. В 1900 году новый устав Нобелевского фонда был обнародован шведским королем Оскаром II . Согласно завещанию Нобеля, Каролинский институт в Швеции, медицинская школа и исследовательский центр, отвечает за премию в области физиологии и медицины. Сегодня эту премию обычно называют Нобелевской премией по медицине.