Экспериментальные технологии
Наряду с общепринятыми методиками, имеющими высокий уровень доказательности, активно развиваются экспериментальные методики, такие как таргетное воздействие на стволовые опухолевые клетки, иммунотерапия, использование онколитических вирусов.
Sundar S. J. et al. (2014) важную роль в повышении эффективности химиотерапии глиобластом отводят таргетному воздействию на стволовые опухолевые клетки, так как с активностью именно данного типа клеток связывают выработку механизмов резистентности .
Иммунотерапия глиобластом делится на пассивную и активную. Пассивная представляет собой стимуляцию иммунной системы цитокинами, а также лечение стимулированными иммунными эффекторными клетками (натуральные киллеры, цитотоксические Т-лимфоциты). Активная иммунотерапия предполагает антигенную стимуляцию собственной иммунной системы. Она включает пептидную и клеточную технологии. В первом случае пептиды вводят в виде вакцины, вызывающей иммунную активацию (вирус-ассоциированные антигены, мутированные онкогенные белки и т.д.). Во втором — используются антигенпредставляющие клетки, способствующие формирование иммунного ответа на антигены опухоли .
Отдельный интерес представляет использование онколитических вирусов (модифицированный вирус простого герпеса), способных избирательно атаковать опухолевые клетки. Данная технология ограничена интенсивностью иммунного ответа на внедрение самого вируса, что требует одновременного применения цитостатиков .
Какие анализы помогают выявить мутацию?
Обычно мутации PIK3CA определяют методом полимеразной цепной реакции (ПЦР). В лаборатории ДНК опухолевых клеток многократно копируют с помощью ферментов, после чего она становится доступна для изучения. Также применяют секвенирование по Сэнгеру — методику, которая позволяет «прочитать» последовательность генетического кода.
Для исследования подходят ткани, фиксированные формалином, парафиновые блоки, образцы на предметных стеклах с содержанием опухолевых клеток не менее 10%. Можно использовать материал, который сохранился в лаборатории после предыдущей биопсии.
Кроме того, мутации PIK3CA могут быть обнаружены путем анализа плазмы крови. Это самый удобный способ: получить кровь проще, чем образец опухолевой ткани. Но отрицательный результат может быть недостоверным: в таких случаях всё же рекомендуется провести биопсию и перепроверить.
Мутации PIC3CA при раке молочной железы
При злокачественных опухолях молочной железы нарушение работы сигнального пути PI3K-Akt-mTOR обнаруживается более чем в 70% случаев. Оно может быть вызвано различными изменениями в генах. При гормонально-позитивном и HER2-негативном раке груди в 40% случаев встречаются мутации в гене PIC3CA.
В некоторых злокачественных опухолях молочной железы присутствует большое количество рецепторов к женским половым гормонам — эстрогенам и/или прогестерону. Такой рак называется гормонально-позитивным. Рост новообразования зависит от гормональных эффектов, и в данном случае эффективна гормональная терапия.
Примерно в 20% случаев на поверхности раковых клеток присутствует большое количество белка-рецептора HER2. Активируясь, этот рецептор стимулирует рост злокачественной опухоли. Такой рак называется HER2-позитивным, и против него хорошо работают некоторые таргетные препараты, например, герцептин (Трастузумаб).
Если на опухолевых клетках нет ни рецепторов к гормонам, ни чрезмерного количества HER2, то рак молочной железы называется тройным негативным. Обычно эти злокачественные опухоли агрессивны, и с ними сложно бороться.
При гормонально-позитивном и HER2-негативном раке молочной железы мутации в гене PIC3CA приводят к патологической активации сигнального пути PI3K-Akt-mTOR. Из-за этого становится неэффективна гормональная терапия.
Мутации PIK3CA при HER2-позитивном раке молочной железы встречаются в 20% случаев, и они также влияют на эффективность лечения. Это одна из причин устойчивости опухолевых клеток к таргетному препарату трастузумабу.
Кроме того, мутации PIK3CA влияют на течение заболевания и прогноз. Так, при раке G1 (высокодифференцированная опухоль — наименее агрессивная, и ее ткань максимально похожа на нормальную) мутации в этом гене не встречаются, а при G3 (низкодифференцированная опухоль — наиболее агрессивна) — встречаются в 20% случаев.
Среди женщин с раком молочной железы III стадии и мутацией PIK3CA существенно снижены показатели выживаемости:
- однолетняя выживаемость — снижена на 20%;
- 2-летняя выживаемость — на 30%;
- 3-летняя выживаемость — на 50%;
- 5-летняя выживаемость — на 30%.
Развитие таргетной терапии и преимущества метода
Рак – это бич современного общества, а потому процесс борьбы с онкологическими заболеваниями никогда не прекращается. Непосредственно при исследовании таргетного воздействия ищут новые комбинации препаратов и генерируют действующие вещества, находящие и разрушающие злокачественного образования. На сегодняшний день таргетная терапия осуществляется в следующих формах:
- воздействие на конкретные клеточные компоненты (рецепторы половых гормонов, элементы ДНК, ферменты);
- повреждение структур, отвечающих за жизнедеятельность новообразований, к примеру, сосудистой системы, питающей клетки;
- блокировка внутриклеточных биохимических сигналов, также отвечающих за развитие и распространение рака по организму.
Однако полного разделения таргетного воздействия и химиотерапии на данный момент не произошло, т.к. новые препараты, используемые в борьбе с раком, всё также сочетаются с цитостатиками для усиления эффективности. Потому и полного отсутствия побочных эффектов, в частности, проявляющихся в клеточной биохимии, гарантировать нельзя.
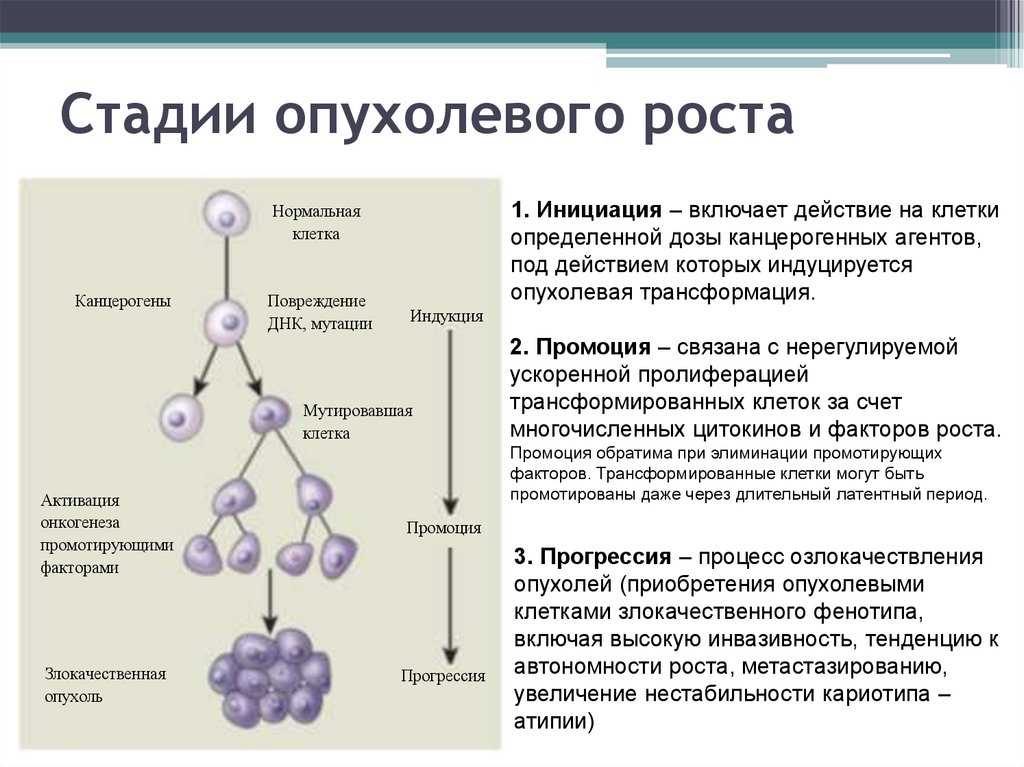
Мы все — мутанты, это норма. Но некоторые мутации приводят к раку
«Порядочные» клетки живут, не мешая другим. Используют строго отведенное количество ресурсов, достойно выполняют свои биологические функции, а в положенное время — умирают, уступая место следующим поколениям (этот процесс называется апоптозом). Каждые 7–10 лет тело человека полностью обновляется.
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Перед делением клетка запасается «копией» наследственной генетической информации, которая находится в ее ядре. Нити ДНК, «свернутые» в хромосомы внутри ядра — реплицируются, т. е. удваиваются. И уже после этого клетка делится, спокойно раздавая каждой из дочерних клеток по идентичному набору хромосом. Из одной клетки получается две абсолютно таких же, и вместе со своим генетическим багажом каждая из них получает «знания» о том, как ей надо жить, какую функцию выполнять и сколько раз в жизни делиться.
Иногда в процессе деления получаются сбои — мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом — и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли — по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования — без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли — это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования — все еще редкий случай, к сожалению — для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона — технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Большинство онкологов в России НЕ используют молекулярно-генетические тесты. Потому что не имеют достаточного опыта работы с ними и специфических знаний. Не получится просто открыть отчет и «списать» оттуда лечение
Нужно принимать во внимание множество факторов, понимать, как все эти многочисленные мутации влияют друг на друга, на рост опухоли, на потенциальную индивидуальную переносимость пациентом препарата и т. п
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) — а потом еще и собираем консилиум, принимаем коллегиальное решение.
Необходимо продумывать комбинации из таргетных препаратов, уметь сочетать их химиотерапевтическими лекарствами, предусматривать возможные побочные эффекты таких «коктейлей». Это довольно сложная задача — и врач должен быть очень мотивирован постоянно учиться.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел — нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF — у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Так что, хоть нам в международной клинике Медика24 и приходится все время держать мозги в тонусе, разбираться в новых и новых исследованиях генетических мутаций — результаты определенно того стоят.
Будьте здоровы.
Материал подготовлен заместителем главного врача по лечебной работе международной клиники Медика24, кандидатом медицинских наук Сергеевым Петром Сергеевичем.
Передается ли рак по наследству
Многие полагают, что, если факт наследования рака установлен, то заболевание возникнет обязательно. Наследственная предрасположенность не является 100% неизбежностью заболевания раком. Присутствие одних и тех же мутаций у одних оборачивается развитием рака в молодом возрасте, а другие остаются здоровыми до преклонных лет.
Проводимые исследования не выявили решающего влияния каких-либо внешних факторов на проявления онкологического заболевания. Ученые пришли к выводу, что в развитии рака большую роль играют особенности генетического фона человека.
Выявлены многочисленные варианты последовательности расположения нуклеотидов в цепочке ДНК, которые увеличивают или уменьшают вероятность образования злокачественных опухолей.
После получения молекулярно-генетического профиля опухоли — начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В зависимости от запроса, такое исследование может занимать от 5 до 15 рабочих дней: одному пациенту нужно просто определить тип опухоли и уточнить рекомендованную терапию — достаточно проверить наличие базового набора из 20 мутаций ДНК по рекомендациям мировых онкологических ассоциаций. А другому, с редким диагнозом или резистентностью к стандартному лечению — нужно составить «молекулярный паспорт» опухоли, а для этого — секвенировать 400 генов.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label — и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности — полезно для спокойствия пациента.
В итоге, из этого отчета врач получает максимально полный молекулярно-генетический профиль злокачественной опухоли. У него есть информация что именно лечим, какую конкретно поломку в клетке. Есть самое «свежее» понимание, какие препараты сегодня уже одобрены или доступны для использования в рамках клинических исследований.
Отчет получается довольно увесистым — 30 страниц захватывающего чтения
Рентгенологическая диагностика
Глиобластомы гипоинтенсивны при спиральной компьютерной томографии (СКТ) и гиперинтенсивны в режиме Т2 при магнитно-резонансной томографии (МРТ). Опухоль окружена инфильтративным отеком, распространяющимся на белое и серое вещество головного мозга, и характеризуется значительным объемным воздействием. На момент диагностики, как правило, выявляется смещение срединных структур и компрессия бокового желудочка. При контрастном усилении на МРТ можно увидеть кольцевидную тень, представляющую собой клетки опухоли, в центре кольца чаще находится зона некроза, реже — киста. В режиме МРТ Т2* можно увидеть выпадение сигнала от продуктов крови, хотя выявление гематомы в ткани опухоли является довольно редким явлением. Солидные части опухоли характеризуются низкой диффузией с уменьшенными значениями ADC (индекс коэффициента диффузии), в то время как некротические области демонстрируют высокий сигнал на диффузии. При МР-спектроскопии отмечается повышение пика холина, уменьшение NAA (N-ацетил-аспартат) и увеличение пика лактат/липиды. При исследовании перфузии отмечается значительное увеличение относительных значений объема крови в солидных частях опухоли по сравнению с паренхимой головного мозга. В 10 % случаев глиобластомы представлены множественными очагами при нейровизуализации . Известно, что клетки глиобластомы могут распространяться за пределы накапливающей контраст части опухоли примерно на 15 мм .
Дифференциальную диагностику глиобластом проводят с абсцессом характеризующимся снижением индекса коэффициента диффузии, а также метастатическими поражениями, обычно локализующимися на границе серого и белого вещества и сопровождающимися более выраженным перифокальным отеком .
Диффузионно-тензорная томография (трактография) позволяет оценить топографическое соотношение опухоли и основных проводящих путей, что является важным для хирургического планирования и позволяет дифференцировать послеоперационное васкулярное повреждение и резидуальную опухоль .
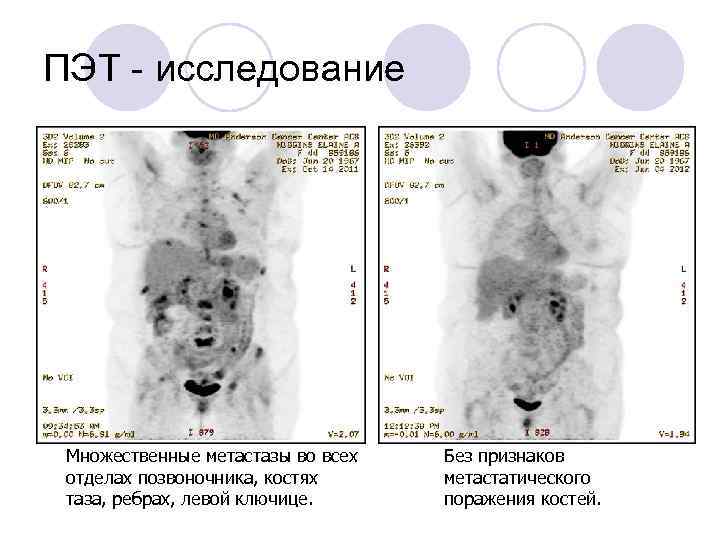
Для определения распространенности опухолевого процесса, планирования лучевой терапии и дифференциальной диагностики продолженного роста и постлучевого некроза используются следующие методы нейровизуализации: позитронно-эмиссионная томография с аминокислотами (1С-метионином, 18F-фторэтилтирозином, 18F-холином, 18F-допамином), однофотонная эмиссионная компьютерная томография, СКТ-перфузия, МРТ-ASL-перфузия и МР- спектроскопия .
Почему возникают мутации PIC3CA, и чем это грозит?
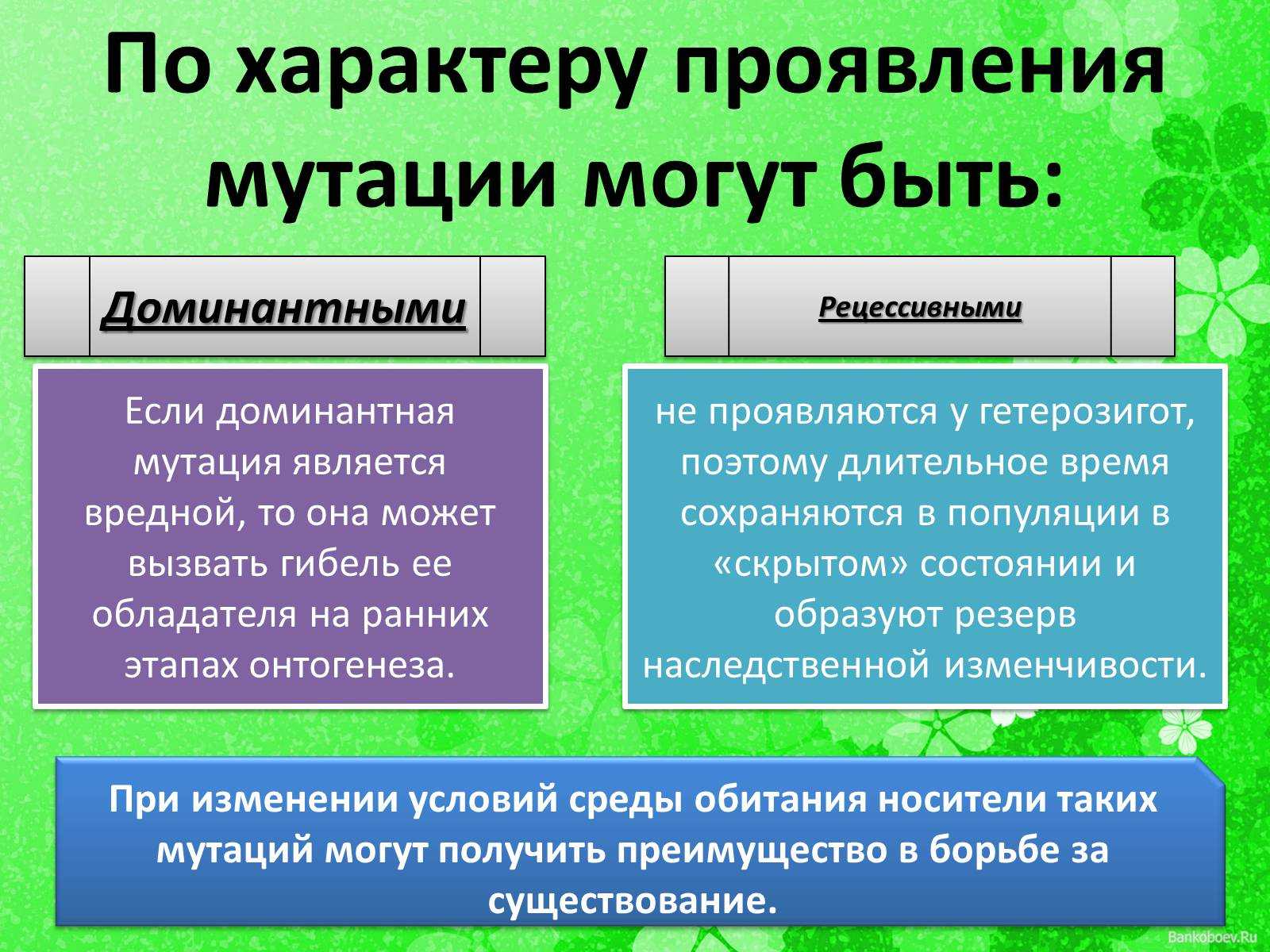
Все мутации, связанные с онкологическими заболеваниями, делятся на две большие группы:
- Наследственные передаются от родителей или возникают в половых клетках. Такие мутации присутствуют во всех клетках тела человека с рождения.
- Соматические возникают в течение жизни и только в определенных клетках.
Мутации в гене PIK3CA являются соматическими. Большинство из них (около 90%) возникает в трех «горячих точках»: положениях E542 и E545 экзона 9 (хеликазный домен), положении H1047 экзона 20 (киназный домен). Аминокислоты в позициях E542 и E545 обычно заменяются на лизин, а H1047 — на аргинин. Более редкие разновидности мутаций обнаруживаются в домене, который кодирует N-концевой участок р110 альфа, взаимодействующий регуляторной субъединицей с р85.
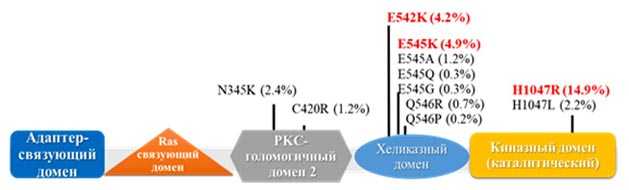
Мутации в гене PIK3CA. Фигурами разных цветов обозначены отдельные домены — части белка, выполняющие определенные функции.
В норме регуляторная субъединица PI3K удерживает каталитическую в неактивном состоянии. При мутации PIK3CA каталитическая единица все время активна.
Рак яичка
Сравнительно редкая опухоль. Страдают ею в основном белокожие мужчины (наиболее высок уровень заболеваемости в Норвегии, Дании, Швейцарии ). Хотя трудно объяснить, почему, например, уровень заболеваемости в Дании в 4 раза выше, чем в соседней Финляндии, и в 9 раз — чем в Литве.
В развитых странах каждый четвертый в течение жизни рискует заболеть раком, а каждый пятый — погибнуть от него. В развивающихся странах раковых больных всегда было меньше. Причина банальна — низкая продолжительность жизни. Но в последнее время и здесь люди стали жить дольше, отчего полезла вверх и кривая онкологических заболеваний.
Рак предстательной железы
Сегодня занимает одно из первых мест среди мужской онкологии. Американские специалисты предупреждают о настоящей эпидемии рака простаты в развитых странах мира и предсказывают как минимум трехкратное увеличение заболеваемости в предстоящие 30 лет.
Реже всего раком простаты у себя на родине болеют китайцы и японцы. Но как только человек из Юго-Восточной Азии переезжает в другую страну, риск этой болезни резко возрастает. Так, у китайцев, живущих в Калифорнии, он в 13-16 раз выше. Поэтому есть все основания полагать, что причина рака простаты — условия жизни, привычки. Например, приверженность к красному мясу и животным жирам. Полагают, что животный жир повышает в крови уровень половых гормонов и тем самым провоцирует болезнь. Включение в рацион растительного масла и рыбьего жира уменьшает шанс заболеть.
Гены: их роль и воздействие
Хорошо известно: клетки нашего организма действуют не хаотично, а в соответствии с программой, неким кодом, заложенным в ее ДНК.
Именно гены ответственны за все протекающие процессы, например, размножение клеток, их рост. Когда происходят изменения, система регуляции выходит из строя. В результате этого клетка игнорирует сигналы, поступающие от молекул посланные ей, и, превратившись в раковую, начинает бесконтрольно размножаться.
Сегодня большинство генов, в которых изменения ведут к раковой мутации, идентифицированы. Их принято классифицировать в 3 группы:
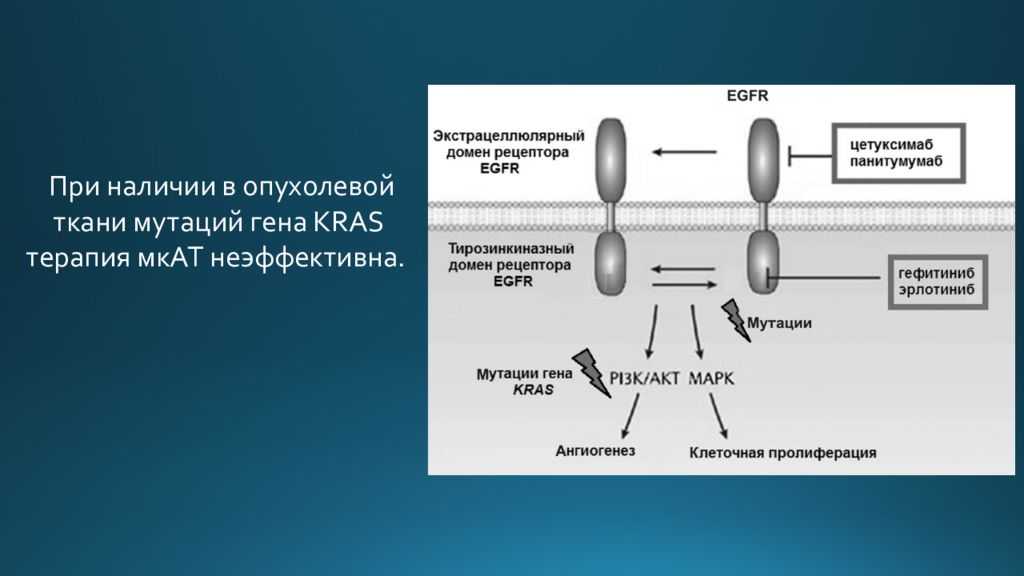
- Онкогены (сюда входят, например, HER2, RAS). Их функция кодировать белки, способствующие чрезмерному размножению клеток и защищающие их от апоптоза. Это важная роль, так как в случае чрезмерной активизации белка здоровая клетка становится патогенной.
- Гены-супрессоры опухолей(например, BRCA1, BRCA2, TP53). Их функция прямо противоположна и состоит в ограничении роста клеток, в инициировании в них апоптоза. В данном случае причиной мутации клеток становится их недостаточная активность.
- Гены репарации. Когда в молекуле ДНК начинаются изменения, гены этой группы начинают ей препятствовать, при слабой работе этих генов ДНК все больше изменяется.
Анализ на сепсис в клинике Onco.Rehab
Если становится ясно, что в раковой опухоли есть определенная мутация, как объект для воздействия лекарственного препарата можно избрать белок, способствующий бесконтрольному размножению патогенных клеток.
Но проблема состоит в том, что для подбора такого препарата необходимо знать, какой именно это белок. Вот здесь на помощь медикам и приходят молекулярно-генетические исследования.
Рак молочной железы
Провоцируют половые гормоны (эстрогены). Более чем столетний опыт изучения этого вида рака позволил ученым сделать однозначные выводы: чем позже у женщины появился первый ребенок, тем выше риск рака молочной железы. Вероятность заболеть, например, возрастает в три раза, если первые роды случились в 30, а не в 18 лет. Поэтому в странах, где женщины рожают рано (Средняя Азия и Ближний Восток, Китай, Япония), заболеваемость раком молочной железы низка. Более всего распространен рак молочной железы в Великобритании.
Надо сказать, что и в окружающей среде есть вещества, влияющие на уровень заболеваемости раком молочной железы. Например, табачный дым содержит почти точные копии эстрогенов. И действуют они соответствующе — провоцируют рак.
А вот в некоторых растениях содержатся соединения (флавоноиды), которые защищают нас от рака. Есть они (и много) в чае, рисе, сое, яблоках, капусте, салатах, луке. Именно с регулярным употреблением в пищу некоторых из этих продуктов ученые связывают низкую заболеваемость раком молочной железы на Востоке (Китай, Япония).
Бесконтрольность белков и сдерживающие препараты
TRK – это аббревиатура, обозначающая международное название отропомиозин-рецепторной киназы. Так называется белок, локализующийся в мембране клетки. Функции его различны, но для онкологии важна, прежде всего, одна из них – помощь в избегании апоптоза клетки.
Самые частотные типы названного рецептора – TrkA, TrkB и TrkC.
NTRK1, NTRK2 и NTRK3, являющиеся генами NTRK (гены нейротрофической рецепторной тирозинкиназы), кодируют эти рецепторы.
Любые мутации в этих генах становятся причиной активации белков Trk, что инициирует развитие ряда злокачественных новообразований, например, опухоли легких.
В NTRK-позитивных опухолях нередко выявляется сращение генов, что также является разновидностью мутационного процесса.
В современной медицинской практике используются ингибиторы Trk, т.е. препараты, способные блокировать белки супер-активные:
Ларотректиниб. Это ингибитор TrkA, TrkB, TrkC. Одобрен FDA в конце 2018 года. Применяется при лечении некоторых типов NTRK-позитивного метастазированного рака, в случае безрезультатности других видов терапевтического лечения.
Клинические исследования показали эффективность препарата в лечении любой опухоли.
Результаты: у 75% пациентов – ответ на лечение, 22% — опухоль исчезла полностью, 53% – уменьшилась наполовину.
Еще один препарат из этой серии – Энтректиниб. Является ингибитором TrkA, TrkB, TrkC и ряда других белков.
Создание эффективного препарата – лишь один из шагов в борьбе с раковыми заболеваниями. Одна из важнейших роль в этой борьбе отводится методам диагностики. Именно она поможет специалисту-онкологу разобраться в вопросах мутации NTRK и назначении оптимального лечения.
Заключение
Несмотря на современные достижения в изучении биологии глиобластом, проблема остается крайне актуальной. В условиях развития микрохирургической техники становится возможным удаление опухолей с сохранением нормального качества жизни пациентов. В свою очередь, радикальность удаления улучшает время общей и безрецидивной выживаемости.
Совершенствуются методики лучевой и химиотерапии, что находит положительное отражение в нейроонкологической статистике. Многообещающими являются экспериментальные технологии, основанные на таргетных генетических и иммунологических механизмах.