Общий белок
Общий белок – это сумма всех различных белков в сыворотке или плазме. Плазма содержит на 0,2-0,4% больше белка, чем сыворотка за счет фибриногена.
Гипопротеинемия и гиперпротеинемия – это неспецифические индикаторы. Они в основном используются для оценки состояния пациента. Относительная гиперпротеинемия -– не самое частое состояние. На количество общего белка влияет скорость синтеза белка, скорость разложения белка и количество плазмы.
Повышенные значения:
- обезвоживание;
- гипергаммаглобулинемия – хронические инфекции;
- парапротеинемия – миелома, макроглобулинемия Вальденстрема;
- повышенный синтез белка острой фазы.
Сниженные значения:
- потеря белка – гастроэнтеропатия, нефротический синдром, ожоги;
- снижение потребления или синтеза белка – дефицит белка, нарушение расщепления и всасывания белка, хронические заболевания печени, гуморальный иммунодефицит;
- повышенный метаболизм и утилизация белков – эндокринологические заболевания, такие как тиреотоксикоз; опухоли;
- повышенная проницаемость капилляров – генерализованная инфекция.
Большое количество – для большой роли
доли различных белков в крови
Такое большое количество альбумина (по сравнению с другими плазменными белками) запрограммировано природой, поскольку оно необходимо для качественного выполнения функционального назначения, которое он осуществляет следующим образом:
- В компетенцию этого простого белка входит связывание многих веществ, которые в свободном состоянии могут быть опасными для организма. Например, несвязанный билирубин является ядом, а в соединении с альбумином сразу теряет все токсические свойства и в безвредной форме доставляется в печень. Связав холестерин и жирные кислоты, альбумин спасает от разрушения красные кровяные тельца – эритроциты (ЖК в соединении с данным белком перестают негативно влиять на эритроциты), препятствует жировому перерождению печени и образованию атеросклеротических бляшек;
- Данный белок вступает во взаимодействие с кальцием, обратимо связывает до 40 % его количества, чтобы обеспечить динамическое равновесие с метаболически активной формой – ионизированным кальцием, который представляет собой свободные ионы элемента (Са2+);
- Кроме кальция, альбумин способен связываться с другими неорганическими катионами (Mg2+, Zn2+), а также с многими фармацевтическими средствами (барбитураты, производные салициловой кислоты, антибактериальные препараты, аминокислоты);
- Сывороточный альбумин находится в числе участников процесса, поддерживающего на благоприятном уровне концентрации анионов и катионов и, если в организм попадают тяжелые металлы, вездесущий протеин (благодаря своим тиоловым группам) в течение короткого времени связывает и нейтрализует их;
- Альбумин в крови транспортирует углеводы и многие биологически активные вещества, в частности – гормоны щитовидной железы (тироксин, трийодтиронин) и гормоны коры надпочечников (альдостерон, кортизол). И, хотя данные вещества, находясь в соединении с этим белком, не проявляют никакой активности, в любой момент они могут мобилизоваться, чтобы быстро решить свои функциональные задачи;
- Главная фракция плазмы крови, подобно другим белкам, также состоит в резерве, предназначенном для построения новых тканевых протеинов.
Низкий альбумин в плазме приводит к тому, что вещества, которых обычно «видит» и связывает альбумин, остаются без субстрата для соединения и их концентрация в крови начинает падать, однако при этом, физиологически активные фракции некоторое время продолжают поддерживать уровень своих нормальных значений, препятствуя тем самым формированию каких-либо клинических признаков патологии.
Белковые фракции
Фракционирование белков – это ориентировочный количественный метод оценки количества определенных белков. В основном идентифицируются и интерпретируются 5 белковых фракций:
- альбумин;
- альфа-1-глобулины;
- альфа-2-глобулины;
- бета-глобулины, также можно выделить фракции бета-1-глобулинов и бета-2-глобулинов;
- гамма-глобулины.
Клиническая интерпретация этих фракций определяется содержащимися в них белками.
Фракция альбумина:
- преальбумин;
- альбумин.
Фракция альфа-1 глобулина:
- альфа-1-антитрипсин;
- альфа-1 кислотный гликопротеин – орозомукоид;
- альфа-1 липопротеин – аполипопротеин А;
- химотрипсин альфа 1;
- альфа-фетопротеин.
Фракция альфа-2 глобулина:
- альфа-2-макроглобулин;
- гаптоглобулин;
- церулоплазмин;
- бета-липопротеин (аполипопротеин B также может находиться в бета-зоне на некоторых электрофореграммах);
- гемопексин;
- антитромбин III;
- Ингибитор с1-эстеразы.
Фракция бета-глобулина:
- трансферрин (зона бета-1 глобулинов);
- комплемент C4 (зона бета-1 глобулина);
- комплемент C3 (зона бета 2 глобулинов);
- бета-2-микроглобулин (зона бета-2-глобулинов).
Фракция гамма-глобулина:
- иммуноглобулин А;
- иммуноглобулин М;
- иммуноглобулин G;
- фибриноген (в образцах плазмы);
- иммуноглобулин Е;
- иммуноглобулин D;
- легкие цепи иммуноглобулина;
- С-реактивный белок;
- лизоцим (мурамидаза).
Виды аминокислот
Аминокислоты чаще всего делятся в зависимости от того, синтезируются ли они организмом или должны поставляться с пищей.
У здоровых людей эндогенные аминокислоты вырабатываются в достаточном количестве, но в случае нарушения обмена веществ или сопутствующих заболеваний может потребоваться их поступление из вне. К этой группе относятся: аланин, глицин, пролин, аспарагин, аспарагиновая кислота, глутаминовая кислота, цистеин и серин.
В свою очередь, экзогенные аминокислоты делятся на подгруппы:
- Относительно экзогенные аминокислоты. Их организм способен вырабатывать при условии, что он обеспечен соответствующими питательными веществами (чаще всего другими аминокислотами). Относительные аминокислоты: аргинин, гистидин, тирозин.
- Абсолютно экзогенные аминокислоты. Должны поставляться с пищей или в виде добавок: лейцин, изолейцин, лизин, метионин, фенилаланин, валин, треонин, триптофан.
Таблица 1. Роль отдельных аминокислот
| Аминокислота | Роль в организме | Как восполнить |
| Аргинин | Микрофлора кишечника, кишечная проницаемость, чувствительность к инсулину, артериальное давление | Содержится в мясе, рыбе, крупах, бобовых, орехах, сухофруктах, грибах |
| Аспарагиновая кислота | В виде калийной соли применяется при нарушениях развития детей с задержкой роста, в состояниях физического и психического истощения, выздоровления после заболеваний и хирургических вмешательств | Больше всего ее в продуктах пчеловодства. Также кислоту получают из продуктов животного происхождения. Также содержится в пивных дрожжах, орехах, авокадо |
| Глутаминовая кислота, цистеин, глицин | Это строительный блок глутатиона — важнейшего антиоксиданта | Синтезируется в организме. Есть в мясе, молоке, орехах, некоторых овощах |
| Фенилаланин | Необходим организму для выработки другого эндогенного соединения — тирозина. Отвечает за: укрепление физического состояния, поддержку похудения, уменьшение признаков усталости, нормальный уровень железа и белка в организме | Фенилаланин доступен в мясе, рыбе, молочных продуктах и яйцах |
| Изолейцин | Отвечает за: наращивание и укрепление мышечной ткани, регенерацию, поддержку в синтезе белков и гемоглобина, регулирование и поддержание нормального уровня сахара в крови | Это экзогенная аминокислота, поступающая в организм с молочными продуктами, мясом, орехами, яйцами |
| Лейцин | Отвечает за: развитие и конструирование мышечной ткани, снабжение организма энергией, снижение уровня глюкозы, профилактику быстрой утомляемости организма, поддержку иммунной системы | Это соединение, содержащееся в белках, особенно сое и молоке, рыбе, мясе |
| Лизин | Отвечает за: укрепление сердечно-сосудистой системы, профилактику образования пульпы, увеличение мышечной массы, выработку антител, стимуляцию роста, концентрацию, выработку гормонов и ферментов. | Еще одно из экзогенных соединений, которое можно обеспечить, употребляя в пищу рыбу, сыр, бобовые, гречку, орехи, желатин |
| Метионин | Отвечает за: поддержку метаболических изменений, синтез холина и креатина, метилирование соединений. | Соединение можно дополнить, потребляя белковые и зерновые продукты |
| Треонин | Отвечает за: правильную работу нервной системы, повышение иммунитета, синтез мышечного белка, переваривание жиров и правильное функционирование печени, правильную работу пищеварительной системы. | Можно обеспечить с мясом птицы, рыбой, молочными продуктами, бобовыми, желатином, зерновыми злаками |
| Триптофан | Отвечает в организме за: выработку мелатонина, сератонина и гормона роста, синтез витаминов В3 и В6, поддерживает углеводный обмен, защищает зрение от УФ-излучения, правильную работу пищеварительной системы, стимулирующую похудение, лактацию. | Аминокислота, дефицит которой можно дополнить диетой, богатой рыбой, постным мясом, тыквенными семечками, соевыми продуктами и производными молока |
| Валин | Валин отвечает за: развитие мышечной ткани, синтез витамина В5, регенерацию организма, биосинтез углеводов. | Содержится в молоке и молочных продуктах, мясе, рыбе, орехах, семенах, бобовых |
| Цистин | Одна из серосодержащих аминокислот. Играет важную роль в синтезе инсулина, белков плазмы крови и как поставщик серы для обменных процессов. | Это относительно экзогенная аминокислота: может быть восстановлена из метионина. Взаимосвязь есть и в обратную сторону – низкое содержание цистина в пище, может вызвать повышение потребности в метионине. |
Польза и вред
Положительно влияет L-tryptophan на людей, склонных к раздражительности, перепадам настроения, повышенному напряжению. Прием аминокислоты повышает восприимчивость мозга к информации, улучшает способность переносить жесткое давление, сильный испуг, ситуацию нестабильности. У человека с достаточным количеством в организме этого элемента увеличивается работоспособность.
Аминокислота Tryptophan положительно влияет на сон, что обусловлено повышением выработки гормона сна мелатонина. Существует миф, что регулярное употребление продуктов, содержащих триптофан, способствует развитию сонливости. Это не совсем так, ведь аминокислота является источником образования гормона радости серотонина, а производство мелатонина происходит по необходимости. Если после приема пищи клонит ко сну, то это обусловлено ее повышенной питательностью, плотностью или жирностью, что нередко происходит после употребления грибов и мясных продуктов.
Помимо всего прочего, аминокислота триптофан помогает человеку справиться с последствиями отказа от алкоголя, курения, наркотиков. Вещество во время реабилитации снижет потребность в химических веществах, способствует уменьшению агрессивности, возбудимости, нервозности, раздражительности. Что касается вреда для организма, то у этого компонента присутствуют и негативные свойства:
- при нарушениях работы иммунной системы дополнительный прием аминокислоты может спровоцировать развитие онкологии или укрепить уже существующую болезнь, поскольку злокачественные клетки «любят» белковые соединения;
- поскольку Tryptophan усиливает седативное воздействие антидепрессантов и успокоительных средств, то во время приема психотропных лекарственных средств лучше ограничить его потребление;
- не исключены аллергические реакции организма на аминокислоту, особенно если у человека индивидуальная непереносимость продуктов, ее содержащих.
Состав
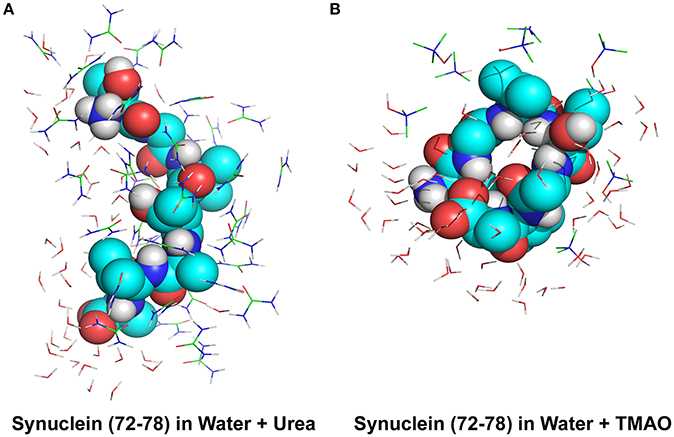
Альфа-синуклеин в растворе считается внутренне неупорядоченным белком , т. Е. Ему не хватает единой стабильной трехмерной структуры. По состоянию на 2014 год все больше сообщений предполагают наличие частичных структур или в основном структурированных олигомерных состояний в структуре раствора альфа-синуклеина даже в отсутствие липидов. Эта тенденция также подтверждается большим количеством измерений отдельных молекул ( оптический пинцет ) на отдельных копиях мономерного альфа-синуклеина, а также на ковалентно усиленных димерах или тетрамерах альфа-синуклеина.
Альфа-синуклеин специфически активируется в дискретной популяции пресинаптических окончаний мозга в период синаптической перестройки, связанной с приобретением. Было показано, что альфа-синуклеин значительно взаимодействует с тубулином , и что альфа-синуклеин может обладать активностью в качестве потенциального белка , связанного с микротрубочками , такого как тау .
Недавние данные свидетельствуют о том, что альфа-синуклеин действует как молекулярный шаперон при образовании комплексов SNARE . В частности, он одновременно связывается с фосфолипидами плазматической мембраны через свой N-концевой домен и с синаптобревином -2 через свой C-концевой домен, что имеет повышенное значение во время синаптической активности. В самом деле, появляется все больше доказательств того, что альфа-синуклеин участвует в функционировании нейронального аппарата Гольджи и переносе пузырьков .
По-видимому, альфа-синуклеин необходим для нормального развития когнитивных функций. Нокаутные мыши с целевой инактивацией экспрессии альфа-синуклеина демонстрируют нарушение пространственного обучения и рабочей памяти.
Взаимодействие с липидными мембранами
Были собраны экспериментальные данные о взаимодействии альфа-синуклеина с мембраной и его участии в составе мембраны и ее обороте. Скрининг генома дрожжей показал, что несколько генов, отвечающих за метаболизм липидов и слияние митохондрий, играют роль в токсичности альфа-синуклеина. Напротив, уровни экспрессии альфа-синуклеина могут влиять на вязкость и относительное количество жирных кислот в липидном бислое.
Известно, что альфа-синуклеин напрямую связывается с липидными мембранами, связываясь с отрицательно заряженными поверхностями фосфолипидов . Альфа-синуклеин образует протяженную спиральную структуру на небольших однослойных пузырьках. Обнаружено преимущественное связывание с небольшими пузырьками. Связывание альфа-синуклеина с липидными мембранами оказывает комплексное воздействие на последние, изменяя структуру бислоя и приводя к образованию мелких пузырьков. Было показано, что альфа-синуклеин изгибает мембраны отрицательно заряженных фосфолипидных везикул и формирует канальцы из больших липидных везикул. С помощью крио-ЭМ было показано, что это мицеллярные трубки диаметром ~ 5-6 нм. Также было показано, что альфа-синуклеин образует липидные дискообразные частицы, подобные аполипопротеинам . Исследования ЭПР показали, что структура альфа-синуклеина зависит от поверхности связывания. Белок принимает конформацию разорванной спирали на липопротеиновых частицах, в то время как он образует протяженную спиральную структуру на липидных везикулах и мембранных трубках. Исследования также показали возможную антиоксидантную активность альфа-синуклеина в мембране.
Микрофотографии областей черной субстанции у пациента, на которых видны тельца Леви и нейриты Леви при различном увеличении
Мембранное взаимодействие альфа-синуклеина модулирует или влияет на скорость его агрегации. Мембранно-опосредованная модуляция агрегации очень похожа на наблюдаемую для других амилоидных белков, таких как IAPP и abeta. Агрегированные состояния альфа-синуклеина проникают через мембрану липидных везикул. Они образуются при взаимодействии с полиненасыщенными жирными кислотами (ПНЖК), склонными к перекисному окислению, но не с мононенасыщенными жирными кислотами, а связывание переходных металлов, способствующих самоокислению липидов, таких как железо или медь, вызывает олигомеризацию альфа-синуклеина. Агрегированный альфа-синуклеин обладает специфической активностью в отношении перекисных липидов и вызывает автоокисление липидов в богатых ПНЖК мембранах как нейронов, так и астроцитов, снижая устойчивость к апоптозу. Автоокисление липидов подавляется, если клетки предварительно инкубируют с усиленными изотопами PUFA (D-PUFA).
Когда и как сдают анализ?
Альбумины в крови определяют, главным образом, с целью оценить качество обменных реакций с участием белков. Кроме этого, данный анализ нередко помогает проводить динамическое наблюдение за состоянием больных, страдающих онкологическими заболеваниями, печеночной, почечной, сердечной патологией, а также перенесших тяжелые травмы и ожоги.
Кровь у пациента берут из вены утром натощак, при этом, всегда учитывают, что белок «не любит» длительного пережатия сосуда жгутом, усердной работы «кулачком», интенсивного физического напряжения и продолжительного пребывания в вертикальном положении. Эти факторы способны повышать концентрацию белка в крови до 12%, то есть, искажать результаты исследования.
Выражение ткани
Альфа-синуклеин — это синуклеиновый белок неизвестной функции, который в основном обнаруживается в нервной ткани , составляя до 1% всех белков в цитозоле клеток мозга. Он преимущественно экспрессируется в неокортексе , гиппокампе , черной субстанции , таламусе и мозжечке . Это преимущественно нейрональный белок, но его также можно найти в нейроглиальных клетках . В меланоцитарных клетках экспрессия белка SNCA может регулироваться MITF .
Было установлено, что альфа-синуклеин широко локализован в ядре нейронов мозга млекопитающих, что позволяет предположить роль альфа-синуклеина в ядре. Однако синуклеин обнаруживается преимущественно на пресинаптических концах как в свободной, так и в мембраносвязанной формах, при этом примерно 15% синуклеина в нейронах в любой момент связаны с мембраной.
Также было показано, что альфа-синуклеин локализован в митохондриях нейронов . Альфа-синуклеин высоко экспрессируется в митохондриях обонятельной луковицы , гиппокампа, полосатого тела и таламуса, где также богат цитозольный альфа-синуклеин. Однако кора головного мозга и мозжечок являются двумя исключениями, которые содержат богатый цитозольный альфа-синуклеин, но очень низкие уровни митохондриального альфа-синуклеина. Было показано, что альфа-синуклеин локализован во внутренней мембране митохондрий и что ингибирующий эффект альфа-синуклеина на активность комплекса I дыхательной цепи митохондрий зависит от дозы. Таким образом, предполагается, что альфа-синуклеин в митохондриях по-разному экспрессируется в разных областях мозга, и фоновые уровни митохондриального альфа-синуклеина могут быть потенциальным фактором, влияющим на функцию митохондрий и предрасполагающим некоторые нейроны к дегенерации.
По крайней мере, три изоформы синуклеина продуцируются посредством альтернативного сплайсинга . Основная форма белка и наиболее изученная — это полноразмерный белок, состоящий из 140 аминокислот. Другие изоформы — это альфа-синуклеин-126, в котором отсутствуют остатки 41-54 из-за потери экзона 3; и альфа-синуклеин-112, в котором отсутствуют остатки 103-130 из-за потери экзона 5.
Выявление GBA-ассоциированной БП
Нами, как и в предыдущих исследованиях не показано различия уровня общего и олигомерного альфа-синуклеина в плазме крови между пациентами с БП и в контрольной группе (Hong et al., 2010; Shi et al., 2010; Foulds et al., 2011; Park et al., 2011). При этом следует отметить, что всего в одно из перечисленных выше исследований вошла группа пациентов, не получающих терапию Л-ДОФА-содержащими препаратами.
Рядом исследователей в последние годы изучалась возможность оценки уровня периферического альфа-синуклеина в качестве прогностического маркера БП. Однако до настоящего момента вопрос остается открытым. Исследования по сопоставлению уровня мономерного альфа-синуклеина лимфоцитов периферической крови, плазмы и СМЖ у пациентов с БП и в контрольной группе носят противоречивый характер (Таблица 2, п.1.3.5). Уровень альфа-синуклеина в различных фракциях клеток мог быть как повышен, так и понижен или не изменяться у пациентов с БП по сравнению с лицами контрольной группы. Так, отмечалось, что уровень альфа-синуклеина не имел статистически значимых отличий у пациентов с БП и у лиц контрольной группы (Brighina et al., 2010), аналогичные результаты были получены для альфа-синуклеина плазмы крови в группе пациентов с БП и в контрольной группе (Shi et al., 2010). Измерение уровня альфа-синуклеина в СМЖ также не продемонстрировало статистически значимых отличий между сравниваемыми группами (Aerts et al., 2012).
Большое внимание было уделено разработке методов оценки олигомерных форм альфа-синуклеина, т.к. показано, что именно эти формы белка обладают нейротоксическим эффектом (Winner et al., 2011)
На сегодня исследования по изучению олигомерных форм альфа-синуклеина в периферических жидкостях человека остаются малочисленными. Так, сопоставление уровня олигомерного альфа-синуклеина в СМЖ пациентов с болезнью Паркинсона и у лиц контрольной группы выявило повышение уровня олигомерных форм у пациентов в четырех исследованиях (Tokuda et al., 2010; Bruggink et al., 2011; Park et al., 2011; Unterberger et al., 2014). В плазме крови уровень олигомерного альфа-синуклеина был оценен также в нескольких работах. El-Agnaf с соавторами (2006) сообщает о повышении уровня олигомерного альфа-синуклеина у пациентов с БП, в то время как в более поздних исследованиях различий не обнаружено (Foulds et al., 2011; Park et al., 2011). Необходимо подчеркнуть, что в первое исследование были включены пациенты с БП, принимающие Л-ДОФА-содержащие препараты, приводящие к повышению уровня дофамина в плазме крови, что может влиять на уровень альфа-синуклеина. В наше исследование, а также в исследование Park с соавторами, были включены пациенты с БП, не получавшие лечения Л-ДОФА содержащими препаратами.
Суммируя полученные результаты можно предположить, что использование уровня общего и олигомерного альфа-синуклеина в плазме крови не является перспективным направлением поиска биомаркера заболевания. Анализируя данные литературы, можно сделать вывод об увеличении уровня олигомерного альфа-синуклеина в СМЖ, что свидетельствует о потенциальной возможности рассмотрения данной формы альфа-синуклеина в качестве биомаркера БП, однако это не являлось предметом данного исследования.
В ходе данного исследования нами была проведена оценка уровня олигомерного альфа-синуклеина в плазме крови у пациентов с однородной по этиологии GBA-ассоциированной БП. Всего в группу вошли 17 пациентов. Медиана концентрации олигомерного альфа-синуклеина в группе пациентов с GBA-ассоциированной БП составила (медиана (мин., макс.) — 1,75 (0,48 — 1259,41)).
Было получено статистически значимое увеличение уровня олигомерного альфа-синуклеина в плазме у пациентов с GBA-ассоциированной БП по сравнению с лицами контрольной группы (p=0,002) и пациентами со спорадической БП (p=0,004) (Рисунок 20). В настоящее время существует ряд гипотез о том, каким образом мутации в гене GBA столь значительно влияют на риск развития БП, включая гипотезу «gain-of-function», предполагающую непосредственное конформационное взаимодействии мутантной молекулы GBA c альфа-синуклеином (Cullen et al., 2011). Существует несколько гипотез, объясняющих возможные механизмы олигомеризации альфа-синуклеина при снижении ферментативной активности GBA.
Во-первых, аккумуляция глюкоцереброзида, происходящая при снижении ферментативной активности GBA, может приводить к изменениям в липидном составе мембран, что может влиять на уровень несвязанного альфа-синуклеина в клетке, потому как около половины всего клеточного альфа-синуклеина связано с липидами мембран (McGlinchey et al., 2013).
Лечение ATTR-амилоидоза
До недавнего времени единственным методом лечения ATTR-амилоидоза была трансплантация печени, секретирующей
нормальный транстиретин. Поскольку 98% всего сывороточного транстиретина синтезируется печенью, это позволяло
прервать продукцию мутантного транстиретина. Трансплантация печени существенно замедляет прогрессирование
ATTR-амилоидоза, а 20летняя выживаемость больных после трансплантации составляла 55,3% . Однако уже
имеющиеся массы амилоида способны выступать в роли ядра нуклеации для новых депозитов амилоида на основе
нормального транстиретина (амилоидускоряющая субстанция). В настоящее время у больных с ранними стадиями
ATTRамилоидной полиневропатии апробированы консервативные методы стабилизации тетрамерной структуры мутантного
транстиретина и, следовательно, подавления его амилоидогенности. Один из таких препаратов – тафамидис замедлял
на 52% (р=0,027) прогрессиро вание неврологических нарушений у больных ATTRамилоидозом, сохраняя функцию
периферических соматических и автономных нервных волокон . В клиническом исследовании III фазы лечение
тафамидисом по сравнению с плацебо у больных с ATTR-амилоидозом сердца вызывало снижение общей смертности и
частоты госпитализаций по сердечно-сосудистым причинам и задерживало ухудшение функциональной активности . В
Российской Федерации применение тафамидиса зарегистрировано только для лечения ATTR-амилоидоза с периферической
полиневропатией.
Показания к анализу
Исследование белковых фракций позволяет диагностировать синдром иммунодефицита, онкологические и аутоиммунные процессы.
Также врач может назначить протеинограмму в следующих случаях:
- оценка тяжести течения воспалительных или инфекционных процессов (в острой и хронической форме);
- диагностика заболеваний печени (гепатиты) и почек (нефротический синдром);
- определение продолжительности заболевания, формы (острая, хроническая), стадии, а также контроль эффективности терапии;
- диагностика моно- и поликлональных гаммапатий;
- диагностика и лечение диффузных поражений соединительной ткани, в том числе коллагенозов (ее системное разрушение);
- наблюдение пациентов с нарушенным метаболизмом, режимом питания;
- мониторинг состояния больных с синдромом мальабсорбции (нарушение пищеварения и всасывания питательных компонентов);
- подозрение на множественную миелому, характеризующуюся симптомами: хроническая слабость, лихорадка, частые переломы и смещения, ломота в костях, инфекционные процессы в хронической форме.
- При отклонениях в лабораторных анализах, позволяющих заподозрить множественную миелому: гиперкальциемии, гипоальбуминемии, лейкопении и анемии.
- При подозрении на недостаточность альфа-1-антитрипсина, болезнь Брутона и другие иммунодефициты.
Исследование белковых фракций в крови (протеинограмма) выявляют концентрацию общего белка, количественное соотношение альбуминов и глобулинов.
Общие сведения
Одним из основных компонентов крови является белок, который состоит из фракций (альбумина и нескольких видов глобулинов), образующих определенную формулу количественного и структурного соотношения. При воспалительных (острых и хронических) процессах, а также при онкологических патологиях формула белковых фракций нарушается, что позволяет оценить физиологическое состояние организма и диагностировать ряд серьезных заболеваний.
Под действием электрического поля (на практике применяется электрофорез) белок разделяется на 5-6 фракций, которые отличаются по местоположению, подвижности, структуре и доле в общей белковой массе.
Самая главная фракция — альбумин — составляет более 40-60% объема общего белка сыворотки крови.
Другие фракции представляют собой глобулины:
Альфа-1
К ним относятся белки острой фазы (быстрого реагирования):
- антитрипсин — блокирует протеолитические ферменты (при воспалительном процессе в легочной ткани подавляет функцию эластазы, предотвращая деградацию эластина в стенках альвеол и развитие эмфиземы легких);
- кислый гликопротеин (орозомукоид) — способствует фибриллогенезу;
- липопротеины отвечают за доставку липидов к другим клеткам;
- транспортные белки связывают и перемещают важные гормоны организма (кортизол, тироксин).
Альфа-2
Также включают белки острой фазы:
- макроглобулин активизирует защитные процессы организма при инфекционных и воспалительных поражениях;
- гаптоглобин соединяется с гемоглобином;
- церулоплазмин определяет и связывает ионы меди, нейтрализует свободные радикалы и является окислительным ферментом для витамина С, адреналина;
- липопротеины обеспечивают перемещение жиров.
Бета
К этой группе относят белки:
- трансферрин — обеспечивает перемещение железа;
- гемопексин — препятствует потере железа, связывает гемоглобин, миоглобин, каталазу, доставляет их в печень, где происходит распад гема и связывание железа с ферритином.
- комплементы — участвуют в иммунном отклике;
- бета-липопротеины — перемещают фосфолипиды и холестерин;
- некоторые иммуноглобулины — также обеспечивают иммунную реакцию.
Гамма
Фракция включает важнейшие белки иммуноглобулины разных классов (IgА, IgМ, IgЕ, IgG), которые являются антителами и отвечают за местный и общий иммунитет организма.
В результате развития острых или обострения хронических воспалительных заболеваний соотношение белковых фракций изменяется. Уменьшение количества того или иного вида белка может наблюдаться при иммунодефицитах, которые свидетельствуют о серьезных процессах в организме (аутоиммунные заболевания, ВИЧ, онкология и т.д.). Избыток зачастую свидетельствует о моноклональной гаммапатии (производство аномальных типов иммуноглобулинов). К последствиям гаммапатии можно отнести множественную миелому (рак плазматических клеток), макроглобулинемию Вальденстрема (опухоль костного мозга) и т.д. Также может возникнуть поликлональная гаммапатия (секреция аномального количества иммуноглобулинов). Результатом являются инфекционные болезни, аутоиммунные патологии, заболевания печени (например, вирусные гепатиты) и другие хронические процессы.



























![Железобактерии и железо [1968 лысогоров н.в. - когда отступает фантастика]](http://mediaex.ru/wp-content/uploads/5/8/3/583b8e856dbbe55ee82b2892195f2836.jpeg)