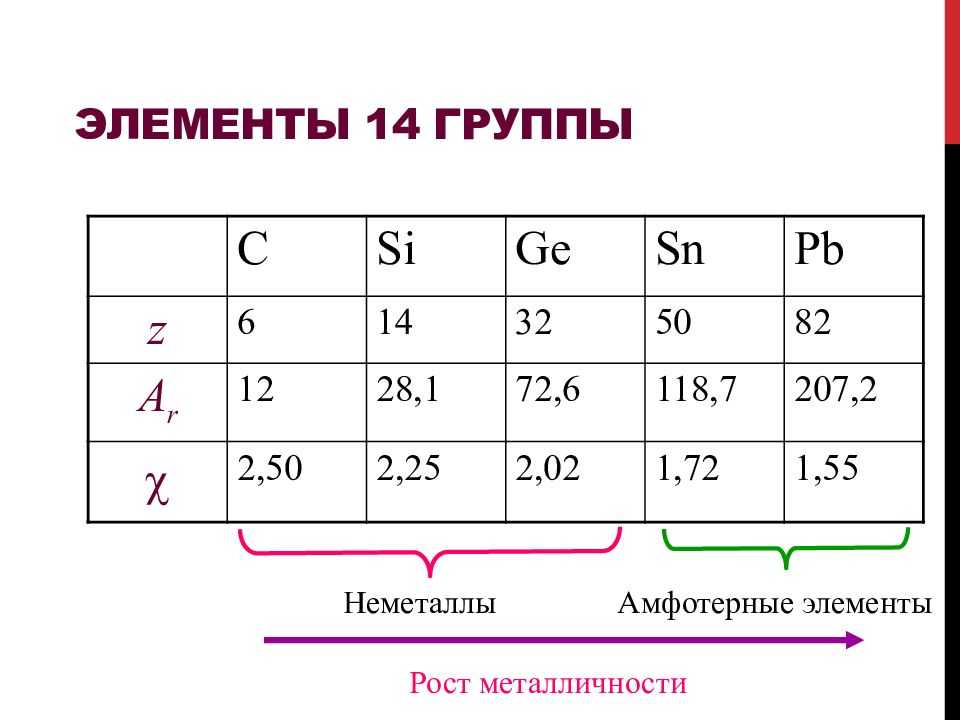
Литература[править | править код]
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
- Китай ввел пошлины на ввоз поликристаллического кремния «солнечного» качества из США… Под их действие не попадает поликремний «электронного» качества, предназначенный, в частности, для изготовления чипов… // 2014
| H | He | |||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | |||||||||||||||||||||||||
| Iа | IIа | IIIб | IIIб: лантаноиды и актиноиды и Суперактиноиды | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||||||||||||||
Получение[править | править код]
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Химические свойства[править | править код]
Схема атома кремния
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiС (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Биологическое воздействие
Как и в литосфере, в организме человека кремний – один из топовых макроэлементов (до 4%).
О нехватке вещества сигнализирует следующие факторы:
- Тусклость, ломкость волос, ногтей.
- Сухость кожи.
- Частые ОРВИ, ОРЗ.
- Учащенное сердцебиение.
- Ослабленность скелета (позвоночные боли, остеопороз).
- Бесплодие.
Плюс пониженный иммунитет. У детей – замедление роста и общего развития.
Пополнить запас микроэлемента помогают продукты.
Больше всего вещества в продуктах, богатых клетчаткой:
- Необработанные крупы: рис, овес, ячмень, гречка.
- Все бобовые.
- Орехи, овощи, ягоды, фрукты,
В «животном» сегменте это мясо, яйца, морепродукты, молоко.
Физические свойства[править | править код]
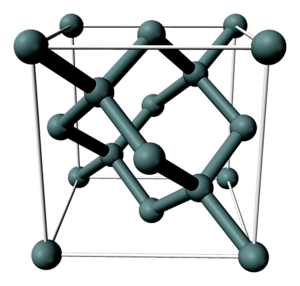
Кристаллическая структура кремния.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению начиная с длинны волны 1.1 микрометр. Обладая самым высоким коэффициетом преломления (n = 3,4), прозрачностью, пропусканию инфракрасеых лучей он нашёл широкое применение в изготовлении оптических систем (объективов, биноклей ночного видения, в медицине — контактных линз и т.д.)
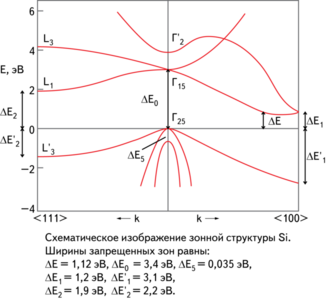
Схематическое изображение зонной структуры кремния
Электрофизические свойстваправить | править код
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ . Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 0,15 м²/в·с (или 1500 cм²/в·с ).
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2019). Кремний. Получено с: en.wikipedia.org
- MicroChemicals. (н.д.). Кристаллография кремния. Получено с: microchemicals.com
- Lenntech B.V. (2019). Таблица Менделеева: кремний. Получено с: lenntech.com
- Маркес Мигель. (н.д.). Возникновение кремния. Получено с: nautilus.fis.uc.pt
- Больше Hemant. (5 ноября 2017 г.). Кремний. Получено с: hemantmore.org.in
- Пилгаард Майкл. (22 августа 2018 г.). Кремний: появление, выделение и синтез. Получено с: pilgaardelements.com
- Доктор Дуг Стюарт. (2019). Факты об элементе кремния. Chemicool. Получено с: chemicool.com
- Кристиана Хонсберг и Стюарт Боуден. (2019). Сборник ресурсов для преподавателей фотоэлектрических систем. PVобразование. Получено с: pveducation.org
- Американский химический совет, Inc. (2019). Силиконы в повседневной жизни. Получено с: sehsc.americanchemistry.com
Химические свойства кремния
Si + O2 → SiO2 (при температуре).
При нагревании кремний как неметалл образует соединения с различными металлами. Такие соединения называются силицидами. Например:
2Ca + Si → Ca2Si (при температуре).
Силициды, в свою очередь, без затруднений разлагаются при помощи воды или некоторых кислот. В результате данной реакции образуется особое водородное соединение кремния – газ силан (SiH4):
Кремний также способен взаимодействовать с фтором (при нормальных условиях):
Si + 2F2 → SiF4.
А при нагревании кремний взаимодействует с другими неметаллами:
Si + 2Cl2 → SiCl4 (400–600°).
3Si + 2N2 → Si3N4 (1000°).
Si + C → SiC (2000°).
Также кремний, взаимодействуя со щелочами и водой, образует соли, называемые силикатами, и газ водород:
Si + 2KOH + H2O → K2SiO3 + H2.
Однако большинство химических свойств данного элемента мы разберем, рассматривая кремний и его соединения, так как именно они являются основными веществами, на которых основано применение и взаимодействие кремния с другими химическими элементами. Итак, какие же соединения кремния являются наиболее распространенными?
Структура и электронная конфигурация
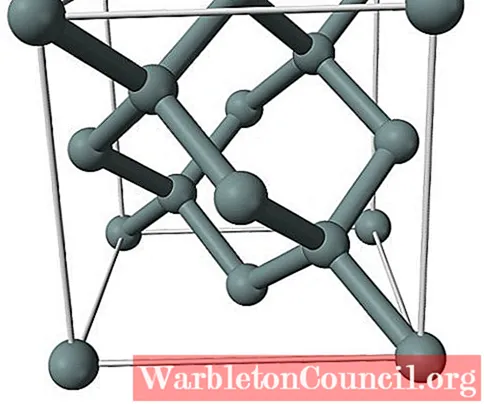
На изображении выше показана гранецентрированная кубическая структура (ГЦК), такая же, как у алмаза, для кристалла кремния. Серые сферы соответствуют атомам Si, которые, как видно, ковалентно связаны друг с другом; кроме того, они имеют тетраэдрическое окружение, воспроизводимое вдоль кристалла.
Кристалл кремния является ГЦК, потому что атом Si находится на каждой из граней куба (6 × 1/2). Точно так же есть восемь атомов Si в вершинах куба (8 × 1/8) и четыре, расположенных внутри него (те, которые показывают четко определенный тетраэдр вокруг них, 4 × 1).
При этом каждая элементарная ячейка содержит в общей сложности восемь атомов кремния (3 + 1 + 4, числа указаны в абзаце выше); характеристика, которая помогает объяснить его высокую твердость и жесткость, поскольку чистый кремний представляет собой ковалентный кристалл, подобный алмазу.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Качества вещества

Силиций был впервые выделен в 1824 году шведским химиком Йенсом Якобом Берцелиусом, который также обнаружил церий, селен и торий, согласно Фонду химического наследия. Ученый нагревал кремнезем с калием, чтобы очистить кремний. Сегодня процесс получения выглядит иначе — происходит нагревание углерода с кремнеземом в форме песка, чтобы изолировать элемент.
Кремний не является ни металлом, ни неметаллом: это металлоид, элемент, который находится где-то посередине. Эта категория — серая область, нет четкого определения того, каким требованиям она отвечает. Но металлоиды обычно имеют свойства как металлов, так и неметаллов. Кремний является полупроводником, это означает, что он проводит электричество. Однако, в отличие от типичного металла, он лучше проводит ток при повышении температуры (металлы же ухудшают проводимость повышенных температурах).

Кремний находит применение и в производстве низкотехнологичных творений, таких как кирпичи и керамика. При присоединении водорода к оксиду силиция образуется гидроксид. Гидрозоли кремниевых кислот применяют в фототехнике, а также в качестве адсорбентов. Но высокотехнологичные изделия — сфера, где элемент действительно оставляет видимый след. В качестве полупроводника кремний используется для изготовления транзисторов, которые усиливают или переключают электрические токи и являются основой электроники от радиоприемников до смартфонов.
Кремний по-разному используется в солнечных элементах и компьютерных микросхемах, одним из примеров является полевой транзистор с оксидом металла и полупроводника, основной переключатель во многих электронных устройствах. Создавая пространства из чистого силиция, инженеры получают зазор, в котором электроны не могут течь — это как переключатель в положении «выключено».
https://youtube.com/watch?v=1M7bSz4QH-M
Электроны с отрицательным зарядом притягиваются к положительному заряду, что позволяет им совершать прыжок через сегмент чистого кремния. (Другие полупроводники, кроме кремния, также могут использоваться в транзисторах.)
Производство неметалла

Получить чистый кремний не так уж и просто, учитывая инертность его соединений и высокую температуру плавления большинства из них. В промышленности чаще всего прибегают к восстановлению углеродом из диоксида. Проводят реакцию в дуговых печах при температуре 1800 С. Таким образом получают неметалл чистотой в 99,9%, что для его применения недостаточно.
Полученный материал хлорируют с тем, чтобы получить хлориды и гидрохлориды. Затем соединения очищают всеми возможными методами от примесей и восстанавливают водородом.
Очистить вещество можно и за счет получения силицида магния. Силицид подвергают действию соляной или уксусной кислоты. Получают силан, а последний очищают различными способами – сорбционным, ректификацией и так далее. Затем силан разлагают на водород и кремний при температуре в 1000 С. В этом случае получают вещество с долей примеси 10-8–10-6%.
Химические свойства кремния
Как и углерод, кремний может быть и восстановителем, и окислителем, в зависимости от того, с каким веществом вступает в реакцию.
При н.у. кремний взаимодействует только с фтором, что объясняется достаточно прочной кристаллической решеткой кремния.
В реакцию с хлором и бромом кремний вступает при температурах, превышающих 400°C.
С углеродом и азотом кремний взаимодействует только при очень высоких температурах.
- В реакциях с неметаллами кремний выступает в роли восстановителя:
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
Si + 2F2 = SiF4 - при высоких температурах кремний реагирует с хлором (400°C), кислородом (600°C), азотом (1000°C), углеродом (2000°C):
- Si + 2Cl2 = SiCl4 — галогенид кремния;
- Si + O2 = SiO2 — оксид кремния;
- 3Si + 2N2 = Si3N4 — нитрид кремния;
- Si + C = SiC — карборунд (карбид кремния)
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
- В реакциях с металлами кремний является окислителем (образуются салициды:Si + 2Mg = Mg2Si
- В реакциях с концентрированными р-рами щелочей кремний реагирует с выделением водорода, образуя растворимые соли кремниевой кислоты, называемые силикатами: Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
- С кислотами (за исключением HF) кремний не реагирует.
Применение

Области применения кремния трудно перечислить:
- стекла;
- цемент;
- зажигалки;
- оптоволокно;
- керамика;
- микропроцессоры.
В любой зубной пасте есть Е551 — аморфный диоксид кремния.
На основе кремниевых полупроводников устроены почти все электронные приборы.
Большинство наших домов на 20-40%% состоят из кремниевых минералов.
Нитриты и карбиды кремния — одни из самых твердых соединений. Они входят в состав особой жаропрочной и твердой керамики. Ее используют в производстве бронежилетов, абразивы (абразивные диски для всем известных болгарок). Рекомендуем: ТАНТАЛ — твёрдый, редкий и дорогой
Как сырье технической чистоты Silicium применяют:
- В металлургии (как присадки, как раскислители в производстве чугуна и сталей).
- В производстве силанов и кремнийорганических материалов.
- В производстве солнечных батарей.
Синтетические SiC под названием муассанита с успехом заменяют алмазы в ювелирной промышленности.
Продукцией из песка, соды и извести стеклом — пользуются миллионы людей.
Красота и здоровье: полуметалл необходим человеческому организму для костей, волос, здоровой кожи. А силикон — материал, с помощью которого женщины исправляют свои формы.
Химические свойства оксида кремния
Диоксид кремния взаимодействует с огромным количеством химических элементов – как металлов, так и неметаллов. Например:
- При высоких температурах кремнезем взаимодействует со щелочами, образуя при этом соли:
SiO2 + 2KOH → K2SiO3 + H2O (при температуре).
- Как типичный кислотный оксид, данное соединение дает силикаты в результате взаимодействия с оксидами различных металлов:
SiO2 + CaO → CaSiO3 (при температуре).
- Или с карбонатными солями:
- Одно из важнейших химических свойств диоксида кремния – это возможность получения из него чистого кремния. Это можно осуществить двумя способами – при взаимодействии диоксида с магнием или углеродом:
SiO2 + 2Mg → 2MgO + Si (при температуре).
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
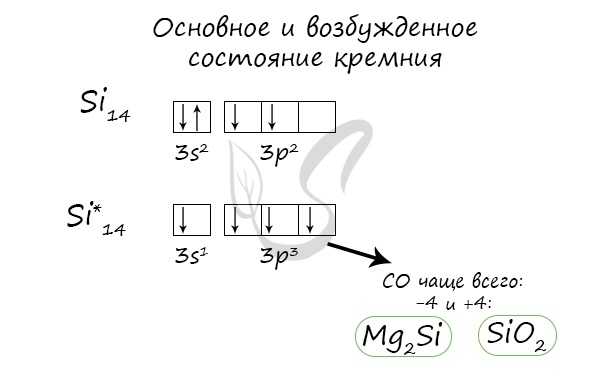
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s23p2.
В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns1np3.
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:
У кремния возможны следующие степени окисления: -4, +2, +4.
Поликристаллический кремний
В отличие от других синтезов или производств, получение поликристаллического кремния начинается с газовой фазы силана, SiH4. Этот газ подвергается пиролизу при температуре выше 500 ºC, так что происходит термическое разложение и, таким образом, из его исходных паров поликристаллы кремния осаждаются на поверхности полупроводника.
Следующее химическое уравнение иллюстрирует протекающую реакцию:
Да H4(g) => Si (s) + H2(грамм)
Очевидно, что в камере не должно быть кислорода, так как он будет реагировать с SiH.4:
Да H4(г) + 2O2(г) => SiO2(s) + 2H2O (г)
И реакция горения такова, что она происходит быстро при комнатной температуре с минимальным воздействием воздуха на силан.
Другой синтетический путь для производства этого типа кремния начинается с кристаллического кремния в качестве сырья. Они заставляют его реагировать с хлористым водородом при температуре около 300 ºC, в результате чего образуется трихлорсилан:
Si (т.) + 3HCl (г) => SiCl3H (г) + H2(грамм)
И SiCl3H реагирует при 1100 ° C, чтобы регенерировать кремний, но теперь поликристаллический:
4SiCl3H (г) => Si (т) + 3SiCl4(г) + 2Н2(грамм)
Просто посмотрите на уравнения, чтобы получить представление о работе и строгих производственных параметрах, которые необходимо учитывать.
Химические свойства
Схема атома кремния
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiС (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Химические свойства кремния
У кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
- Реакции с неметаллами
| Кремний не реагирует с водородом и фосфором в силу близких значений электроотрицательностей! |
- Реакция со щелочами
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:
- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:
Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):
(оксид кремния(IV) входит в состав песка, который мы видим на улице)
Получение кремния
Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.

- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.

Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Заключение
Итак, мы выяснили, что кремний является важнейшим химическим элементом, широко распространенным в природе. Кремний применяется при строительстве и художественной деятельности, а также незаменим для живых организмов. Многие вещества, начиная от простого стекла и заканчивая ценнейшим фарфором, имеют в своем составе кремний и его соединения.
Изучение химии позволяет познать окружающий наш мир и понять, что не все вокруг, даже самое великолепное и дорогое, настолько таинственно и загадочно, как могло показаться. Желаем успехов в научном познании и изучении такой прекрасной науки, как химия!
Заключение
Итак, мы выяснили, что кремний является важнейшим химическим элементом, широко распространенным в природе. Кремний применяется при строительстве и художественной деятельности, а также незаменим для живых организмов. Многие вещества, начиная от простого стекла и заканчивая ценнейшим фарфором, имеют в своем составе кремний и его соединения.
Изучение химии позволяет познать окружающий наш мир и понять, что не все вокруг, даже самое великолепное и дорогое, настолько таинственно и загадочно, как могло показаться. Желаем успехов в научном познании и изучении такой прекрасной науки, как химия!