Состояние вопроса
В ходе длительных исследований достоверно установлено, что антибактериальный эффект препаратов бактериофагов основан на внедрении генома фага в клетку бактерии с последующим его размножением внутри ее и лизисом инфицированной клетки. После выхода во внешнюю среду фаги повторно инфицируют и лизируют другие клетки до полного уничтожения патогенных бактерий в очаге воспаления.
Бактериофаги отличаются высокой специфичностью действия в отношении штаммов-хозяев, отсутствием токсичности, не способностью вызывать аллергические реакции и дисбактериоз. Они могут применяться в качестве самостоятельного лекарственного средства, а так же совместно с антибиотиками и иммуноукрепляющими препаратами.
Также в разделе
|
Особенности дренирования операционной раны при грыжах живота А.В.Юрасов Доктор медицинских наук, Российский Научный Центр Хирургии РАМН, Москва Дренирование ран и полостей является важным элементом абсолютного… |
|
|
Роль витаминных комплексов в профилактике и лечении заболеваний внутренних органов Ших Е.В. Витаминный статус Многие широко распространенные в наше время неспецифические симптомы, такие как повышенная утомляемость, раздражительность,… |
|
| Гендерні особливості провідних факторів ризику, які визначають розвиток і перебіг інфаркту міокарда. Суттєвий успіх щодо зниження смертності від ішемічної хвороби серця (ІХС) та інфаркту міокарда (ІМ), якого досягли протягом останніх десятиріч у більшості країн… | |
| Что такое аминокислота? Аминокислоты являются основным «строительным материалом» для синтеза специфических тканевых белков, ферментов, пептидных гормонов и других физиологически… | |
|
Применение пайлер-терапии в комплексном лечении пострадавших с травматическими повреждениями челюстно-лицевой области Т.Н. Хахелева, д.мед.н., профессор И.Н. Матрос-Таранец, к.мед.н. Д.К. Калиновский Донецкий государственный медицинский университет им. М.Горького, Кафедра… |
|
|
Способы подготовки шейки матки к родам Глаголева Е.А., Михайлова О.И., Балушкина А.А. Проблема рационального подхода к прединдукционной подготовке шейки матки является одной из наиболее сложных и… |
|
|
Психосоциальный стресс и метаболизм липидов: концепция факторов риска и новый подход к профилактике сердечно-сосудистых заболеваний Гарганеева Н.П. Современная медицина поддерживает концепцию факторов риска (ФР) как возможных причин развития и прогрессирования мультифакториальных… |
|
|
Почему российские пациенты лечатся в Германии? Д-р Виктор Крамер Главный медицинский консультант международного института здравоохранения г. Мюнхена, Германия Сотрудники международного института… |
|
|
Специфическая иммунотерапия атопических заболеваний Профессор Л.А. Горячкина РМАПО, Москва Профессор Н.Г. Астафьева Саратовский медицинский университет Антигенспецифическая иммунопрофилактика впервые… |
|
|
Органы грудной клетки здорового человека в рентгеновском изображении К.м.н. Р.Ф. Саламов, к.м.н. Н.А. Семенова Кафедра рентгенологии и радиологии РГМУ Теневая картина органов грудной клетки представляет собой плоскостное… |
Морфология и структура
Как и прочие вирусы, во внеклеточной форме бактериофаги являются метаболически инертными частицами. Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, строению фаговой частицы, морфологии негативных колоний, характеру взаимодействия с микробными клетками.
Для обозначения бактериофагов используются буквы латинского и греческого алфавитов. В частности хорошо изучены фаги кишечной палочки: λ, ϕX174, fd, f2, R17, Т2.
Большинство из фагов относятся к сложным вирусам и состоят из хорошо сформированной икосаэдрической (кубической) головки и хвоста (отростка) различной степени выраженности, иногда имеющего дополнительные структуры. Все структуры отростка имеют белковую природу. Размер фага колеблется от 20 до 200 нм. Средний диаметр головки – от 60 до 100 нм, длина отростка – 100–200 нм. Длина хвоста, как правило, в 2–4 разабольше диаметра головки.
Головка состоит из генетического материала (двух цепочечной или одноцепочечной нуклеиновой кислоты (РНК или ДНК) с ферментом транскрипаза в неактивном состоянии) и капсида (белковой оболочки). Нуклеиновая кислота и капсид вместе образуют нуклеокапсид.
При каких заболеваниях применяют бактериофаги?
На каждую бактерию существует свой фаг, и теоретически возможности для их применения безграничны. Нужно лишь найти подходящего «хищника», способного уничтожать возбудителей инфекции. Это в теории, а на практике всё немного сложнее (об ограничениях фаготерапии еще поговорим ниже). Тем не менее препараты бактериофагов уже находят применение при многих заболеваниях:
Применяют фаготерапию и для профилактики: раствором обрабатывают свежие и послеоперационные раны, дают его пациентам при высоком риске внутрибольничной инфекции (ведь бактерии, циркулирующие в клиниках, зачастую уже выработали устойчивость к антибиотикам).
Чаще всего препараты бактериофагов выпускают в виде растворов во флаконах. Применять их можно разными способами:
- Внутрь – то есть проглатывать.
- Промывать раны, делать примочки.
- Вводить турунды и тампоны, смоченные раствором, например, в носовую полость, влагалище.
- Закапывать в нос, глаза, уши.
- Полоскать рот, горло.
- Вдыхать в виде ингаляций. Но использовать можно только компрессорные ингаляторы (небулайзеры), где аэрозоль создается за счет сжатого воздуха. В ультразвуковых ингаляторах бактериофаги разрушаются.
- Вводить в различные органы и полости, например, в матку, мочевой пузырь, брюшную, плевральную полость.
- При системных инфекциях есть опыт введения препаратов бактериофагов внутривенно.
Есть и другие лекарственные формы, включая таблетки, мази, гели, суппозитории (свечи), суспензии, спреи, аэрозоли, губки.
Такое огромное количество показаний, способов введения и лекарственных форм стало возможно благодаря тому, что фаги совершенно не взаимодействуют с организмом человека. Они просто убивают опасные бактерии, а потом покидают тело. Некоторые бактериофаги становятся нашими постоянными сожителями еще с самого рождения. Они живут на коже, в кишечнике, дыхательных путях, органах мочеполовой системы, даже в крови и спинномозговой жидкости. Исследования показали, что бактериофаги из кишечника легко проникают через клетки слизистой оболочки прямо в кровеносные сосуды. Ученые пока не могут точно сказать, что «пожиратели бактерий» делают в кровотоке человека – возможно, помогают бороться с инфекциями. Так или иначе, это лишний раз доказывает, что для нас фаги совершенно безобидны.
Как подобрать правильные препараты для фаготерапии?
По своему отношению к микроорганизмам бактериофаги делятся на три группы:
- моновалентные – атакуют только бактерии определенного вида;
- поливалентные – способны поражать несколько родственных видов бактерий;
- типовые – самые привередливые, нападают лишь на бактерии определенного штамма (можно сказать, «породы») в пределах одного вида.
Препараты могут содержать только один вид бактериофагов или «коктейли» из нескольких видов. Так или иначе, чтобы лечение прошло эффективно, нужно подобрать фаг, к которому бактерии чувствительны. Для этого предварительно проводят пробы.
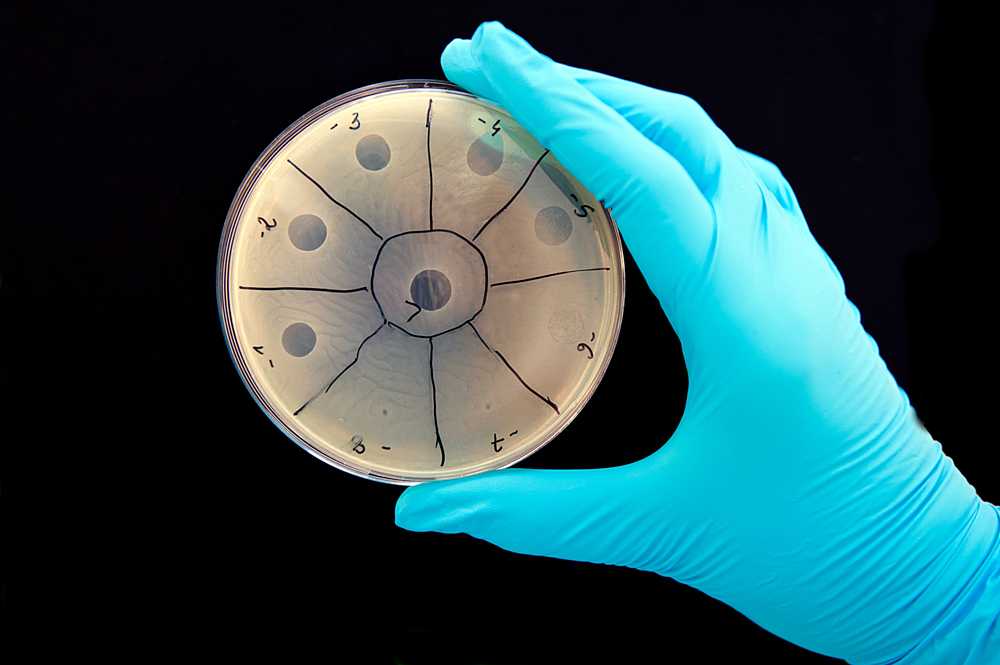
Для анализа пациент должен сдать какой-либо материал, в зависимости от характера инфекции: кровь, мочу, слюну, соскобы, мокроту, кал. Этот материал высевают на питательную среду, ждут, когда вырастет колония бактерий, а затем добавляют к ней растворы разных бактериофагов. Когда попадается нужный препарат, на колонии появляются полупрозрачные бляшки.
Почему в настоящее время растет интерес к фаготерапии?
Еще Александр Флеминг предупреждал, что антибиотики нельзя использовать бесконтрольно, иначе микроорганизмы приобретут к ним устойчивость. Но человечество не послушало ученого. Антибактериальные препараты до сих пор можно купить без рецепта и применять на свое усмотрение. Врачи тоже зачастую назначают их необоснованно. Антибиотики широко используют в ветеринарии, добавляют в средства гигиены. Это ускоряет эволюцию бактерий.
Яркий пример – золотистый стафилококк. Еще к середине 1940-х годов эта бактерия стала устойчивой к пенициллину, и с тех пор началась «гонка вооружений». Ученые создавали новые антибиотики, какое-то время они хорошо работали, а потом появлялись устойчивые микроорганизмы.
Кошмар современных врачей – метициллин-резистентные стафилококки, сокращенно MRSA. Именно их в СМИ часто называют «супербактериями». Против них уже не помогают ни пенициллины, ни цефалоспорины, ни более современные карбапенемы. Об этих микроорганизмах начали широко рассказывать относительно недавно, но на самом деле они появились еще в 1960-х годах. Против них остался единственный более-менее эффективный антибиотик – ванкомицин.
Не лучше обстоят дела и со многими другими инфекциями. Эксперты ВОЗ сообщают, что всё сложнее (а иногда и вовсе невозможно) становится лечить вызванные устойчивыми к антибиотикам бактериями пневмонии, туберкулез, пищевые инфекции, гонорею, сепсис. По данным ученых из США, в этой стране резистентными бактериями ежегодно заражается около двух миллионов людей, и 23 тысячи из них погибают.
При этом разработка новых антибактериальных препаратов становится всё сложнее, дольше и дороже. Ни одна фармкомпания не хочет этим заниматься: производители не видят смысла тратить огромные ресурсы на создание нового лекарства, которое спустя несколько лет всё равно перестанет действовать и не будет хорошо продаваться. На этом фоне стали возникать пессимистичные и даже панические настроения: некоторые ученые и врачи поговаривают, что из-за снижения эффективности антибиотиков мы можем откатиться в мрачное Средневековье, когда эпидемии уносили множество жизней.
Однако ученые не сдаются. Они активно ищут альтернативы антибиотиками, и одной из таких альтернатив может стать бактериофаготерапия. Плюс фагов в том, что они хорошо работают против бактерий, на которые перестали действовать антибиотики.
Какие проблемы возникают при использовании бактериофаготерапии?
В мире нет ничего идеального, и бактериофаги не исключение. Фаготерапия не панацея, с ее применением тоже возникают определенные проблемы:
- Узкий круг хозяев. Фаги уничтожают только определенные виды бактерий, и их нельзя подобрать «на глаз», как это зачастую получается с антибиотиками. Перед тем как начинать фаговую терапию, нужно провести анализы и проверить чувствительность микроорганизмов. Это требует определенного времени, а еще за анализы придется дополнительно платить. К тому же заранее неизвестно, насколько быстро получится найти подходящие фаги, и получится ли вообще.
- Бактерии могут вырабатывать устойчивость к бактериофагам. Ведь их эволюция тоже никогда не останавливалась, и они обзавелись массой способов защиты. Самый известный – бактериальная «иммунная система» – CRISPR-Cas. В ДНК бактерий есть вставки с копиями генетического материала фагов. Они с помощью специальной РНК могут распознавать вирусные гены, в итоге активируются специальные ферменты, которые разрушают «чужой» генетический материал. Хотя в теории можно быстро вывести новый эффективный вид фагов, на практике появляются некоторые трудности.
- Фаги могут усиливать устойчивость бактерий к антибиотикам. Умеренные бактериофаги могут встраивать в ДНК бактерий гены, в том числе связанные с антибиотикорезистентностью.
- Иммунная система человека сопротивляется лечению. Хотя фаги и безобидны для организма, они воспринимаются иммунитетом как чужеродные частицы. Иммунная система не понимает, что это ее помощники, и уничтожает их. Из-за этого активность фаготерапии снижается.
- Фаги действуют медленнее, чем антибиотики. Во многом именно из-за этого в прошлом веке антибактериальные препараты сильно потеснили бактериофаготерапию.
Новости
читать все
-
В Сеченовском университете будут учить проектировать суперсовременное медицинское оборудование
О планах ввести специальность «медицинский инженер» для подготовки специалистов, которые будут работать над импортозамещением современного и высококачественного медицинского оборудования в России, сообщил ТАСС ректор Сеченовского Университета, профессор, академик РАН Петр Глыбочко. «Введение специальности “медицинский инженер”, квалификация “специалист в области медицинского оборудования”, позволит решить проблему по подготовке специалистов, готовых к проектированию медицинского оборудования на основе современных
ЧитатьНаука
#сделано в России
15.08.2022
77
События -
Детский врач-эндокринолог подтвердила высокое качество российских инсулинов
В Санкт-Петербурге состоялось совещание между представителями Минпромторга, врачами, а также ведущими российскими производителями лекарств и медицинских изделий в области детской эндокринологии. На встрече обсуждали, как наладить бесперебойное снабжение пациентов современной высококачественной отечественной медицинской продукцией. Совещание проводилось под председательством директора Департамента развития фармацевтической и медицинской промышленности Минпромторга России Дмитрия Галкина и главного внештатного детского специалиста эндокринолога Минздрава России Валентины
ЧитатьЗдоровье и медицина
15.08.2022
38
События -
Россияне больше не будут угорать
О том, что в арсенале российских медиков появилось средство от отравления угарным газом, стало известно в ходе Международного военно-технического форума «Армия-2022». На Форуме «Армия-2022», важнейшем деловом и выставочном мероприятии в подмосковной Кубинке, традиционно демонстрируются, в частности, новейшие достижения военно-полевой медицины и фармацевтическая и медицинская продукция. В этом году достижения Федерального медико-биологического агентства представила его руководитель
ЧитатьПродукция
15.08.2022
47
События -
Ростех будет дорабатывать свою вакцину для защиты от оспы обезьян
Количество заболевших оспой обезьян во всем мире растет, и, хотя в России до сих пор зафиксирован лишь один случай этого заболевания и пациент уже выздоровел, ведущие иммунобиологические компании наготове. Так, в случае необходимости госкорпорация «Ростех» готова усовершенствовать свою вакцину от натуральной оспы для более эффективной защиты от оспы обезьян. Пока в России нет специфической вакцины
ЧитатьЗдоровье и медицина
15.08.2022
48
События
Живые организмы в противовес антибиотикам
Фаговая терапия рекомендуется лицам с аллергией на антибиотики, показана при беременности и не вызывает нарушение эмбрионального развития плода. Вakteriohaqum составляют достойную конкуренцию антибиотикам. Цель приема антибиотиков и бактериофагов совпадает, но неклеточная форма жизни обладает рядом преимуществ:
- Оказывают положительное влияние на состояние местного иммунитета, не разрушая этот защитный барьер.
- Проникают вглубь организма и действуют до тех пор, пока не уничтожат болезнетворную микрофлору. Происходит избирательное уничтожение: полезных микробов они не трогают.
- Возможно их использования параллельно с другими методами лечения. Доказано, что они усиливают действие антибиотиков.
-
У фагов нет побочных эффектов. Уничтожив вредоносных бактерий, они исчезают.
- Выражено воздействие при вялотекущем хроническом заболевании в том случае, когда бактерии приобрели устойчивость к антибиотикам, потеряли к ним чувствительность. Резистентность к вирусам у них не вырабатывается.
- Не нанесут вреда взрослым, детям (с первого года жизни), беременным, пожилым. Являются альтернативой для людей, склонных к аллергии на химические соединения в препаратах, а также страдающих от побочных эффектов на некоторые из них.
Но в микромире нет совершенства: bakteriohaqum воздействует на конкретный вид бактерии и не реагирует на других представителей царства микробов. К примеру, дизентерийный бактериофаг не способен уничтожить возбудителя брюшного тифа.
Чтобы препарат с определенным фагом в составе действовал результативно, необходим бактериологический посев для подтверждения диагноза.
На проверку бактерии, вызвавшей патологию, уходит 4-5 дней. Терапия длительная: чтобы уничтожить возбудителя заболевания лекарство принимают 1-2 недели. Для большей эффективности курсы повторяют 2-3 раза через небольшие промежутки времени.
Показания к применению и способы введения
Поскольку назначение бактериофагов — уничтожение патогенных микробов, то их активно включают в комплексную терапию при лечении ряда инфекционных заболеваний. Они способны побороться со следующими инфекциями:
- хирургическими (абсцесс, ожоги, гнойные раны);
- урогенитальными (цистит, пиелонефрит, кольпит);
- энтеральными (холецистит, дисбактериоз кишечника, гастроэнтероколит);
- ЛОР-заболеваниями (ангина, гайморит, отит);
-
болезнями органов дыхания (трахеит, бронхит, пневмония);
- заражением крови.
Метод введения bakteriohaqum в организм зависит от локализации очага воспаления. Исходя из ситуации, препарат с фагом в составе применяется внутрь (перорально), в виде клизмы (ректально), в качестве примочек, орошений, полосканий (местно). Для большей эффективности сочетают внутреннее и наружное применение активных вирусов: например, одновременно в виде примочки и таблетки.
Препараты с вирусами в составе не вводятся внутривенно или внутримышечно. Пить их несложно даже детям: они лишены вкуса и неприятного запаха. Появились препараты на основе бактериофагов в форме растворов, таблеток, гелей, аэрозолей, свечей. Биотехнологический метод лечения набирает обороты, защищая человека от опасных для жизни инфекций.
Как диагностируется патологическая слизь на задней стенке горла?
Синдром постназального затекания устанавливается на основании следующих диагностических методов:
- Физическое обследование. Врач осмотрит заднюю часть вашего горла, чтобы увидеть, есть ли покраснение или отек, и спросит о других признаках инфекции (таких как головные боли, лихорадка, озноб и мышечные боли).
- Риноскопия. Выявляются возможные патологии полости носа и пазух, которые могут приводить к данным симптомам (искривление носовой перегородки, ринит, полипозные разрастания в носу, воспаление глоточной миндалины).
- Инструментальное обследование. Сюда включается эндоскопическая риноскопия, назофарингоскопия, ларингоскопия (при которой используется эндоскоп для осмотра верхней части глотки), 24-часовой рН-зонд (при котором можно проверить наличие кислотного рефлюкса), эзофагогастродуоденоскопия (при которой исследуется слизистая оболочка пищевода, желудка и тонкий кишечник для диагностики гастроэзофагеальной рефлюксной болезни).
- Компьютерная томография носа и околоносовых пазух, МРТголовы (позволяет определить патологию околоносовых пазух и полости носа).
- Лабораторные тесты. Это исследование образца слизи на задней стенке носоглотки и мокроты. Если мокрота окрашена кровью, это может быть признаком желудочно-кишечной или легочной инфекции. Этот тип состояния потребует дополнительной оценки. Исследование мокроты на флору.
- Тесты на аллергию. Если эпизоды, когда слизь стекает по носоглотке, повторяются каждые несколько дней или недель и исчезают на определенное время, это может быть связано с аллергической реакцией или чувствительностью, например, к определенной пище. Врач может порекомендовать вам вести дневник симптомов слизи в горле и кашля, отмечая, что вы ели и с чем могли контактировать (например, с пыльцой или домашними животными). Аллергические пробы могут точно определить, почему слизь в носоглотке стекает в горло.
Жизненный цикл
Как указывалось выше, бактериофаги характеризуются специфичностью к определенным видам бактерий. Однако, взаимоотношение между фагами и бактериями сложны и не всегда завершаются лизисом чувствительной к нему клетки и размножением фага.
В зависимости от специфичности различают:
- моновалентные бактериофаги – лизируют культуры бактерий определенного вида;
- типовые бактериофаги – лизируют отдельные штаммы внутри вида;
- поливалентные бактериофаги – вызывают лизис группы родственных видов микробов.
Инфекцию клетки, заканчивающуюся ее гибелью и размножением в ней фага, называют продуктивной.
Главная особенность бактериофагов: размножение происходит только в живых клетках, находящихся в состоянии развития и роста. В мертвых клетках и в продуктах клеточного обмена размножение фагов не происходит.
По характеру взаимодействия с бактериальными клетками различают две группы:
- Вирулентные бактериофаги – всегда лизируют зараженные бактерии и имеют только один путь развития – литический цикл.
- Умеренные бактериофаги – ведут себя двояко: после проникновения в клетку нуклеиновая кислота вируса может быть вовлечена в литический цикл или вступает с клеткой-хозяином в своеобразные симбиотические отношения. Она встраивается в хромосому бактерии и превращается в профаг, передаваясь всему потомству клетки (лизогенный путь). При этом бактерии, содержащие профаг, называют лизогенными бактеиями.
Бактериофаги – «пожиратели» бактерий
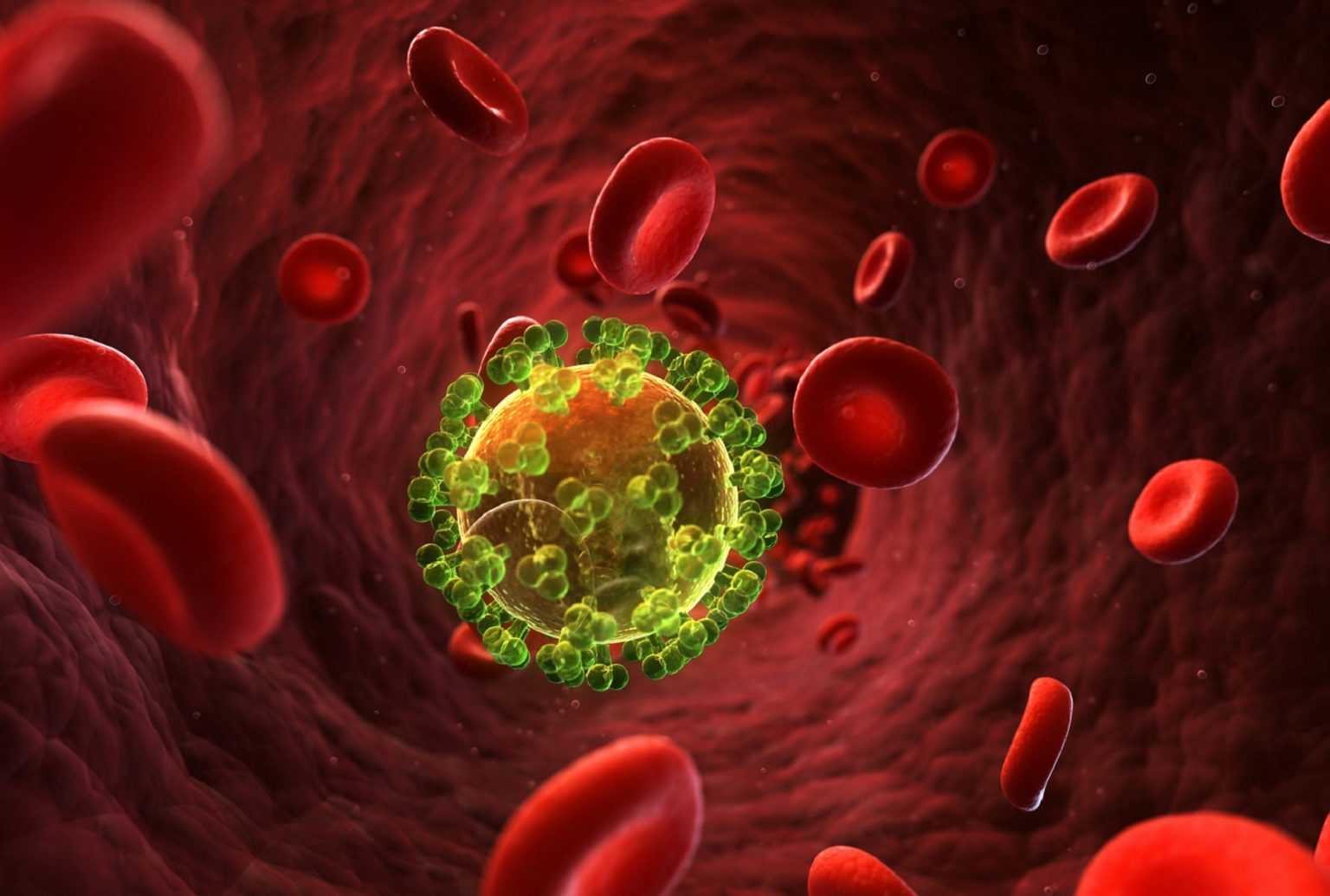
На самом деле, бактериофаги – это вирусы. Но только не те вирусы, которые поражают человека или животных. Бактериофаги уничтожают исключительно бактерии, или точнее – пожирают их (от греческого phagos – «пожиратель»). Эти миниатюрные (размером в среднем от 20 до 200 нанометров) враги бактерий очень распространены на нашей планете, найти их можно практически везде: в воде, глубоко под землей, в почве и даже в макроорганизмах. Бактериофаги используют в научных исследованиях, но, конечно, их основное практическое применение – борьба с бактериями.
Каждый бактериофаг поражает только те бактерии, против которых направлен. Когда фаг замечает «свою» бактерию, он моментально прикрепляется к оболочке ее клетки, после чего вводит собственную нуклеиновую кислоту (геном) внутрь бактерии. Его цель – заставить бактериальную клетку «работать на себя», то есть начать в ней процесс своего размножения.
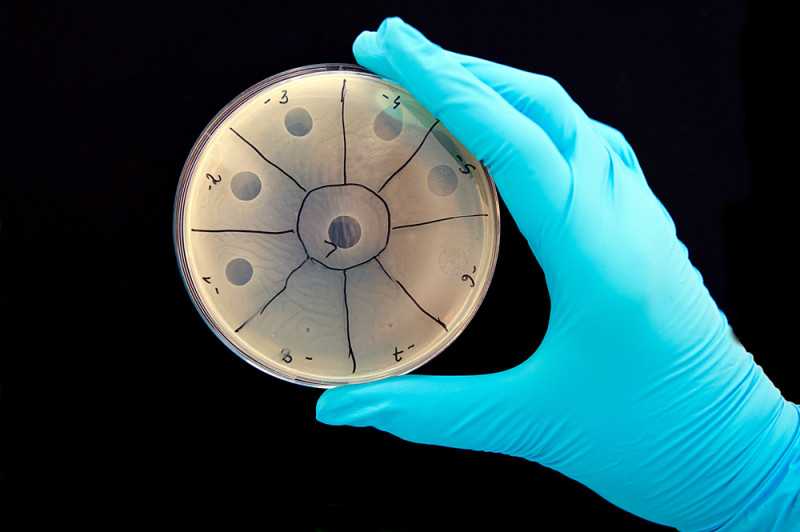
Бактериофаговая активность. Маленькие пятна – область лизиса бактерий, вызванного фагами
Вскоре внутри бактерии формируются новые бактериофаги, и начинается процесс лизиса – распада бактериальной клетки и выход зрелых фагов. Таким образом, на свет появляются сотни новых бактериофагов, готовых к нападению. «Литический цикл» вновь повторяется. При всей своей кажущейся агрессивности, этот процесс абсолютно безвреден и не причиняет никаких побочных эффектов остальной микрофлоре организма.
Бактериофаги – далеко не новый биологический вид, а древнейшая группа вирусов. Ученые приступили к их изучению задолго до появления всем известных антибиотиков. Первые научные сообщения о бактериофагах появились еще в 1920-х годах. Многие тогда считали фаготерапию ключом к уничтожению бактериальных инфекций. Кстати, одним из основоположников фаготерапии стал грузинский микробиолог Георгий Элиава. В 1923 году он основал бактериологический институт в Тбилиси – первый в мире научно-исследовательский центр бактериофагологии. Через некоторое время к нему присоединился и сам первооткрыватель бактериофагов – француз Феликс Д’Эрелль. Кстати, именно он и придумал само название «бактериофаг».
В 1940 году бактериофагами заинтересовались за океаном – американские фармацевтические компании пытаются коммерциализировать идею фаготерапии. Но «фаготерапевтическому буму» вскоре приходит конец. Событие, которое отложило исследование фаготерапии на долгие годы – начало промышленного производства пенициллина. Несмотря на то что Александр Флеминг открыл пенициллин еще в 1928 году, первое время его идея не получила широкого применения из-за отсутствия возможности химического производства антибиотика. И только в начале 1940-х годов в Англии, США и СССР организуется промышленный выпуск пенициллина.
Морфологические типы
Описание структуры и морфологии бактериофагов приведенное выше соответствует наиболее изученным Т-фагам (типовым фагам). Они составляют группу коли-дизентерийных фагов, включающую 7 представителей: 4 нечетных Т1, ТЗ, Т5 и Т7 и 3 четных Т2, Т4, Т6.
Классические иди «хвостатые» фаги составляют основную массу бактериофагов, около 96%. Однако установлено, что тонкая структура фагов более разнообразна и сложна, чем структура фитопатогенных вирусов и зоопатогенных вирусов. В настоящее время исследовано большое количество фагов с морфологией отличной от представленной выше.
По форме вирусных частиц фаги делятся на шесть основных морфологических типов:
Фаготерапия по-русски
Эксперты отмечают, что производство бактериофагов – весьма перспективное направление в фармацевтической промышленности. Кстати, наша страна в производстве бактериофагов исторически занимает ведущие позиции. Уже в годы Великой Отечественной войны применялась фаготерапия
Особое внимание уделялось разработке бактериофагов против кишечных инфекций – холеры, брюшного тифа, дизентерии и сальмонеллеза. Всего в военное время для фронта было изготовлено более 200 тыс
литров бактериофагов.
Сегодня в нашей стране развитие производства лекарственных препаратов на основе бактериофагов входит в Стратегию предупреждения распространения антимикробной резистентности в Российской Федерации до 2030 года, принятую Правительством РФ. Единственный в стране производитель препаратов бактериофагов – компания «Микроген» холдинга «Нацимбио» Госкорпорации Ростех. В период с 2017 по 2019 год продажи бактериофагов «Микрогена» выросли более чем на 25% в денежном выражении.
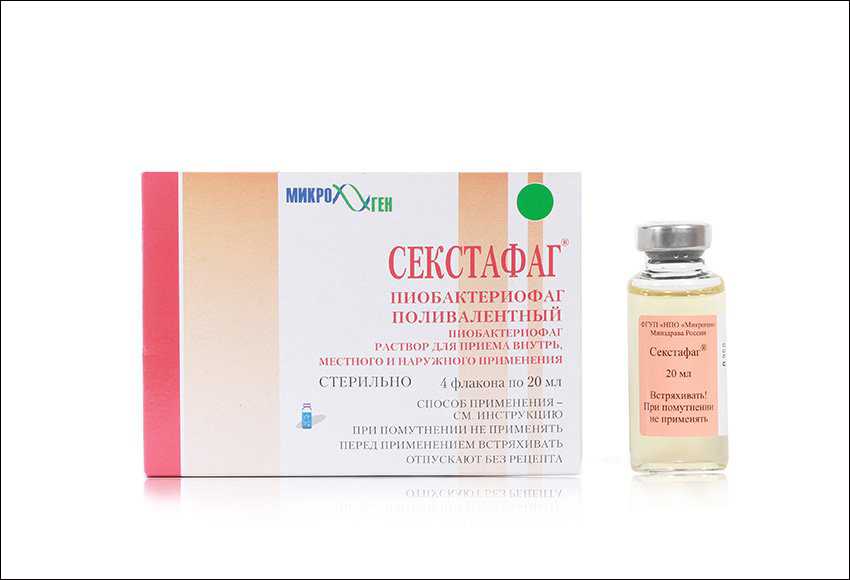
Компанией разработаны и выпускаются 19 наименований лекарств на основе бактериофагов против множества известных возбудителей инфекционных заболеваний: дизентерии, брюшного тифа, сальмонеллеза, гнойно-септических и других. Кроме того, разработаны комбинированные препараты, например «Секстафаг» (Пиобактериофаг поливалентный). Он обладает способностью справиться с бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек. Данный препарат отличается высокой степенью очистки от бактериальных метаболитов, что позволяет успешно использовать его для лечения новорожденных и детей раннего возраста, а также применять для беременных.
В рамках Стратегии по борьбе с антимикробной резистентностью ученые НПО «Микроген» проводят множество исследований. В настоящий момент предприятие приступило к созданию первого в России Биологического ресурсного центра для углубленного изучения бактериофагов.
«Задача Биологического ресурсного центра – объединить микробные производственные коллекции, собранные на территории России. На данный момент это более 10 тыс. штаммов. В коллекцию также входят бактериофаги для терапевтических целей. Это уникальный материал, представляющий собой государственную ценность, на его основе удастся создать новые виды лекарств», – прокомментировал исполнительный директор Госкорпорации Ростех Олег Евтушенко.
Но, пожалуй, самой амбициозной целью нового центра является создание основы для перехода к персонализированной фаготерапии в ближайшие 5-7 лет. Персонально подобранный «коктейль» из бактериофагов может спасти жизнь пациентам, которым уже не помогают антибиотики.
Успехи российских и зарубежных ученых вселяют надежду на то, что проблема антимикробной резистентности в скором времени может быть преодолена. Тем временем каждый из нас в этой борьбе с «супербактериями» может внести свой маленький вклад – соблюдать правила, которые помогут уберечься от вирусов и бактерий, остановить появление новых опасных инфекций. Все просто: не забывать о гигиене, вести здоровый образ жизни, вовремя обращаться к врачам и ограничить использование антибиотиков.