Векторная вакцина
Огромное преимущество этой вакцины в том, что человеку вводят не сам опасный вирус, как это делалось раньше, а лишь маленький кусочек его генетического кода. Таким образом, вероятность заражения и тяжелых побочных эффектов практически отсутствует.
Генетический код опасного вируса буквально режут на части, извлекая из него маленький фрагмент. Этот фрагмент отвечает за производство поверхностных белков вирусной частицы, которые еще называют «шипами». Вирус использует эти «шипы» как консервный нож для вскрытия человеческой клетки и проникновения внутрь.
Но сам по себе этот фрагмент вирусного гена не может попасть в клетку. Поэтому его доставляют с помощью вектора.
Вектор – это другой вирус, который выполняет роль доставщика. И лучше всего с этой ролью справляется обыкновенный аденовирус, который вызывает простуду.
В процессе изготовления вакцины ДНК аденовируса подвергается двум изменениям:
- Аденовирус лишают функции размножения, что делает его безопасным для человека.
- В ДНК аденовируса встраивают тот самый ген опасного вируса, от которого необходимо привиться.
После введения вакцины аденовирус проникает в клетки человека, высвобождая внутри клеточного ядра свою ДНК. Эта ДНК не может копировать сама себя и вызвать инфекцию. Вместо этого она превращает клетку в нано-фабрику по производству шипов опасного вируса.
Важно!
Произведенные вирусные шипы выступают на поверхности клетки, а наш иммунитет, распознав в них чужеродный элемент, немедленно блокирует зараженную клетку и вырабатывает антитела к незнакомому белку.
Может ли аденовирусный вектор повредить ДНК человека?
По сути, аденовирусный вектор мало чем отличается от обычного аденовируса, которым в течение жизни заражаются практически все люди на Земле. А манипуляции с ДНК принципиально не меняют его поведение.
По словам Линды Кофлан, исследователя векторных вакцин из Университета Мэрилэнда, аденовирус не имеет ферментативного механизма для присоединения к человеческой ДНК. Дело в том, что две молекулы ДНК не могут объединиться сами по себе, без специального фермента. Аденовирус не обладает таким ферментом и полностью безопасен для генома человека. Именно этим обстоятельством руководствовались разработчики вакцины, выбрав аденовирус в качестве «доставщика».
А учитывая, что вектор лишен способности размножаться, в момент гибели зараженной клетки ДНК вектора поглощается и расщепляется нашими иммунными клетками. Вакцина исчезает без следа, а человек приобретает иммунитет к опасному вирусу, с которым может столкнуться в будущем.
Грегори Поланд, доктор медицинских наук из клиники Мэйо, обратил внимание на то, что изготовители вакцин всегда используют специальные культуры аденовирусов, которые классифицируются как неинтегрирующиеся. Это значит, что безопасность данных векторов для ДНК человека и животных была доказана многократными исследованиями
Интересный факт!
Список литературы и библиографических ссылок:
Опубликовано: 13.5.2021
Дополнено: 02.6.2021
Просмотров: 25886
Поделиться
34826
Спасает ли от вирусной или атипичной пневмонии прививка от пневмококка
7639
Коронавирус 2019-nCoV из Китая – стоит ли паниковать?
8956
Топ-20 распространенных заблуждений о вреде прививок
70568
Инфекционист. Чем занимается данный специалист, какие исследования проводит, какие патологии лечит?
56917
Иммунолог. Чем занимается данный специалист, какие манипуляции проводит, какие патологии лечит?
48806
Генетик. Чем занимается данный специалист, какие исследования производит, какие заболевания лечит?
43636
Влияние климата и погоды на иммунитет
44375
Влияние физических нагрузок на иммунитет
46085
Влияние стрессов и эмоций на иммунитет
29811
Влияние режима дня на иммунитет
71630
Влияние питания на иммунитет. Как поднять иммунитет правильным питанием?
85838
Ротавирусная инфекция у детей грудного возраста, дошкольного возраста и у взрослых. Симптомы, диагностика и лечение ротавирусной инфекции
38332
Желтая лихорадка. Симптомы, диагностика, анализы и прививка от болезни
35023
Лихорадка Эбола. Симптомы, диагностика, анализы и прививка от болезни
63676
Брюшной тиф. Симптомы, диагностика, анализы и прививка от болезни.
111282
Что делать если укусил клещ? Первая помощь, как вытащить клеща? Заболевания, передающиеся через укусы клещей. Профилактика клещевого энцефалита, прививка.
410957
Укусила собака, что делать? Осложнения травмы, бешенство, симптомы, лечение, последствия, первая помощь. Прививки после укуса собаки детям.
439915
Краснуха — симптомы, признаки, лечение, последствия и профилактика. Прививка – сроки, эффективность, делать ли прививку
310950
Иммуноферментный анализ (ИФА, ELISA) — суть, принцип метода и этапы исследования. Анализ на антитела, классы антител, иммунный комплекс
1047026
Биохимический анализ крови, ферменты крови — амилаза, липаза, АЛТ, АСТ, лактатдегидрогеназа, щелочная фосфатаза — расшифровка анализа
178167
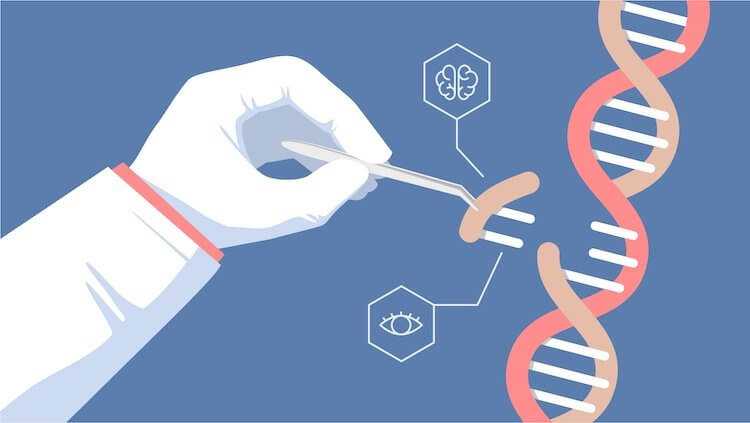
Молекула ДНК человека. Как работают гены, что такое РНК, нуклеотиды, синтез белка
Защита от вирусов на уровне ДНК
В основе редактирования генов и понимания того, зачем это вообще нужно, стояли исследования бактерий, которые показали, как они вырабатывали защиту от бактериофагов. Ученых особенно интересовало, как эта защита влияет на цепочки ДНК и при этом переносится на новые поколения бактерий.
Более того, определенные признаки изменения генов нашли изначально у бактерии кишечной палочки. Ученые заметили определенные повторяющиеся фрагменты, которые были разделены спейсерами, но тогда объяснить этого не смогли. Позже подобную структуру-кассету нашли и у других представителей прокариот. Тогда им и дали сокращенное название CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats). В переводе на русский это может звучать, как КППРРГ (короткие палиндромные повторы, регулярно расположенные группами). Такое сокращение выглядит просто ужасно и проще пользоваться емким словом CRISPR.
Позже выяснилось, что те самые спейсеры очень похожи на куски ДНК вирусов-бактериофагов и являются частью защитного механизма бактерий, выработанного в ходе эволюции. Ученые предложили механизм, при котором белок Cas, ассоциированный с CRISPR, позволяет находить чужеродную ДНК, когда вирус попадает в клетку бактерии. Если ДНК вируса соответствует информации, которая есть у бактерии, то в этом случае чужая ДНК разрезается и заражение предотвращается.
Бактериофаги не просто живут за счет бактерий, но и размножаются в них.
Ученые провели ряд экспериментов, в ходе которых меняли геном бактерий и наблюдали, как на них воздействуют другие бактериофаги. Результаты доказали, что механизм работает именно так, как они думали. Также они подтвердили, что когда бактерия сталкивается с новым для себя вирусом, она может вырезать часть его ДНК и вставлять их в свою CRISPR-кассету. После чего эти ”записи” передаются потомкам.
Как можно редактировать геном
Ученые предлагали несколько способов редактирования генов. В частности можно было создавать определенные искусственные последовательности, которые могли бы узнавать определенные участки ДНК. В результате белок Cas9 вносил бы разрезы точно в те места, в которых это требовалось. Параллельно с разработкой такого метода было доказано, что внесение изменений подобным образом возможно не только на уровне бактерий, но и в клетках других организмов.
Есть и другие способы редактирования генома. Например, с помощью искусственных ферментов, которых не существует в природе, но которые способны расщеплять цепочку ДНК. Их еще называют цинковыми пальцами. Все из-за того, что этот белковый модуль включает в себя один или несколько ионов цинка.

Редактировать гены возможно, но это сложно.
Такой способ требовал сложного подхода и долгой подготовки. Для каждого разреза в определенных участках генома надо было синтезировать специфичный белок. Кроме того, подобный способ редактирования часто приводил к ошибкам, так как разрезы часто происходили не в тех местах, где было нужно. Это лишний раз доказывает то, что вероятность ошибки очень высока, а неточности на начальных этапах могут привести к тому, что сбои будут идти, как снежный ком.
Стоит ли запретить генетические исследования
Конечно, сейчас нельзя говорить о том, что уже завтра мы рискуем получить нежелательные последствия редактирования генома. Во-первых, исследования еще только ведутся и чего-то действительно серьезного не сделали. Во-вторых, даже когда начнется массовое применение технологий на людях, понять истинные последствия можно будет только через несколько поколений. К сожалению, такое положение дел может расслабить некоторых ученых, ведь по сути у них не будет никакой ответственности. Впрочем, это вряд ли, но вероятность этого все равно есть.
Главное не вестись на кажущуюся легкость редактирования генов. Неизвестно, во что потом это выльется.
Пока ученые с осторожность прогнозируют вероятность внесения таких изменений в геном человека, которые сделают из него кого-то другого, но в перспективе это все равно возможно. Если даже в этом не поможет CRISPR, найдется другой способ, но он будет
Тут уже можно поднимать вопросы этичности того, что одни люди изначально будут от рождения лучше других. Кроме этого, возникают вопросы, насколько это корректно — вмешиваться в геном человека без его ведома. Может быть, когда из модифицированного появится человек, который отличается от остальных, он сам будет не рад этому. Одно дело, когда у него от природы определенный цвет волос, разрез глаз и форма ушей, а другое — когда за него кто-то решил, каким он должен быть. Вот еще одна дилемма будущего. А решать, стоит ли запрещать редактирование генома, вам. Каждый имеет свое мнение, которым можно и нужно поделиться в нашем Telegram-чате.
И в поле, и в аптеке
Уже в 1992 году ГМ-организмы вышли «на широкий оперативный простор»: в Китае началось выращивание трансгенного табака, устойчивого к вредителям. С 1996 года публикуется мировая статистика по трансгенным сельскохозяйственным культурам. В 2004 году общая площадь, которую они занимают на полях планеты, превысила 80 миллионов га. Общее число таких сортов исчисляется сотнями, к промышленному «применению» разрешены десятки. ГМ-кукуруза, ГМ-рапс и ГМ-хлопчатник захватили значительную долю рынка соответствующих культур. Но рекорд принадлежит сое: из каждых трех ее бобов, поступающих в продажу, два — измененные человеком.
Успехи могли бы быть и значительнее, если б трансгенные культуры не «наткнулись» во многих странах на яростные протесты. В 1998 году страны Евросоюза даже ввели мораторий на регистрацию новых ГМО (хотя все это время в Германии и Испании продолжали сеять ранее зарегистрированные сорта). Четыре года спустя на смену этому запрету пришли исключительно строгие и подробные правила обращения с «рукотворными» культурами и продуктами из них. Прописанные в этом документе меры безопасности мало отличаются от тех, что соблюдаются при работе с возбудителями чумы или сибирской язвы. Впрочем, швейцарцев, например, не удовлетворили даже такие строгости: в ноябре прошлого года 58% граждан альпийской конфедерации проголосовали на общенациональном референдуме за пятилетний запрет на выращивание чего-либо, генетически модифицированного.
Что способно наносить ущерб нашим генам
Каждая клетка насыщена ферментами, регулирующими её деятельность. Есть факторы, способные вызвать возмущение ферментов и заставить их наносить ущерб геному и клетке. Способствовать запуску этого процесса могут такие внешние причины, как курение, длительный стресс, плохая экология, биологическое старение организма.
В зависимости от того, какой ген подвергся ущербу и насколько важна функция данного гена, можно наблюдать либо отсутствие существенных перемен в состоянии здоровья человека, либо нарастание какого-то патологического процесса, который невозможно остановить никаким другим способом, кроме воздействия на генетическую программу. Можно блокировать сигналы гормонов, можно удалять повреждённые ткани хирургически, но если клетки настроены на абсолютно новую генетическую задачу, то они будут непрерывно делиться, а заболевание прогрессировать. В результате могут произойти настолько глубокие изменения генетической программы, что клетка начинает подчиняться совершенно другим законам.
У нас в организме все время происходят мутации, и это нормально
Однажды в маршрутке вы увидели ребенка с генетическим заболеванием (синдромом Рубинштейна — Тейби), спросили у мамы, где они наблюдаются, а когда узнали, что нигде и стоит диагноз ДЦП, взяли эту маму с ребенком за руку и повели к себе в институт. И там уже обнаружили у девочки порок сердца, которого прежде никто не искал.
А сейчас бы вы как поступили в этой ситуации?
Я не знаю, как надо. Я тогда была молодая и бестактная (улыбается), но сейчас стараюсь не предлагать помощь, когда ее не просят — это неправильно. Родители изменились. Наверное, если бы увидела ребенка с несовершенным остеогенезом на коляске неактивного типа, которую везет мама, то, наверное, подошла бы. Обычно каждая семья, где есть ребенок с таким диагнозом, знает мое имя. Но вот как спросить? «Здравствуйте, я доктор Белова, занимаюсь такой-то болезнью. Нужна ли помощь?» — «Нет, не нужна, мы про вас много гадостей слышали».
Но все-таки я хотела бы не подходить к каждому пациенту, а сделать место, куда любая семья может обратиться, а мы будем искать возможности ей помочь.
На ваш взгляд, мысль, что все генетические поломки можно вылечить — это реальность или скорее фантастика?
Починить поломку гена нельзя, но можно устранить ее тяжелые последствия. Все время разрабатывается генетическая терапия, и сегодня уже можно заместить фермент, которого не хватает, как например, при мукополисахаридозе, и вводить его пожизненно
Причем это важно делать до начала клинических проявлений болезни, потому что повернуть вспять что-то, что уже есть, обычно трудно.
А можно ли как-то предотвратить генетическое заболевание в утробе?
Это может быть разговор только про преимплантационную диагностику. Если у пары уже есть ребенок с тяжелым наследственным заболеванием, то мы можем обследовать и отличить те формы, при которых риск повтора у другого ребенка велик, от тех форм, когда риска повтора почти нет
Семье это очень важно знать. Например, при несовершенном остеогенезе в 90% случаев, если родители здоровы, то риск повтора очень низкий, и в нашей тусовке детей с несовершенным остеогенезом крутится много их здоровых братьев и сестер.
Как вы относитесь к генетическому анализу при планировании беременности? Сегодня этот скрининг все более популярен.
Это просто коммерческое предложение, это бессмысленно. На сегодняшний день смотреть на все мутации технически невозможно. У нас в организме все время происходят мутации, и это нормально, иначе мы бы не эволюционировали.
Каждый человек — носитель патологических генов, и считается, что минимум семь из этих генов смертельны.
И если встречаются два носителя одинаковых генов, у части таких пар может быть гибель плода на самых ранних сроках, у части — родится нежизнеспособный ребенок, а еще у части — сочетание двух измененных генов приведет к рождению детей с патологией. И такие гены встречаются у здоровых людей.
И сейчас мы можем проверить пару на конкретную мутацию, но только если знаем, что ищем. Иначе это действительно иголка в стоге сена. Например, в некоторых странах существует скрининг именно на те мутации, которые в этой стране, в определенных национальных группах встречаются в сотни раз чаще, чем у других. Например, в Израиле есть скрининг на болезнь Тея — Сакса — это заболевание встречается преимущественно среди евреев-ашкенази. И тогда такой анализ имеет огромный смысл.
А к чему вы больше склоняетесь — исследовать возможную мутацию или принимать ее как есть?
Наука должна двигаться вперед. Но мне кажется очень важным, чтобы она не опережала какие-то гуманитарные ценности, чтобы не перейти границу и определять, кто достоин жить, а кто нет. Это такой философский вопрос, и я тут скорее за гуманитарные ценности, чем за движение науки.

У нас недавно на приеме был подросток с несовершенным остеогенезом, он поступил к нам на доске, к ней привязанный, не мог даже сесть и голову повернуть. С избыточным весом, глухой, его слухом никто не занимался, считая, что при таком заболевании слухом заниматься бессмысленно. Мальчика только оперировали раз за разом, но с каждой операцией уровень его самостоятельности и активности был все ниже и ниже.
И что с ним сейчас?
Нам надо было его поставить на ноги, вертикализировать. И бороться со страхами и мамы, и мальчика. Объяснить, почему так необходимо заняться слухом, убрать последствия неправильных операций, например, наружные металлоконструкции, которые нельзя было ставить в такой ситуации.
Мы, к сожалению, редко фотографируем детей, когда они к нам поступают, но это понятно: и мы в шоке от состояния ребенка, который свисает с кушетки и не шевелится, и родителям страшно… А теперь он красавец! Но мама и мальчик были настроены, как бойцы, а от настроя родителей многое зависит.
Всегда ли виновата мутация генов
Одни из самых распространенных наследственных заболеваний — рак молочной железы и яичников — связаны с мутацией в гене BRCA (Breast Cancer Assoсiated). Нормальная работа этого гена подавляет способность клеток превращаться в раковые. Но если одна из его копий имеет «поломку», то это приводит к неконтролируемому делению клеток, и в итоге к возникновению злокачественной опухоли. Примерно 5% всех случаев рака молочной железы — это наследственный, или так называемый семейный рак, потому что девочка унаследовала по женской линии мутантный ген.
Кстати, в США все женщины обследуются в рамках специальной скрининговой программы. Если у пациентки находят мутацию гена BRCA, ей предлагают для профилактики болезни удалить молочные железы. Анджелина Джоли — классический пример, у неё наследственная мутация BRCA. У нас в стране такой программы, увы, нет. Хотя о её необходимости много говорят.
Но самое интересное — при обследовании женщин с раком молочной железы выяснилось, что примерно в 40% случаев ген BRCA структурно идеален! Однако при этом он «молчит», т. е. не выполняет свою функцию!
Осуществлённая недавно программа «Геном человека» продемонстрировала, что в генетике всё не так просто, как считалось раньше. Геном — восприимчивая структура, которая способна изменяться при любом воздействии. Представьте себе активно работающий ген, который выполняет важную функцию. Мы думали, что выключать его может лишь необратимая мутация. Структура гена нарушается, и он выключается из системной работы. Но оказалось, что ген может «замолчать» также в результате действия других механизмов, которые отличаются от процессов, происходящих при мутации.
Ретровирусные инфекции
Относительно недавно я уже рассказывал о том, как мы все являемся носителями ретровирусов или, как их еще называют, реликтовых вирусов. В том числе к ним относится и ВИЧ, который миллионы лет назад встроил свой геном в наши ДНК и мы продолжаем передавать его из поколения в поколение.
В журнале Scientific Reports даже была опубликована работа, которая показывает, как при помощи CRISPR-Cas9 можно избавиться от этого наследства и даже ликвидировать возможность повторного встраивания вируса в ДНК.
Китайские ученые даже проводили эксперименты в этом направлении и обеспечили рождение двух генно-модифицированных человек. Ими стали девочки близнецы, один из родителей которых был ВИЧ-положительным. В итоге, они родились с устойчивым иммунитетом к вирусу. Проблема в том, что эксперимент был за гранью законности, но в целом все получилось.
Также в другой работе, опубликованной в Nature Biotechnology, доказывается, что при помощи модифицированного белка Cas9 можно отключать гены, которые мешают нормальному перерождению клеток и приводят к злокачественным образованиям. То есть потенциально это может стать долгожданным лекарством от рака. Вот только не привело бы такое вмешательство к тому, что воспроизводство новых клеток станет еще хуже.
Применение генной инженерии в промышленности
Более того, можно смело говорить о том, что генное модифицирование уже применяется на практике для достижения определенных результатов. Я говорю о генно-модифицированных организмах — ГМО.
Самым простым примером, как для понимания преимуществ метода, так и для самих генетиков является создание модифицированных кисломолочных бактерий. Дело в том, что когда на производстве вирусы бактериофаги попадают в закваску, они уничтожают культуру полезных микроорганизмов. В итоге это приводит к тому, что партия оказывается испорченной, а производитель несет огромные убытки. Именно поэтому устойчивые к бактериофагам микроорганизмы решают массу проблем.

Если бактериофаги попадают на производство, пропадают просто огромные объемы продукции.
Ключи к человечности
Маклайсэт и ее коллеги сравнили геномы H. sapiens и P. troglodytes. Используя специальные программы, они сопоставляли последовательности известных на сегодняшний день генов человека и шимпанзе. Авторы обнаружили в геноме человека 644 гена, не имеющих аналогов у шимпанзе.
Порядок расположения генов у шимпанзе и человека практически не отличается. Исследователи пристально изучили области обезьяньего генома, где могли бы располагаться подозрительные последовательности. В существующих базах данных ДНК P. troglodytes в некоторых из этих мест отсутствовали большие куски кода, поэтому исследователям пришлось исключить из рассмотрения 425 из найденных 644 генов.
На следующей стадии работы ученые провели повторный поиск оставшихся 219 последовательностей в геноме шимпанзе, используя немного иной алгоритм. У 150 предположительно уникальных человеческих генов в геноме P. troglodytes обнаружились аналоги. Таким образом, «круг подозреваемых» сузился до 69 генов. Ученые вычеркнули из этого списка последовательности, которые были обнаружены в геномах других видов, кроме шимпанзе. Наконец, Маклайсэт и ее соавторы отказались от генов, которые были представлены только в одной базе данных человеческой ДНК и могли попасть туда по ошибке.
Все стадии отбора прошли только три гена — CLLU1, C22orf45 и DNAH10OS. Чтобы еще раз убедиться в их уникальности для человека, исследователи проверили геномы макаки, гиббона и гориллы. Последовательности, напоминающие CLLU1, C22orf45 и DNAH10OS, были обнаружены у всех изученных приматов, однако являться полноценными генами они не могли и присутствовали в «мусорной» ДНК.
Для того чтобы считаться геном, последовательность должна содержать определенные сочетания «букв», в частности, отмечающих конец и начало гена. Такие характерные «буквосочетания» узнаются ферментами, отвечающими за синтез белка с этого гена. У макаки, шимпанзе, гиббона и гориллы характерных для генов отличительных признаков не было. Более того, у них имелись участки, мешающие полноценной работе ферментов. Причем у всех приматов (кроме человека) эти участки были одинаковыми.
Исследователи предположили, что в ходе эволюции человека в некоторых регионах «мусорной» ДНК, присутствующих у приматов, накопились необходимые изменения, которые позволили им стать настоящими генами. Именно работа этих генов привела к появлению рода Homo.
Из-за пробелов в генетических базах данных и очень строгих критериев отбора ученые смогли полноценно изучить только 20 процентов из исходно отобранных генов. Соответственно, в будущем, когда дыры будут заполнены, авторы рассчитывают обнаружить еще как минимум 15 уникальных генов. Пока же авторы сосредоточились на поиске белков, кодируемых «человеческими» генами. В работах других исследовательских групп было показано, что белки с этих последовательностей синтезируются, однако какова может быть их функция, на данный момент не совсем ясно. Если Маклайсэт и коллегам удастся это узнать, то человечество, возможно, чуть-чуть приблизится к ответу на вопрос, чем же отличается человек от обезьяны.
















![Все познается в сравнении (сравнительная геномика). геном человека [энциклопедия, написанная четырьмя буквами]](http://mediaex.ru/wp-content/uploads/4/2/5/425e0112fda48ae7f47d6c3fa5df721f.png)












![Все познается в сравнении (сравнительная геномика). геном человека [энциклопедия, написанная четырьмя буквами]](http://mediaex.ru/wp-content/uploads/4/7/6/47600e5175b5c33d0aa274d342965a73.jpeg)