Применение генной инженерии в промышленности
Более того, можно смело говорить о том, что генное модифицирование уже применяется на практике для достижения определенных результатов. Я говорю о генно-модифицированных организмах — ГМО.
Самым простым примером, как для понимания преимуществ метода, так и для самих генетиков является создание модифицированных кисломолочных бактерий. Дело в том, что когда на производстве вирусы бактериофаги попадают в закваску, они уничтожают культуру полезных микроорганизмов. В итоге это приводит к тому, что партия оказывается испорченной, а производитель несет огромные убытки. Именно поэтому устойчивые к бактериофагам микроорганизмы решают массу проблем.
Если бактериофаги попадают на производство, пропадают просто огромные объемы продукции.
Как возникают гены-сироты
Большинство генов любого биологического вида также встречаются как минимум у одного другого вида. Последовательности у них могут немного отличаться, но они всё же достаточно схожи, чтобы можно было распознать их родство. В результате случайных мутаций цепочки ДНК со временем расходятся по своему строению, но гомологичные гены (произошедшие от одного участка. — Прим. ред.) по-прежнему можно классифицировать по семействам благодаря их сходству. Например, гены молекул гемоглобина у людей и прочих млекопитающих принадлежат к одному семейству.
Сусуму Оно предложил теорию, согласно которой гены с новыми функциями возникают путем дивергенции (от лат. divergium — расхождение, растекание. — Прим. ред.). Он показал, что дупликация генов с последующей мутацией, в результате которой происходит дивергенция двух гомологичных генов, приводит к образованию новых генов.
Стоит ли запретить генетические исследования
Конечно, сейчас нельзя говорить о том, что уже завтра мы рискуем получить нежелательные последствия редактирования генома. Во-первых, исследования еще только ведутся и чего-то действительно серьезного не сделали. Во-вторых, даже когда начнется массовое применение технологий на людях, понять истинные последствия можно будет только через несколько поколений. К сожалению, такое положение дел может расслабить некоторых ученых, ведь по сути у них не будет никакой ответственности. Впрочем, это вряд ли, но вероятность этого все равно есть.
Главное не вестись на кажущуюся легкость редактирования генов. Неизвестно, во что потом это выльется.
Пока ученые с осторожность прогнозируют вероятность внесения таких изменений в геном человека, которые сделают из него кого-то другого, но в перспективе это все равно возможно. Если даже в этом не поможет CRISPR, найдется другой способ, но он будет
Тут уже можно поднимать вопросы этичности того, что одни люди изначально будут от рождения лучше других. Кроме этого, возникают вопросы, насколько это корректно — вмешиваться в геном человека без его ведома. Может быть, когда из модифицированного появится человек, который отличается от остальных, он сам будет не рад этому. Одно дело, когда у него от природы определенный цвет волос, разрез глаз и форма ушей, а другое — когда за него кто-то решил, каким он должен быть. Вот еще одна дилемма будущего. А решать, стоит ли запрещать редактирование генома, вам. Каждый имеет свое мнение, которым можно и нужно поделиться в нашем Telegram-чате.
Какое отношение эти различные организмы имеют друг к другу и эволюции?
Совсем немного, считает биолог-эволюционист Оксфордского университета (Oxford University) и автор нового исследования Николас Ирвин (Nicholas Irwin).
Вирусы и эукариоты зависят друг от друга. Первые используют свои гены, полученные от хозяина, для репликации и клеточного контроля, зачастую кодируя информационные и операционные гены клеточного происхождения, позволяя вирусам адаптироваться и выживать. Эукариоты могут включать вирусную ДНК в свои геномы. Эта новая ДНК, ранее считавшаяся неактивной, теперь, как было обнаружено, обеспечивает новую функциональность их хозяевам-эукариотам.
Соавторы исследования из Университета Британской Колумбии (University of British Columbia) в Ванкувере, Канада, и Оксфордского университета (University of Oxford), Соединенное Королевство, сотрудничали с доктором Ирвином, чтобы раскрыть новаторские открытия в области перемещения генов между вирусами и эукариотами, называемые горизонтальным переносом генов.
Векторная вакцина
Огромное преимущество этой вакцины в том, что человеку вводят не сам опасный вирус, как это делалось раньше, а лишь маленький кусочек его генетического кода. Таким образом, вероятность заражения и тяжелых побочных эффектов практически отсутствует.
Генетический код опасного вируса буквально режут на части, извлекая из него маленький фрагмент. Этот фрагмент отвечает за производство поверхностных белков вирусной частицы, которые еще называют «шипами». Вирус использует эти «шипы» как консервный нож для вскрытия человеческой клетки и проникновения внутрь.
Но сам по себе этот фрагмент вирусного гена не может попасть в клетку. Поэтому его доставляют с помощью вектора.
Вектор – это другой вирус, который выполняет роль доставщика. И лучше всего с этой ролью справляется обыкновенный аденовирус, который вызывает простуду.
В процессе изготовления вакцины ДНК аденовируса подвергается двум изменениям:
- Аденовирус лишают функции размножения, что делает его безопасным для человека.
- В ДНК аденовируса встраивают тот самый ген опасного вируса, от которого необходимо привиться.
После введения вакцины аденовирус проникает в клетки человека, высвобождая внутри клеточного ядра свою ДНК. Эта ДНК не может копировать сама себя и вызвать инфекцию. Вместо этого она превращает клетку в нано-фабрику по производству шипов опасного вируса.
Важно!
Произведенные вирусные шипы выступают на поверхности клетки, а наш иммунитет, распознав в них чужеродный элемент, немедленно блокирует зараженную клетку и вырабатывает антитела к незнакомому белку.
Может ли аденовирусный вектор повредить ДНК человека?
По сути, аденовирусный вектор мало чем отличается от обычного аденовируса, которым в течение жизни заражаются практически все люди на Земле. А манипуляции с ДНК принципиально не меняют его поведение.
По словам Линды Кофлан, исследователя векторных вакцин из Университета Мэрилэнда, аденовирус не имеет ферментативного механизма для присоединения к человеческой ДНК. Дело в том, что две молекулы ДНК не могут объединиться сами по себе, без специального фермента. Аденовирус не обладает таким ферментом и полностью безопасен для генома человека. Именно этим обстоятельством руководствовались разработчики вакцины, выбрав аденовирус в качестве «доставщика».
А учитывая, что вектор лишен способности размножаться, в момент гибели зараженной клетки ДНК вектора поглощается и расщепляется нашими иммунными клетками. Вакцина исчезает без следа, а человек приобретает иммунитет к опасному вирусу, с которым может столкнуться в будущем.
Грегори Поланд, доктор медицинских наук из клиники Мэйо, обратил внимание на то, что изготовители вакцин всегда используют специальные культуры аденовирусов, которые классифицируются как неинтегрирующиеся. Это значит, что безопасность данных векторов для ДНК человека и животных была доказана многократными исследованиями
Интересный факт!
Список литературы и библиографических ссылок:
Опубликовано: 13.5.2021
Дополнено: 02.6.2021
Просмотров: 25886
Поделиться
34826
Спасает ли от вирусной или атипичной пневмонии прививка от пневмококка
7639
Коронавирус 2019-nCoV из Китая – стоит ли паниковать?
8956
Топ-20 распространенных заблуждений о вреде прививок
70568
Инфекционист. Чем занимается данный специалист, какие исследования проводит, какие патологии лечит?
56917
Иммунолог. Чем занимается данный специалист, какие манипуляции проводит, какие патологии лечит?
48806
Генетик. Чем занимается данный специалист, какие исследования производит, какие заболевания лечит?
43636
Влияние климата и погоды на иммунитет
44375
Влияние физических нагрузок на иммунитет
46085
Влияние стрессов и эмоций на иммунитет
29811
Влияние режима дня на иммунитет
71630
Влияние питания на иммунитет. Как поднять иммунитет правильным питанием?
85838
Ротавирусная инфекция у детей грудного возраста, дошкольного возраста и у взрослых. Симптомы, диагностика и лечение ротавирусной инфекции
38332
Желтая лихорадка. Симптомы, диагностика, анализы и прививка от болезни
35023
Лихорадка Эбола. Симптомы, диагностика, анализы и прививка от болезни
63676
Брюшной тиф. Симптомы, диагностика, анализы и прививка от болезни.
111282
Что делать если укусил клещ? Первая помощь, как вытащить клеща? Заболевания, передающиеся через укусы клещей. Профилактика клещевого энцефалита, прививка.
410957
Укусила собака, что делать? Осложнения травмы, бешенство, симптомы, лечение, последствия, первая помощь. Прививки после укуса собаки детям.
439915
Краснуха — симптомы, признаки, лечение, последствия и профилактика. Прививка – сроки, эффективность, делать ли прививку
310950
Иммуноферментный анализ (ИФА, ELISA) — суть, принцип метода и этапы исследования. Анализ на антитела, классы антител, иммунный комплекс
1047026
Биохимический анализ крови, ферменты крови — амилаза, липаза, АЛТ, АСТ, лактатдегидрогеназа, щелочная фосфатаза — расшифровка анализа
178167
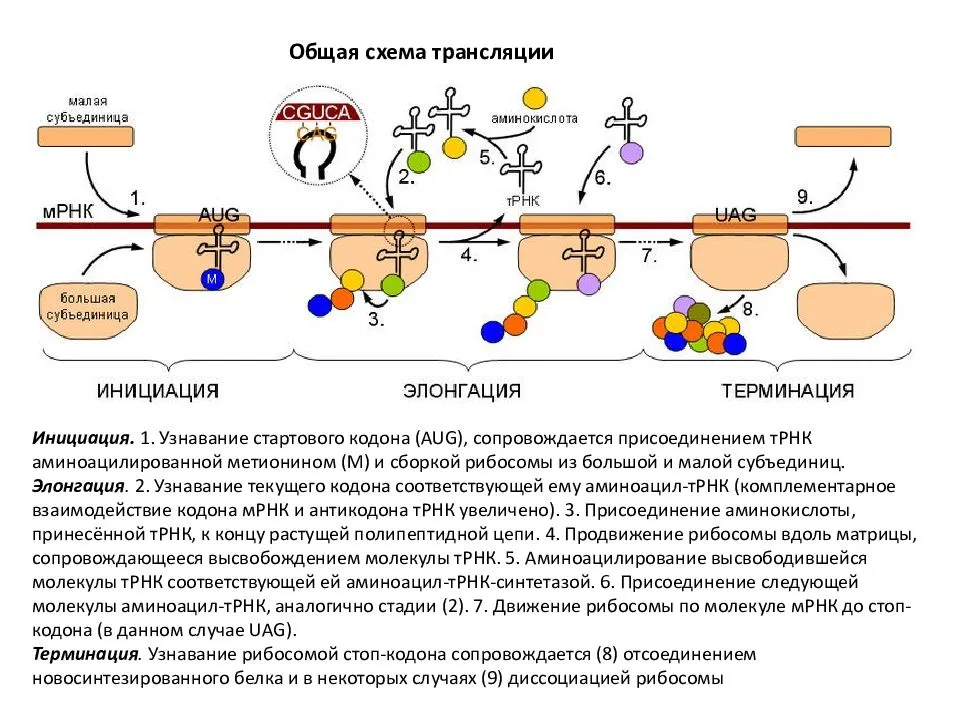
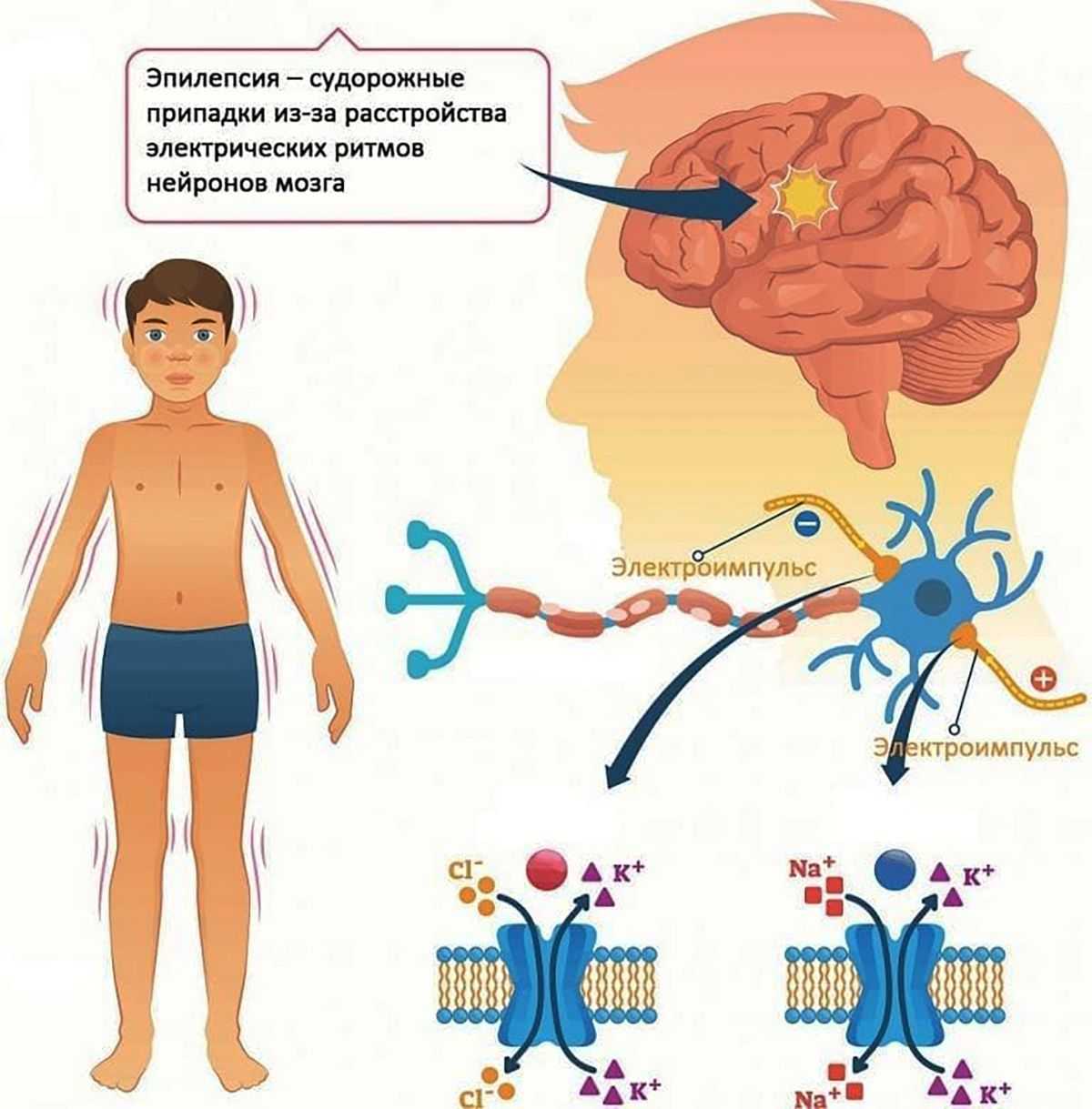
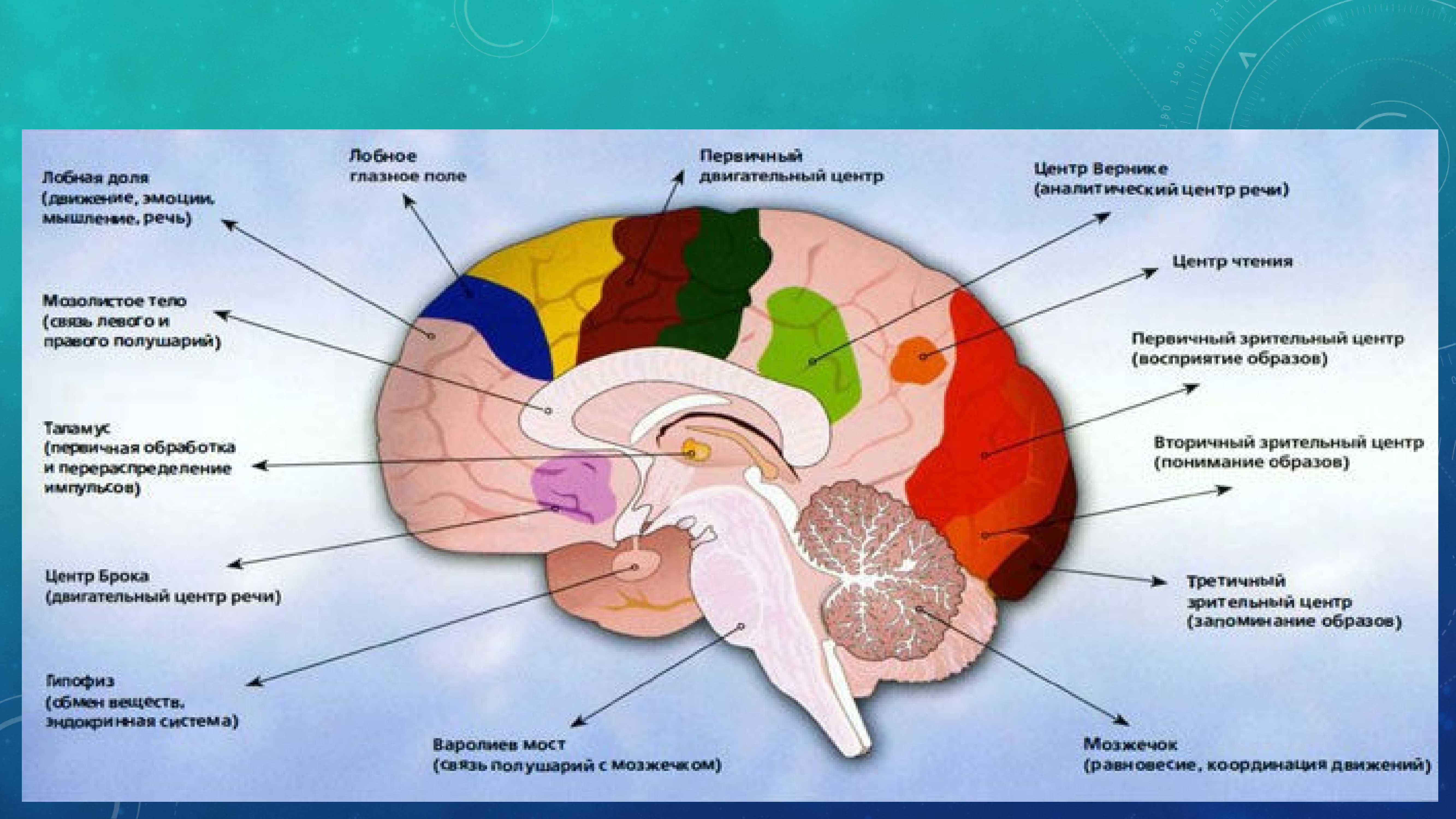
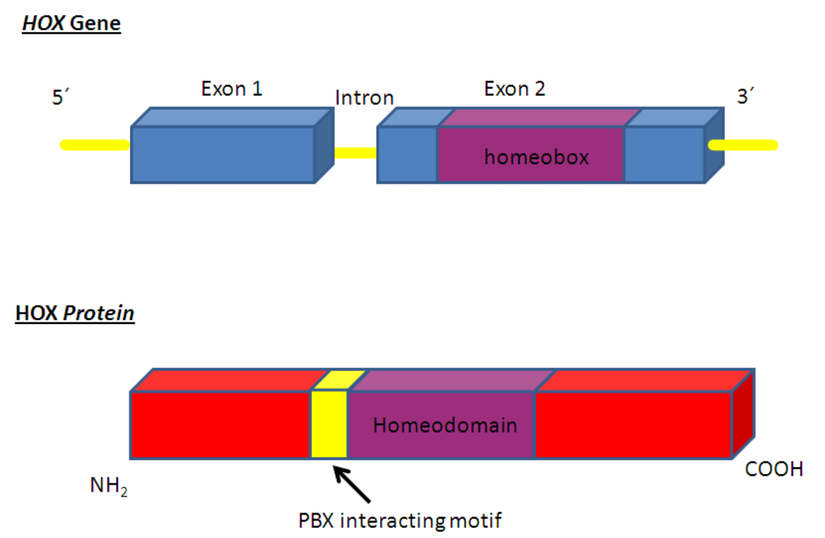
Молекула ДНК человека. Как работают гены, что такое РНК, нуклеотиды, синтез белка
Зарождение генетики
Какого цвета твои глаза, волосы, кожа? Почему у тебя такие же вьющиеся волосы, как и у твоей мамы? Почему ты очень похож на своих родителей, но не являешься их полной копией? Почему листики одного дерева такие разные? Ответы на все эти вопросы дает один из самых интересных разделов биологии — генетика.
Первые шаги
В течение очень длительного периода людям была непонятна причина схожести родственных организмов. Ситуация изменилась в 60-х гг. XX в., когда австрийский биолог и ботаник, монах августинского монастыря в Брно Грегор Мендель начал проводить опыты на горохе в монастырском саду. Он хотел узнать, каким образом определенные признаки живых существ передаются из одного поколения в другое.
Грегор Мендель
Следующий научный шаг в изучении генетики был сделан в 1909 г. датским биологом профессором Вильгельмом Иогансеном, который ввел и объяснил термин «ген». Несколько позже, в 1923 г., американский биолог Томас Морган доказал, что гены находятся в хромосомах, и сформулировал хромосомную теорию наследственности. С тех пор генетика стала развиваться на уровне гена.
Опыты Менделя
Менделя интересовали высота растения, цвет цветков и форма горошин. Занимаясь перекрестным опылением гороха, он тщательно анализировал получаемые результаты и наблюдал, какие именно признаки и в каком поколении передавались по наследству. Причем каждый раз в перекрестном опылении участвовали специально отобранные растения с теми признаками, которые, как думал Мендель, обязательно должны передаться последующему поколению.
В чем заключалась суть экспериментов биолога?
Одним из признаков, которые исследовал Мендель, был цвет цветков гороха. В своих первых опытах он отобрал только те сорта, которые цветут белыми и красными цветками. Мендель был уверен, что после скрещивания в первом поколении (поколение F1) будут растения как с белыми, так и с красными цветками. Каково же было его удивление, когда абсолютно все цветки оказались красными!
Такой результат не только не остановил ученого, но и заставил продолжить эксперименты. Мендель опылил цветки полученных растений первого поколения их же пыльцой и ожидал совершенно логичного результата — красных цветков. Но снова его предположения не оправдались: во втором поколении (поколение F2) 75% всех цветков были красными, а оставшиеся 25% — белыми!
В чем причина?
Такой неожиданный результат вовсе не огорчил ученого. Благодаря полученным данным он пришел к выводу о том, что у каждого растения не один, а два гена, которые принимают участие в передаче определенных признаков. Он назвал красный цвет гороха главным, доминантным, а белый — рецессивным, уступающим признаком.
При наличии двух разных генов (например, красного и белого), определяющим при цветении будет доминантный ген. Поэтому, если у растения есть оба гена (красный и белый), на цвет цветка будет влиять доминантный ген красного цвета. А тот факт, что среди дочерних растений могут быть и цветки белого цвета, говорит лишь о наличии этого гена у растения.
Степень расхождения
Доктор биофизики Каролин Вайсман и ее коллеги из Гарварда Эндрю Мюррей и Шон Эдди использовали несколько иной подход к проблеме, который описали в препринте, опубликованном на сайте biorxiv.org.
Чтобы ответить на этот вопрос, Вайсман изучила родственные виды дрожжей и дрозофил и рассчитала частоту мутаций в пределах их семейств. Это позволило определить статистическую вероятность того, что гомолог гена одного вида можно будет идентифицировать у родственного ему вида.
Вайсман подсчитала, что от 55 до 73% — то есть большинство — генов-сирот у дрожжей возникли в результате дивергенции; это число больше, чем то, которое получила МакЛайсат. Тем не менее Вайсман считает успехом, что, несмотря на совершенно разные подходы, они с МакЛайсат пришли к одному выводу, что «существенное количество генов-сирот с высокой долей вероятности возникли вследствие дивергенции».
Редактирование генома CRISPR
Система CRISPR-Cas с точки зрения редактирование генома более простая и надежная. Главное только правильно синтезировать то, что укажет, в каком месте надо совершить разрез ДНК. Дальше запустится механизм восстановления и все сделается практически само собой. Тем более, если сделать много таких разрезов, то можно запрограммировать нужные изменения достаточно крупного участка ДНК.
Можно даже убирать целые участки ДНК, если это потребуется. При этом, на место удаленных фрагментов будут встроены те участки, которые будут нужны генетикам. Это позволит редактировать ”сломанные” последовательности, которые приводят к тяжелым заболеваниям. В теории надо будет просто заменить нужный фрагмент и все должно стать нормально.
Сами понимаете, что первым вопросом будет ”а можно ли встроить нужную часть кода?” Конечно, со временем и это станет возможно. Вот тогда и могут начать получаться целые новые народы. Но, скорее всего, дело ограничится небольшой группой узких специалистов, вроде людей, которые смогут выдержать полеты к другим планетам, или солдат, которые не будут уставать. Люди найдут, как извлечь из этого выгоду. Особенно правительства и инвесторы, которые вкладывают в разработки огромные деньги. И далеко не все из них делают это, чтобы избавить человечество от болезней. Увы, но реальность такова.
Генная инженерия
Сейчас все большее количество правительств разных стран готовится к тому, чтобы разрешить эксперименты по редактированию генома на эмбрионах человека. Некоторые страны уже даже разрешили это, например, Великобритания.
Справедливости ради, пока мы не говорим о полностью готовом человеке с измененными генами, но все к этому идет. Вы же понимаете? Пока Великобритания разрешает ставить эксперименты только над эмбрионами, выращенными в лабораторных условиях. При этом они обязательно должны быть уничтожены через 14 дней после начала эксперимента. То есть формально нам это ничем не угрожает. Вопрос только в том, для чего это нужно тому, кто это разрешил. Явно не из любопытства. Что-то подсказывает, что как и многие передовые разработки, сначала это будет применяться в военных целях, ведь именно так можно получить универсального солдата. Он не будет хотеть есть или пить. Он не будет уставать или бояться взрывов. Небольшая корректировка генов и супер-солдат готов.
Более того! Такой способ воздействия, если человечество ему научится, может выйти из-под контроля. Или просто ”не в тех руках” это может стать оружием геноцида. Как видим, мрачных последствий куда больше, чем радужных. Поэтому прежде, чем делать что-то подобное, надо основательно взвесить все за и против. Даже клонирование на фоне этого может показаться милой забавой. Хотя изначально все были против этого.
Может не надо это трогать?
Но может все же что-то положительное в этом есть и можно дать шанс ученым доказать, что они не зря открывали инструменты редактирования? Какие преимущества редактирование генов может принести человеку?
Особенности эукариот
При классификации всех живых организмов ученые используют таксономию — систему наименований — для объединения сходных организмов. Самые крупные группировки называются доменами. Например, люди, все животные, растения, грибы и многоклеточные организмы являются доменами, называемыми эукариотами. У всех эукариотических клеток есть одна важная общая черта: они размещают свою ДНК в ядре. Ядро клетки расположено в центре и связано с мембраной. Прокариоты включают бактерии и археи, одноклеточные организмы, ДНК которых неплотно упакована и окружена клеточной мембраной.
Вирусы еще проще. Они состоят только из ДНК или РНК и имеют только одну защитную белковую оболочку, называемую капсидом, окружающую их.
Как можно редактировать геном
Ученые предлагали несколько способов редактирования генов. В частности можно было создавать определенные искусственные последовательности, которые могли бы узнавать определенные участки ДНК. В результате белок Cas9 вносил бы разрезы точно в те места, в которых это требовалось. Параллельно с разработкой такого метода было доказано, что внесение изменений подобным образом возможно не только на уровне бактерий, но и в клетках других организмов.
Есть и другие способы редактирования генома. Например, с помощью искусственных ферментов, которых не существует в природе, но которые способны расщеплять цепочку ДНК. Их еще называют цинковыми пальцами. Все из-за того, что этот белковый модуль включает в себя один или несколько ионов цинка.
Редактировать гены возможно, но это сложно.
Такой способ требовал сложного подхода и долгой подготовки. Для каждого разреза в определенных участках генома надо было синтезировать специфичный белок. Кроме того, подобный способ редактирования часто приводил к ошибкам, так как разрезы часто происходили не в тех местах, где было нужно. Это лишний раз доказывает то, что вероятность ошибки очень высока, а неточности на начальных этапах могут привести к тому, что сбои будут идти, как снежный ком.
История человека-паука с точки зрения науки
Многие смотрели фильм про человека-паука, который начинается с того, что студента кусает генно-модифицированный паук. После этого гены паука встроились в ДНК человека, и обычный парень получил сверхспособности – научился лазать по стенам и выпускать паутину.
Однако ученые-генетики обращают внимание на то, что сюжет фильма – это чистая фантазия. В реальности такое произойти не может
Просто потому, что яд паука состоит из глобулярных белков, и в нем вообще нет паучьей ДНК.
Зато в новейших вакцинах есть молекулы генетического кода вируса. Давайте рассмотрим две самые передовые вакцины, о которых сегодня можно услышать из каждого утюга.
Игрушки и инструменты
Сегодня в разных лабораториях мира «собрано» уже огромное количество генетически модифицированных организмов (ГМО) с самыми разными признаками. Некоторые из них выглядят просто живыми курьезами, шуткой экспериментатора
Скажем, если светящиеся орхидеи сингапурца Чья Тет Фатта привлекают внимание своей красотой (правда, в основном на фотографиях — увидеть их свечение простым глазом почти невозможно), то трансгенные поросята американского профессора Рэнди Пратера со светящимися же пятачками и копытцами откровенно смешны — хотя и те, и другие создавались во вполне практических целях: блеск маркировал те ткани, где работал пересаженный участок ДНК. Примерно из таких же соображений были «выведены» зеленые мыши и обезьянки, картошка «полей меня!», начинающая сверкать при нехватке влаги и в иных стрессовых для растения ситуациях, а также многие другие странные организмы
Кажется, только флуоресцирующая зеленым светом крольчиха Альба была «придумана» бразильским художником Эдуарду Кацем как чисто художественное произведение. Все остальные служат инструментами для добычи новых знаний. Они помогают ученым понять, как организм управляет генами и как сам ген узнает, когда ему начинать и когда прекращать работу.
Разумеется, для того, чтобы стать средством научного поиска, ГМ-организму не обязательно светиться. Более того, самый мощный вклад в исследования последних лет внесли существа, отличающиеся от нормальных сородичей не лишними, а, наоборот, недостающими генами. Технологии генной инженерии позволяют не только пересадить зародышу чужой ген, но и избирательно вырезать или лишить активности его собственный, причем вполне определенный. Такие животные получили название «нокаутных». Понятно, что метод «нокаутирования» позволяет прямо выяснять функции выбитой «детали», ее роль в тех или иных физиологических процессах. Особенным успехом у современных экспериментаторов пользуются «нокаутные» мыши, сыгравшие в функциональной генетике примерно ту же роль, что мушки-дрозофилы в генетике классической. Из всех быстро размножающихся и хорошо изученных животных мышь ближе всего к человеку: подавляющее большинство наших генов есть и у нее. Так вот, «нокаутные» мыши позволили нащупать молекулярные механизмы огромного числа нормальных и патологических процессов — от запоминания и поведения до канцерогенеза и старения. Последовательные «отключения» одного гена за другим позволили ученым поставить вопрос о «минимальном геноме»: каков критический набор генов, позволяющий тому или иному существу жить и выполнять свои функции?
И в поле, и в аптеке
Уже в 1992 году ГМ-организмы вышли «на широкий оперативный простор»: в Китае началось выращивание трансгенного табака, устойчивого к вредителям. С 1996 года публикуется мировая статистика по трансгенным сельскохозяйственным культурам. В 2004 году общая площадь, которую они занимают на полях планеты, превысила 80 миллионов га. Общее число таких сортов исчисляется сотнями, к промышленному «применению» разрешены десятки. ГМ-кукуруза, ГМ-рапс и ГМ-хлопчатник захватили значительную долю рынка соответствующих культур. Но рекорд принадлежит сое: из каждых трех ее бобов, поступающих в продажу, два — измененные человеком.
Успехи могли бы быть и значительнее, если б трансгенные культуры не «наткнулись» во многих странах на яростные протесты. В 1998 году страны Евросоюза даже ввели мораторий на регистрацию новых ГМО (хотя все это время в Германии и Испании продолжали сеять ранее зарегистрированные сорта). Четыре года спустя на смену этому запрету пришли исключительно строгие и подробные правила обращения с «рукотворными» культурами и продуктами из них. Прописанные в этом документе меры безопасности мало отличаются от тех, что соблюдаются при работе с возбудителями чумы или сибирской язвы. Впрочем, швейцарцев, например, не удовлетворили даже такие строгости: в ноябре прошлого года 58% граждан альпийской конфедерации проголосовали на общенациональном референдуме за пятилетний запрет на выращивание чего-либо, генетически модифицированного.
Опасное лекарство
Но, если можно, внедрив человеческий ген в бактериальную клетку, заставить ее производить нужное больному вещество, почему бы не вставить этот ген в клетки самого пациента, раз и навсегда избавив его от недуга?
Идея такой «терапии» возникла сразу же, как только перенос генов из одного организма в другой стал возможным практически. Первые клинические испытания (правда, не в медицинских, а в исследовательских целях) прошли еще в 1989 году. А уже через полтора года в Медицинском центре города Бетесда (США) стартовала экспериментальная программа лечения одного из врожденных иммунодефицитов, а именно — редкой болезни, которая исключает развитие у ребенка иммунной системы, обрекая его на смерть от первой подхваченной инфекции. До появления генной терапии ничем нельзя было помочь таким младенцам. Теперь же американские врачи берут их кроветворные клетки, вводят в них исправную копию гена, дефект которого послужил первопричиной недуга, и возвращают «отремонтированные» клетки обратно в организм.
Борьба с иммунодефицитами ярко продемонстрировала миру возможности генной терапии. Однако… уже в 2002 году самая масштабная программа такого рода (французская) была закрыта: у двух из одиннадцати маленьких пациентов обнаружилась лейкемия. Видимо, это не случайное совпадение. Вектор с доставляемыми генами может внедриться в любой участок генома, и у пострадавших детей он оказался соседом гена LMO2, о котором давно известно, что его избыточная активность (которую вполне может обеспечить входящий в состав вектора мощный вирусный промотор) приводит к белокровию. Конечно, вероятность того, что вектор внедрится именно рядом с LMO2 или другим протоонкогеном, мала. Но каждому ребенку ввели примерно миллион «генетически отремонтированных» клеток, а для развития лейкемии может хватить и одного рокового совпадения. Уже после закрытия программы болезнь диагностировали еще у одного ее пациента. Летальные исходы (правда, не связанные с лейкемией) отмечались и в некоторых американских программах.
Удар был тяжелым. «Генная терапия переживает трудные времена», — констатировал в ноябре 2004 года президент Европейского общества по изучению этого метода профессор Бернд Гансбахер. Впрочем, неудачи скомпрометировали применение в медицине вирусных векторов, но не саму идею лечения генами. И сегодня медики рассматривают возможность безвирусной доставки в клетку нужных молекул. В биотехнологии она давно уже используется: например, с помощью липосом (жировых пузырьков-капсул, способных просачиваться сквозь клеточную мембрану) или «генных пушек», из которых ведется прямой обстрел клеток микрочастицами золота с зафиксированными на их поверхности генами. Правда, эти пути свободны как от опасностей, так и от удобств векторного переноса: вероятность встраивания переносимого таким образом гена в хромосому клетки-мишени намного меньше, и нет никаких гарантий, что даже в случае успешного попадания он начнет там работать.
Так или иначе, по словам заведующего лабораторией пренатальной диагностики наследственных и врожденных болезней НИИ акушерства и гинекологии РАМН профессора Владислава Баранова, сегодня в мире одобрено более 600 проектов клинических испытаний генно-терапевтических методик. Близки к выходу в практику методики лечения иммунодефицитов, диабета, заболеваний сосудов, трофических язв, некоторых онкологических заболеваний. По единодушному мнению медицинского сообщества, через 10—15 лет «генетический ремонт» превратится в массовую процедуру.
Что вирус может сделать с нашей ДНК?
Итак, вирус действительно способен изменить ДНК человеческой клетки. Но далеко не каждый! Такой способностью обладают только ретровирусы.
Это семейство вирусов обладает особым ферментом – «интегразой». Этот фермент буквально приклеивает вирусный геном к ДНК человека, подчиняя себе клетку и заставляя ее создавать новые ретровирусы.
В большинстве случаев зараженная клетка с испорченным ДНК погибает. Однако в редких случаях ретровирус заражает сперматозоид или яйцеклетку. И если происходит оплодотворение с участием зараженной клетки, то абсолютно все клетки эмбриона будут содержать вирусную ДНК. Фактически, этот вирус способен создавать мутантов.
К счастью, это происходит крайне редко. Последний раз ретровирус изменил геном человека более 100 тысяч лет назад. Однако за время эволюции это происходило много раз, поэтому ДНК человека на целых 8% состоит из кусочков ДНК древних ретровирусов, которые заражали половые клетки наших предков.
Ученые утверждают, что ретровирусы являются мощным двигателем эволюции. Например, именно благодаря встрече с ретровирусом у предка всех млекопитающих, жившего 160 миллионов лет назад, появился такой важный орган как плацента.
Интересный факт!