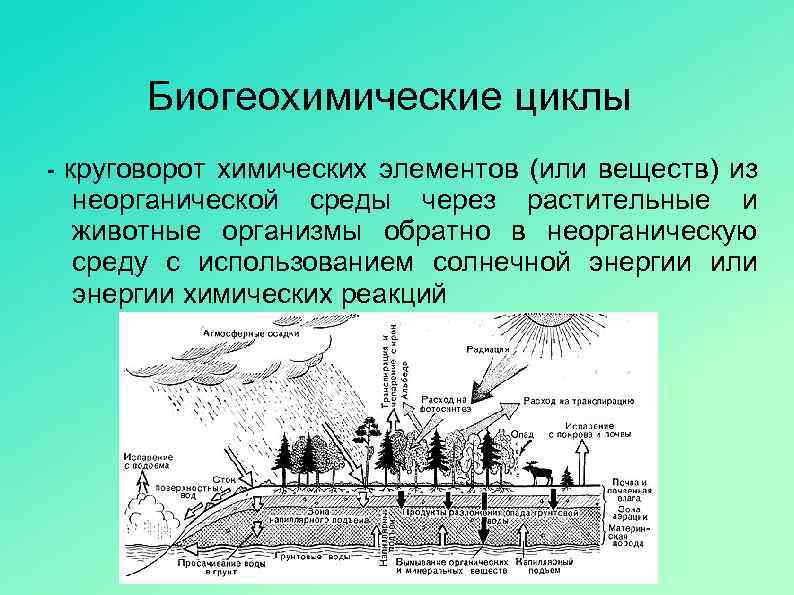
Погрешности пульсоксиметра
Прибор может давать неточные данные в таких случаях:
- устройство низкого качества;
- не заряжен аккумулятор или незаменимы исчерпавшие ресурс батарейки;
- измерения выполняются сразу после физической нагрузки;
- ногти украшены декоративным покрытием;
- пальцы рук холодные;
- на лице маска, материал которой плохо пропускает воздух.
Для получения корректных результатов важно, чтобы устройство было качественным – лучше покупать пульсоксиметр от проверенных временем производителей. Измерения следует проводить в покое
Если перед тестом человек ходил, делал домашнюю работу, следует дать организму время на отдых.
Причины одышки
Одышка вызывается различными причинами. Наиболее частыми причинами одышки являются:
- заболевания сердечно-сосудистой системы. Сердечно-сосудистые патологии приводят к недостаточному кровообращению. Органы не получают необходимое количество кислорода, в крови накапливается углекислый газ. Организм реагирует на подобное состояние учащением дыхания – через легкие за единицу времени прокачивается больше воздуха. Одышка, обусловленная сердечной патологией, возникает или усиливается после физических нагрузок или в положении лежа. В сидячем или полусидячем положении одышка проходит. Подобная одышка характеризуется затрудненным вдохом;
- патологии дыхательной системы. Одышка может быть обусловлена возникновением препятствий для прохождения воздуха через дыхательные пути, например, при сужении просветов бронхов. Поэтому одышка – типичный симптом при бронхиальной астме. В этом случае затруднён выдох. Также одышка может вызываться уменьшением дыхательной поверхности легочной ткани. В результате подобного уменьшения, для того чтобы сохранить необходимое количество поступающего в кровь кислорода, требуется более интенсивная работа легких, то есть более частый вдох. Список заболеваний дыхательной системы, при которых может наблюдаться одышка, обширен и включает такие опасные патологии как опухоли, пневмонию, хронические обструктивные болезни легких и другие;
- анемия. Недостаток красных кровяных телец (эритроцитов) и гемоглобина приводит к тому, что даже при нормальной работе сердца и легких, кровь не в состоянии обеспечить органы необходимым количеством кислорода, и организм пытается компенсировать это, увеличив частоту дыхания;
- неврозы и панические атаки. В этом случае клиническое обследование не выявляет патологий сердца и легких, но субъективно больной испытывает недостаток воздуха, а психоэмоциональные изменения приводит к учащению дыхания.
- ожирение и сахарный диабет также часто приводят к появлению одышки.
История открытия[ | код]
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью большой линзы).
- 2HgO→t2Hg+O2↑{\displaystyle {\ce {2HgO -> 2Hg + O2 ^}}}.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела очень большое значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Для чего проводят измерения
Показатель кислорода измеряют с целью определить состояние здоровья и своевременно выявить гипоксемию, которая может стать причиной летального исхода. Посредством этого просто анализа определяют степень заболевания и принимают меры, направленные на стабилизацию состояния.
С появлением COVID-19 используют термин Silent Hypoxemia, который переводится, как «тихая гипоксемия». Его появление связано с тем, что около 50% больных, поступающих на госпитализацию, имеют низкий уровень сатурации, при этом симптоматика говорит обратное. У пациентов не наблюдается отдышка, их не мучает кашель, а температура тела находится на нормальном уровне. Однако, компьютерная томография показывает значительное поражение легких, поэтому пациента подключают к кислородной поддержке.
Состав воздуха
О2 выполняет функцию окислительных процессов в человеческом теле, которые позволяют выделить энергию для нормальной жизнедеятельности. В состоянии покоя человеческий организм требует около 350 миллилитров кислорода, при тяжелых физических нагрузках это значение возрастает в три-четыре раза.
Сколько процентов кислорода в воздухе, которым мы дышим? Норма равна 20,95%. Выдыхаемый воздух содержит меньшее количество О2 – 15,5-16%. Состав выдыхаемого воздуха также включает углекислый газ, азот и другие вещества. Последующее понижение процентного содержания кислорода приводит к нарушению работы, а критическое значение 7-8% вызывает летальный исход.
Содержание прочих элементов в воздухе в различных условиях представлено в таблице ниже.
| Кислород, % | Углекислый газ, % | Азот и другие элементы, % | |
| Вдыхаемый воздух | 20,95 | 0,03 | 79,02 |
| Выдыхаемый воздух | 16,3 | 4 | 79,7 |
| Альвеолярный воздух | 14,5 | 5 | 80,5 |
Из таблица можно понять, например, что в выдыхаемом воздухе содержится очень много азота и дополнительных элементов, а вот О2 всего 16,3%. Содержание кислорода во вдыхаемом воздухе примерно составляет 20,95%.
Важно понять, что представляет собой такой элемент, как кислород. О2– наиболее распространенный на земле химический элемент, который не имеет цвета, запаха и вкуса
Он выполняет важнейшую функцию окисления в атмосфере.
Без восьмого элемента периодической таблицы нельзя добыть огонь. Сухой кислород позволяет улучшить электрические и защитные свойства пленок, уменьшать их объемный заряд.
Содержится этот элемент в следующих соединениях:
- Силикаты – в них присутствует примерно 48% О2.
- Вода (морская и пресная) – 89%.
- Воздух – 21%.
- Другие соединения в земной коре.
Воздух содержит в себе не только газообразные вещества, но и пары и аэрозоли, а также различные загрязняющие примеси. Это может быть пыль, грязь, другой различный мелкий мусор. В нем содержатся микробы, которые могут вызывать различные заболевания. Грипп, корь, коклюш, аллергены и прочие болезни – это лишь малый список негативных последствий, которые появляются при ухудшении качества воздуха и повышении уровня болезнетворных бактерий.
Процентное соотношение воздуха – это количество всех элементов, которые входят в его состав. Показать наглядно, из чего состоит воздух, а также процент кислорода в воздухе удобнее на диаграмме.
Диаграмма отображает, какого газа содержится больше в воздухе. Значения, приведенные на ней, будут немного отличаться для вдыхаемого и выдыхаемого воздуха.
Диаграмма соотношение воздуха.
Выделяют несколько источников, из которых образуется кислород:
- Растения. Еще из школьного курса биологии известно, что растения выделяют кислород при поглощении углекислого газа.
- Фотохимическое разложение водяных паров. Процесс наблюдается под действием солнечного излучения в верхнем слое атмосферы.
- Перемешивание потоков воздуха в нижних атмосферных слоях.
Примечания
- Дикислород // Большая Энциклопедия Нефти Газа
- J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ Inorganic Crystal Structure Database
- Margaret-Jane Crawford и Thomas M. Klapötke The trifluorooxonium cation, OF3+ // Journal of Fluorine Chemistry. — 1999. — Т. 99. — С. 151-156.
-
Curie P., Curie M. (1899). «Effets chimiques produits par les rayons de Becquerel». Comptes rendus de l’Académie des Sciences 129: 823-825.
- Радиационная химия // Энциклопедический словарь юного химика. 2-е изд.. — М.: 1990. — С. 200.
-
Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28-33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4. (см. ISBN )
- Food-Info.net : E-numbers : E948 : Oxygen.
Как измерить сатурацию пульсоксиметром
Каждый человек сможет купить прибор для измерения сатурации на палец — пульсоксиметр, с целью контроля в бытовых условиях. Он визуально похож на прищепку.
Как уже сказали выше, её фиксируют на пальце. На протяжении 60 секунд датчик, встроенный в устройство, считывает и анализирует данные. Пульсоксиметр оборудован дисплеем, на который выводятся две цифры. Одна демонстрирует процент кислорода, вторая – пульс.
PRbpm (pulse rate beats per minute) на пульсиксометре показывает силу пульса, измеряется в количестве ударов в одну минуту.
В медицинских учреждениях применяют инвазивное оборудование, посредством которого получают газовый состав биологического материала.
Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
Некоторые оксиды поглощают кислород:
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
Озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
Фториды кислорода
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.) OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Примечания[ | код]
- Комментарии
- Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
- Источники
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 387. — 671 с. — 100 000 экз.
- J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ Кнунянц И. Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 387—389. — 671 с. — 100 000 экз.
- Я. А. Угай. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — С. 432—435. — 527 с.
- Campbell, Neil A.; Reece, Jane B. Biology, 7th Edition. — San Francisco: Pearson – Benjamin Cummings, 2005. — С. 522–23. — ISBN 0-8053-7171-0.
- Freeman, Scott. Biological Science, 2nd. — Upper Saddle River, NJ: Pearson – Prentice Hall, 2005. — P. 214, 586. — ISBN Biological Science, 2nd.
- . Дата обращения: 26 июля 2015.
- . Дата обращения: 26 июля 2015.
- . Дата обращения: 25 марта 2016.
- , с. 127.
- ↑ . Дата обращения: 3 августа 2009.
- Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28—33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4.
- Вредные химические вещества: Неорганические соединения элементов V—VIII групп. Справочник. — Л., 1989. — С. 150—170
Химические свойства[ | код]
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, так как фтор более электроотрицателен, чем кислород). Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li+O2⟶2Li2O{\displaystyle {\ce {4Li + O2 -> 2Li2O}}}
- 2Sr+O2⟶2SrO{\displaystyle {\ce {2Sr + O2 -> 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO+O2⟶2NO2↑{\displaystyle {\ce {2NO + O2 -> 2NO2 ^}}}
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6+15O2⟶12CO2+6H2O{\displaystyle {\ce {2C6H6 + 15O2 -> 12CO2 + 6H2O}}}
- CH3CH2OH+3O2⟶2CO2+3H2O{\displaystyle {\ce {CH3CH2OH + 3O2 -> 2CO2 + 3H2O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH+O2⟶CH3COOH+H2O{\displaystyle {\ce {CH3CH2OH + O2 -> CH3COOH + H2O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
-
- 2Na+O2⟶Na2O2{\displaystyle {\ce {2Na + O2 -> Na2O2}}}
Некоторые оксиды поглощают кислород:
-
- 2BaO+O2⟶2BaO2{\displaystyle {\ce {2BaO + O2 -> 2BaO2}}}
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
-
- H2+O2⟶H2O2{\displaystyle {\ce {H2 + O2 -> H2O2}}}
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
-
- Na2O2+O2⟶2NaO2{\displaystyle {\ce {Na2O2 + O2 -> 2NaO2}}}
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
-
- K+O2⟶KO2{\displaystyle {\ce {K + O2 -> KO2}}}
Неорганические озониды содержат ион O−3 со степенью окисления кислорода, формально равной −⅓. Получают действием озона на гидроксиды щелочных металлов:
-
- 3KOH+3O3⟶2KO3+KOH⋅H2O+2O2↑{\displaystyle {\ce {3KOH + 3O3 -> 2KO3 + KOH * H2O + 2O2 ^}}}
В ионе диоксигенила O+2 кислород имеет формально степень окисления +½. Получают по реакции:
-
- PtF6+O2⟶O2PtF6{\displaystyle {\ce {PtF6 + O2 -> O2PtF6}}}
В этой реакции кислород проявляет восстановительные свойства.
Фториды кислорода | код
Дифторид кислорода, OF2, степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
-
- 2F2+2NaOH⟶2NaF+H2O+OF2↑{\displaystyle {\ce {2F2 + 2NaOH -> 2NaF + H2O + OF2 ^}}}
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
-
- F2+O2⟶O2F2{\displaystyle {\ce {F2 + O2 -> O2F2}}}
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифтороксония (англ.) OF+3. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Нахождение в природе[ | код]
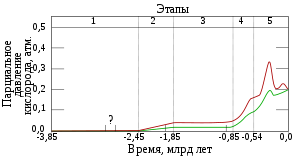
Накопление O2 в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка. 1. (3,85—2,45 млрд лет назад) — O2 не производился2. (2,45—1,85 млрд лет назад) — O2 производился, но поглощался океаном и породами морского дна3. (1,85—0,85 млрд лет назад) — O2 выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя4. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O2 в атмосфере5. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O2 в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад кислород начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[нет в источнике]. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Медицинский кислород хранится в металлических газовых баллонах высокого давления (для сжатых или сжиженных газов) голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горения.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода[ | код]
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом.
Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях для улучшения обменных процессов в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, .
Магнитное свойство — кислород
Магнитные свойства кислорода отличаются от магнитных свойств, присущих другим газам.
Магнитные свойства кислорода высоки по сравнению с магнитными свойствами других газов, однако по своей абсолютной величине они незначительны.
Магнитные свойства кислорода отличаются от магнитных свойств, присущих другим газам.
Это позволяет использовать магнитные свойства кислорода для избирательного измерения его концентрации в промышленных газовых смесях.
|
Сосуды Дью-ара ( в разрезе. |
Как уже упоминалось, магнитные свойства кислорода указывают на наличие в молекуле 02 двух неспаренных электронов. Эти электроны размещаются на разрыхляющих молекулярных тг-орбиталях. Парамагнитность кислорода проявляется, в частности, в том, что жидкий кислород притягивается магнитом.
|
Объемная магнитная восприимчивость газов х при 0е С. |
Принцип действия этих газоанализаторов основан на магнитных свойствах кислорода, резко отличающихся от магнитных свойств других газов.
|
Схема чувствительного элемента магнитного газоанализатора на кислород МГК-348. |
Как следует из данных табл. 19, магнитные свойства кислорода и других газообразных компонентов продуктов сгорания весьма значительно отличаются. На использовании этих особенностей кислорода основываются различные схемы газоанализаторов, предназначенных для определения концентрации кислорода в смеси газов.
|
Схема магнитного газоанализатора на кислород. |
Большинство газоанализаторов для определения содержания кислорода основано на магнитных свойствах кислорода. Дело в том, что кислород в отличие от большинства других газов обладает резко выраженными парамагнитными свойствами. Это значит, что кислород под действием магнитного поля намагничивается и притягивается полем, между тем как другие газы магнитным полем отталкиваются. Чем выше температура кислорода, тем слабее он притягивается магнитным полем. Это свойство кислорода и положено в основу действия газоанализатора.
Магнитные газоанализаторы основаны на измерении тех или иных параметров физических явлений, связанных с магнитными свойствами кислорода.
Непосредственное измерение объемной магнитной восприимчивости сложно, поэтому измерения содержания кислорода в газовых смесях основаны на косвенных методах, связанных с магнитными свойствами кислорода.
Непосредственное измерение этих величин очень сложно и поэтому магнитные методы измерения содержания кислорода в газовых смесях основаны на косвенных явлениях, связанных с магнитными свойствами кислорода.
Сатурация при коронавирусе
Заболевание коронавирусной инфекцией характеризуется мощным и всеобъемлющим поражением основного органа дыхания – легких. Поражаются в первую очередь альвеолы — единичные клетки, выполняющие газообмен между воздухом, попадающим в легкие, и кровью, переносящей кислород к клеткам организма.
Альвеолы и их перегородки блокируются вирусом и воспаляются, в результате их полезная работа за короткий промежуток времени снижается до нуля. Воспаление переходит на соседние альвеолы, пораженная площадь увеличивается. В результате объем кислорода, поступающий за единицу времени в организм, непрерывно снижается.
Состояние постепенно или достаточно резко (за 3-5 суток) ухудшается, самочувствие субъективно оценивается эпитетами «уставший» или «вымотанный», проявляются простудные симптомы.
Важно то, что пострадавший не знает о факте заражения до обнаружения состояния, в котором организм уже истощен, а объем поражений в легких способен привести к катастрофе. Сатурация кислорода при коронавирусе является критерием степени поражения организма
При слишком низком значении необходима незамедлительная медицинская помощь – вплоть до подключения к аппарату искусственного дыхания
Сатурация кислорода при коронавирусе является критерием степени поражения организма. При слишком низком значении необходима незамедлительная медицинская помощь – вплоть до подключения к аппарату искусственного дыхания.
Итоги
Наиболее опасные вещи, сильный взрыв, и пожар, может произойти из-за того, что жидкий кислород проконтактировал с маслами. Во время их взаимодействия появляются перекисные взрывоопасные соединения, которые и могут взорваться при нагревании баллона, или вследствие удара и сотрясения.
Очень опасно соединение масла с кислородом при наличии сильного давления, или если кислород находится в жидком виде. Взрывоопасной ситуации возгорания могут произойти при заправке баллоном, или если в него случайно попало масло. Взрывоопасная ситуация может возникнуть при открытии вентиля кислородных баллонов в рукавицах, которые были испачканы маслом. Поэтому в тех местах, где хранится баллон с кислородом, обязательно должно быть предупреждение о том, что это маслоопасно.







![Lab4:классификация_магнетиков [лаборатория электричества и магнетизма нгу]](http://mediaex.ru/wp-content/uploads/e/0/5/e0596402ccbf0e70ac5d1dd03b1d6023.jpeg)











![Lab4:классификация_магнетиков [лаборатория электричества и магнетизма нгу]](http://mediaex.ru/wp-content/uploads/8/b/d/8bdb408b333845b40e313b72fc0aaadd.jpeg)











![Железобактерии и железо [1968 лысогоров н.в. - когда отступает фантастика]](http://mediaex.ru/wp-content/uploads/5/8/3/583b8e856dbbe55ee82b2892195f2836.jpeg)