Рекомендации
- ↑ и Джениш Р., Берд А., 2003. «Эпигенетическая регуляция экспрессии генов: как геном объединяет внутренние и внешние сигналы», Приложение Nature Genetics , 33 (245: 254)
- Patel A, Fondrk MK, Kaftanoglu O, Emore C., Hunt G, et al., 2007. «Создание королевы: путь TOR — ключевой игрок в развитии дифенической касты». PLoS ONE 2 (6): e509
- Оливье Жан-Жан, «Клетка, прислушивающаяся к своему окружению», Découverte, обзор Palais de la Découverte , январь-февраль 2014 г., стр. 44-51 .
- Веллен К.Е., Хацивассилиу Г., Сачдева У.М., Буй ТВ, Кросс-Дж. Р., Томпсон CB, 2009. «АТФ-цитрат-лиаза связывает клеточный метаболизм с ацетилированием гистонов», Science 5930: 1076-1080
- Андрас Палди, «Эпигенетика и метаболизм», Dossier Pour la Science , октябрь-декабрь 2013 г., стр. 104-109
- Белл Дж. Т., Пай А. А., Пикрелл Дж. К., Гаффни Д. Д., Пике-Реги Р., Дегнер Дж. Ф., Гилад Й, Притчард Дж. К. (2011). «Паттерны метилирования ДНК связаны с генетическими вариациями и вариациями экспрессии генов в клеточных линиях HapMap». Геномная биология 12 (1): R10
- Vertino PM, Spillare EA, Harris CC, Baylin SB (апрель 1993). «Измененные паттерны хромосомного метилирования сопровождают индуцированную онкогенами трансформацию эпителиальных клеток бронхов человека». Cancer Res . 53 (7): 1684–9
- Кубал П., Винсент К. Коэн, Э., 1999. «Эпигенетическая мутация, ответственная за естественные вариации в симметрии цветков», Nature , 401, 157-161
- Kronforst MR, Giley DC Strassman JE, Queller D., 2008. «Метилирование ДНК широко распространено среди социальных перепончатокрылых», Current Biology 19: R287– R288.
- Weiner SA, Galbraith DA, Adams DC, Valenzuela N., Noll FB, Grozinger CM, Toth AL. 2013 «Исследование метилирования ДНК у социальных видов насекомых, стадий жизни и каст показывает обильное и кастовое метилирование у примитивно социальных ос», Naturwissenschaften 100: 795: 799.
- Фредерик Бергер, «Память клетки», Dossier Pour la Science , октябрь-декабрь 2013 г., стр. 93-97
- Sheldon, CC et al., 1999. «Ген FLF MADS box: репрессор цветения у Arabidopsis, регулируемый яровизацией и метилированием», Plant Cell 11, 445-458
- Wolff, GL, Kodell, RL, Moore, SR & Cooney, CA, 1998. «Материнская эпигенетика и метиловые добавки влияют на экспрессию гена агути у мышей Avy / a», Faseb J. 12, 949-957
Какие функции выполняют белки RAS?
Семейство RAS включает три гена: KRAS, NRAS и HRAS. Гены HRAS и KRAS были идентифицированы в качестве онкогенов в 80-х годах прошлого столетия в опухолях у мышей после заражения вирусом саркомы Кирстен и Харви. Отсюда, соответственно, латинские буквы K и H в начале их названий. Ген NRAS был впервые идентифицирован в клетках нейробластомы — злокачественной опухоли из незрелых нервных клеток-нейробластов.
Ген KRAS кодирует два типа одноименных белков — A и B. Гены NRAS и HRAS кодируют по одному варианту белков. Все эти белки являются мембраносвязанными, они находятся внутри клетки и являются частью каскада биохимических реакций, запускающегося при активации белка-рецептора EGFR.
EGFR — рецептор эпидермального фактора роста. Этот белок встроен в клеточную мембрану. Он работает как молекулярная антенна: принимает сигналы извне и передает их внутрь клетки. Когда EGFR активируется, он запускает каскад биохимических реакций. Сбой в этих сигнальных путях играет огромную роль в развитии и прогрессировании злокачественных опухолей.
В норме каскад EGFR регулирует репликацию (синтез копий) ДНК, размножение и гибель клеток. Когда он постоянно активируется, клетки начинают бесконтрольно делиться, приобретают способность к инвазии (вторжению в окружающие ткани), метастазированию (миграции в организме с образованием вторичных очагов в различных органах). Причины активации сигнального пути бывают разными:
- мутации, которые приводят к увеличению количества рецепторов EGFR на поверхности клетки;
- мутации, которые меняют структуру EGFR и переводят его в постоянное активное состояние;
- изменения в генах, кодирующих другие звенья каскада, в результате чего он активируется вне зависимости от состояния EGFR.
Мутации RAS относятся к третьей категории.
Каскад EGFR, молекулы, которые принимают в нем участие, и роль белков RAS.
По своей природе белки RAS являются ГТФ-азами. Они способны связывать энергетическую молекулу гуанозинтрифосфат и работают как переключатели. В норме большая часть этих белков находится в неактивной, ГДФ(гуанозиндифосфат)-связанной форме. Это состояние «выкл». При активации EGFR RAS переходят в активную — ГТФ-связанную — форму. Сигнальный путь начинает работать, и в клетке происходят соответствующие события. Затем ГТФ-связанная форма переходит обратно в ГДФ-связанную, и сигнал прерывается.
При определенных мутациях белки RAS постоянно находятся во «включенном» состоянии. Их можно сравнить с автомобилем, в котором педаль «газа» заклинило, а педаль «тормоза» перестала работать. Клетке больше не нужны сигналы извне — она сама себе дает команду постоянно размножаться.
Регуляция экспрессии генов у прокариот
У прокариот пока молекула РНК синтезируется на участке ДНК, она тут же может транслироваться (начиная с уже синтезированного конца). Поэтому у них регуляция экспрессии (активности) генов осуществляется почти исключительно на уровне ДНК, так как в РНК часто невозможно внести какие-нибудь изменения до ее трансляции.
В 1961 г. Жакобом и Моно была предложена модель оперона как системы регуляции генов у бактерий. Оперон состоит из промотора, оператора, структурных генов оперона (их может быть разное количество) и терминатора. В области промотора прикрепляется фермент РНК-полимераза. В области оператора присоединяется белок-репрессор, который кодируется отдельно отстоящим от оперона геном-регулятором (может быть сцеплен со своим опероном, а может находиться на расстоянии).
Если белок-репрессор соединяется с оператором, то транскрипция всех структурных генов оперона становится невозможной, так как РНК-полимераза не может перемещаться по цепи ДНК.
В свою очередь активность белка-репрессора может блокироваться определенным для него низкомолекулярным соединением — индуктором (тем или иным питательным веществом бактерий). В результате взаимодействия с индуктором белок-репрессор видоизменяется и уже не может присоединиться к оператору своего оперона. В этом случае гены оперона экспрессируются (т. е. на них идет синтез).
Бывает обратная ситуация, когда индуктор активирует белок-репрессор.
Таким образом, в зависимости от того, какие индукторы находятся в цитоплазме, у прокариот экспрессируются те или иные генные группы.
Вышеописанный механизм экспрессии генов относится к негативной регуляции, так как гены транскрибируются, если они не выключены репрессором. И наоборот: не транскрибируются, если выключены.
Кроме негативной регуляции у бактерий существует также позитивная. В этом случае вместо белка-репрессора действие оказывает белок-активатор. На эти белки также действуют индукторы, активируя или инактивируя их.
Также у прокариот были выявлены опероны, которые актируются двумя регуляторными белками, соединенными друг с другом.
Источники
- Дж. Уотсон, Т. Бейкер, С. Белл, А. Ганн, г-н Левин, Р. Лосик, Молекулярная биология гена , 6- е издание, Pearson Education France, французский перевод 2008 г., сделанный г-ном Жаке и Ле Гайяром Ф. , 2009, 688 с.
- Гарри М., Молекулярная и эволюционная генетика , второе издание, Малоин, 2008, 465 с.
- Альбертс, Брей, Хопкин, Джонсон, Льюис, Рафф, Робертс, Уолтер, Основы клеточной биологии , второе издание, Medicine-Sciences Flammarion, 2004, 739 с.
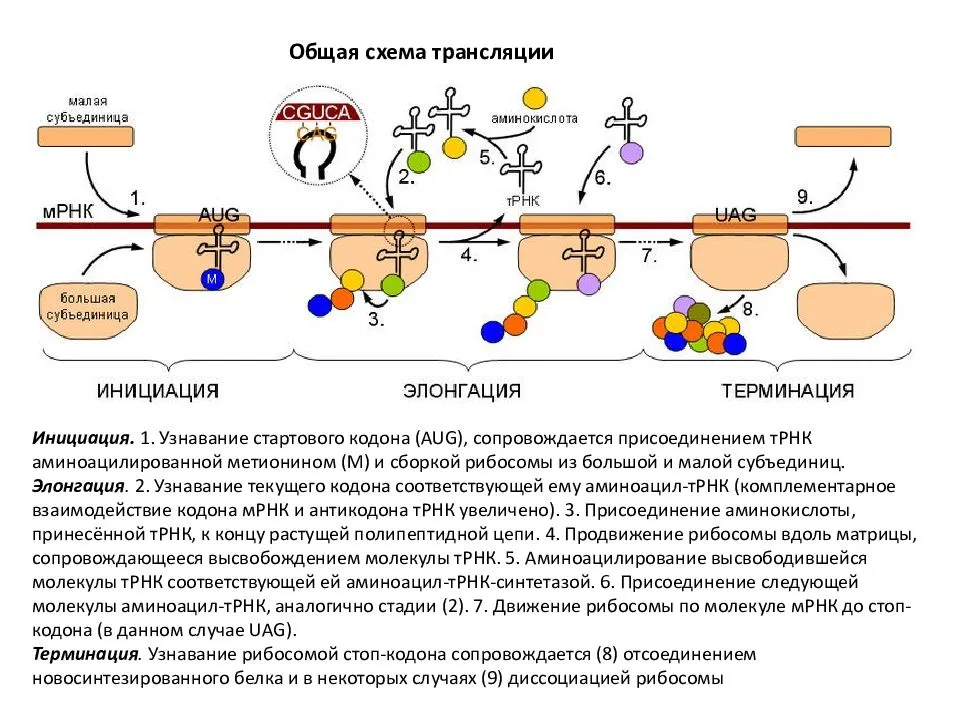
| Введение в генетику | Фундаментальная теория молекулярной биологии · ДНК · РНК · мРНК · белок · генетический код · Биосинтез белков. | ||||
|---|---|---|---|---|---|
| Транскрипция |
|
||||
| Перевод |
|
||||
| Эпигенетический контроль | Ген глушители · CRISPRoff и CRISPRon · метилирование ДНК · Гистоны код · ген Нох · геномный импринтинг |
Края резекции
Когда раковая опухоль удаляется хирургическим путем (во время хирургической биопсии, лампэктомии или мастэктомии), также удаляется ободок нормальной ткани, окружающей опухоль. Этот ободок называется:
- краем резекции;
- хирургическим краем.
Патолог оценивает края под микроскопом и определяет, содержат ли они злокачественные клетки. Это позволяет узнать, была ли удалена вся опухоль.
Оценка краев после хирургического удаления опухоли.
Отрицательными (также называются чистыми, не вовлеченными, ясными) считаются края:
- если они не содержат опухолевых клеток. По краям удаленной ткани присутствует только нормальная ткань;
- хирургического вмешательства в большинстве случаев больше не требуется.
Положительными (также называются вовлеченными) считаются края:
- если по краям находятся клетки опухоли;
- для получения отрицательных результатов скорее всего потребуется дополнительная операция;
- иногда невозможно получить отрицательные края из-за расположения опухоли (например, если она у грудной стенки или прямо под кожей).
Сомнительные/закрытые края:
- раковые клетки приближаются, но не касаются края удаленной ткани молочной железы.
- может потребоваться или не потребоваться дополнительная операция, особенно при протоковых карциномах in situ (DCIS);
- чтобы еще больше подтвердить, что образование удалено полностью, удаленную ткань можно дополнительно, кроме микроскопии, исследовать. Например, подвергнуть рентгенографии. Это полезно, когда на маммограмме были обнаружены микрокальцификации. По результатам рентгена может потребоваться повторная операция. К другим более современным методам изучения краев резекции относятся когерентная оптическая томография и количественная или ЯМР спектроскопия;
- если на маммограмме до операции были обнаружены микрокальцификаты, после операции проводят повторную маммографию, чтобы убедиться, что все они были удалены.
Существует также понятие:
- узкий хирургический край, когда к краю резекции очень близко обнаруживаются опухолевые клетки;
- широкий хирургический край, когда опухолевые располагаются далеко от края резекции.
Виды опухолей по гормональному статусу
Выделяют отрицательные и положительные опухоли:
- Тройной негативный по гормональным рецепторам или отрицательный является отрицательным по эстроген-рецепторам (ER-отрицательный) и отрицательным по прогестерон-рецепторам (PR-отрицательный). Такие виды опухолей рецепторы гормонов не экспрессируют. Это означает, что у них их мало или их нет.
- Положительный по гормональным рецепторам рак, определяется как положительный по эстроген-рецепторам (ER-положительный) и положительным по прогестерон-рецепторам прогестерона (PR-положительный). Такие виды опухолей экспрессируют гормональные рецепторы. Это означает, что у них их много.
Все виды рака молочной железы проверяются на статус гормональных рецепторов. Этот показатель опухоли помогает определить лечение.
Если установлена ER- и PR-положительная опухоль, лечение включает гормональную терапию (например, препараты тамоксифен или ингибитор ароматазы). Гормональная терапия препятствует тому, чтобы клетки опухоли получали гормоны, необходимые для роста, и может остановить рост опухоли.
Регуляция экспрессии генов у эукариот
У многоклеточных организмов в клетках разных тканей экспрессируются разные гены, т. е. для эукариот характерна дифференциальная экспрессия.
У эукариот, также как и у прокариот, существуют регуляторные белки с похожим механизмом действия. При этом для эукариот не характерна регуляция по типу оперона. Цистроны (транскрибируемые участки) эукариот обычно содержат по одному гену. (Это не касается геномов хлоропластов и митохондрий.)
Кроме регуляторных белков, взаимодействующих с ДНК, у эукариот существуют и другие способы регуляции экспрессии генов.
Конденсация и деконденсация хроматина. Это наиболее универсальный метод регуляции транскрипции. Когда нужно экспрессировать определенные гены, хроматин в этом месте деконденсируется.
Альтернативные промоторы. У гена может быть несколько промоторов, каждый из которых начинает транскрипцию с разных его экзонов в зависимости от типа клетки. В конечном итоге будут синтезированы разные белки.
Метилирование и деметилирование ДНК. Метилирование ДНК происходит в регуляторных областях гена. Метилируется цитозин в последовательности ЦГ, после чего ген инактивируется. При деметилировании активность гена восстанавливается. Процесс регулируется ферментом метилтрансферазой.
Гормональная регуляция. При гормональной регуляции гены активируются в ответ на внешний химический сигнал (поступление в клетку определенного гормона). Этот гормон запускает те гены, которые имеют специфические последовательности нуклеотидов в регуляторных областях.
Геномный импринтинг. Это малоизученный способ регуляции экспрессии генов у эукариот. Он возможен только у диплоидных организмов и выражается в том, что активность генов зависит, от какого из родителей они были получены. Выключение генов осуществляется путем метилирования ДНК.
Альтернативный сплайсинг. Это регуляция на уровне процессинга. При альтернативном сплайсинге порядок сшивки экзонов может быть различным. Отсюда следует, что на основе одной и той же нуклеотидной последовательности ДНК могут быть синтезированы разные белки. Хотя их отличие друг от друга будет в основном заключаться лишь в разных сочетаниях одних и тех же аминокислот.
Тканеспецифическое редактирование РНК также протекает на уровне процессинга. Выражается в замене отдельных нуклеотидов в РНК в определенных тканях организма.
Кроме того, у эукариот иРНК часто не подвергается процессингу вообще (а распадается) или подвергается с задержкой. Это токже можно рассматривать как способ регуляции экспрессии генов.
Регуляция стабильности иРНК. У эукариот существует регуляция и на уровне трансляции, когда готовые иРНК не «допускаются» к рибосомам или разрушаются. Другие же иРНК могут дополнительно стабилизироваться для многократного использования.
Посттрансляционная модификация белка. Чтобы молекула полипептида превратилась в активную молекулу белка, в ней должны произойти различные модификации определенных аминокислот, должны быть сформированы вторичная, третичная и возможно четверичная структуры. На этом этапе также можно повлиять на реализацию генетической информации, например, не дав молекуле сформироваться.
Риборегуляторы. Были обнаружены РНК, выполняющие регуляторные функции путем ослабления работы отдельных генов.
Для высокоорганизованных животных отмечается существование надклеточного уровня регуляции экспрессии генов.
Прокариоты
Транскрипционная регуляция
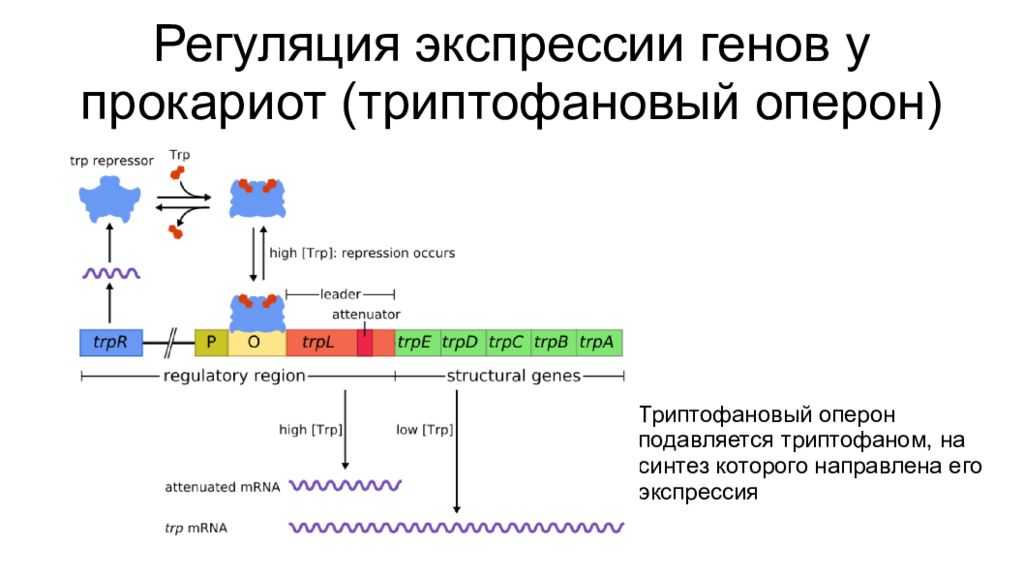
Транскрипция регулируется у бактерий в начале транскрипции. У прокариот ( эубактерий и архей ) гены сгруппированы в опероны , которые являются транскрипционными единицами. Оперон состоит из нескольких генов, транскрипция которых генерирует единственную информационную РНК . Такая информационная РНК называется полицистронной, иногда ее еще называют полицистроном. На полицистронной РНК кодирующие последовательности для каждого гена разделены некодирующими последовательностями, как правило, от 1 до 40 нуклеотидов, которые являются одним из единственных типов некодирующих последовательностей, известных у прокариот ( особенно не имеющих интронов ). Бывают случаи перекрывания генов: нуклеотиды, кодирующие последние аминокислоты первого гена, также кодируют первые аминокислоты второго гена. Эти опероны обычно участвуют в синтезе аминокислот (таких как оперон триптофана (in) ) или метаболизме питательных веществ (например, оперон лактозы ). Активность этих генов регулируется сигма-факторами (in) в зависимости от внешних условий, таких как температура или доступность молекулы. Например, в отсутствие субстрата экспрессия генов, кодирующих ферменты, участвующие в метаболизме этого субстрата, подавляется, что позволяет бактерии экономить энергию. Но если этот субстрат снова появляется в среде, индуцируется экспрессия генов, кодирующих эти ферменты. Гены одного и того же оперона регулируются согласованным образом. Молекулы, эффекторы, могут прикрепляться к аллостерическому сайту и таким образом изменять конформацию ДНК-связывающего домена. Индуктор активирует транскрипцию гена или оперона, корепрессор его подавляет.
Работать индуцибельно
Типичным случаем является оперон лактозы, который содержит три смежных гена: lac Z (кодирующий бета-галактозидазу, которая гидролизует лактозу до глюкозы + галактозы ), lac Y (кодирующая пермеазу лактозы, которая переносит лактозу в клетку) и lac A (кодирующая тиогалактозидтрансацетилазу. избавление клетки от тиогалактозида, импортированного с лактозой). В регуляции оперона участвуют два регуляторных белка: репрессор Lac и активатор CAP, эти два белка связываются с ДНК. В присутствии лактозы репрессор ингибируется лактозой и не может связываться с оператором. Таким образом, лактоза является индуктором и индуцирует трансляцию белков, участвующих в ее метаболизме. В отсутствие глюкозы белок CAP связывается с ДНК и активирует гены оперона. Но в присутствии глюкозы (лучший источник энергии, чем лактоза) экспрессия генов подавляется даже в присутствии лактозы, потому что CAP не может связываться с ДНК. Следовательно, оперон лактозы является индуцибельным опероном.
Работать подавляемый
Часто цитируемым примером является оперон триптофана, который кодирует 5 генов, участвующих в биосинтезе триптофана . Перед этим опероном находится последовательность, кодирующая репрессор. Триптофан (который является корепрессором) связывается с репрессором, который активирует его и позволяет подавлять транскрипцию генов, участвующих в его биосинтезе. В отсутствие триптофана гены активируются, и затем клетка синтезирует собственный триптофан. Таким образом, оперон триптофана является подавляемым опероном.
Регуляторные последовательности и белки
И у прокариот, и у эукариот есть последовательности, способные активировать промоторы: это энхансеры . Другие, способные их ингибировать ( инактиваторы ). Активаторы — это белки, способные связываться с ДНК, рекрутируясь на уровне РНК-полимеразы, основного фермента транскрипции. Репрессоры — это белки, которые ингибируют экспрессию генов, связываясь с промотором: они препятствуют связыванию с ним РНК-полимеразы. Прокариоты, как и эукариоты, имеют цис-регуляторные последовательности . Эти промоторы включают в себя консервативные последовательности: при 0 точки инициации транскрипции является CAT триплет (А является точка 0). Примерно -10 находится последовательность TATAAT (подобная блоку TATA у эукариот) и около -35 — последовательность TTGACA.
Некоторые белки регулируют свою собственную трансляцию, связываясь с последовательностью инициации трансляции информационной РНК. В этом случае рибосома не может связываться с информационной РНК и, следовательно, не может ее транслировать. Другая возможность основана на использовании антисмысловой РНК, спаривании с матричной РНК и формировании двухцепочечной РНК, предотвращающей трансляцию. Наконец, последний случай использует способность образовывать вторичные структуры посредством информационной РНК.
Литература
1. М. Н. Ерофеева. Электрическое раздражение кожи собаки, как условный возбудитель работы слюнных желез. Диссертация. 1912.
2. М. Н. Ерофеева. Раздражение кожи фарадическим током, как условный возбудитель слюнных желез. Труды Об-ва русских врачей, 1912, т. 79.
3. М. Н. Ерофеева. Дополнительные данные о разрушительных условных рефлексах. Известия Петроградского научного ин-та им. Лесгафта, 1921, т. III.
4. Ю. П. Феокритова. Время, как условный возбудитель слюнной железы. Диссертация. 1912.
5. О. М. Чеботарева. К физиологии условного торможения. Доклад в Обществе русских врачей 22 февраля 1912 г. Труды Об-ва русских врачей, т. 79, стр. 151 и т. 80, 1913.
6. О. М. Чеботарева. Дальнейшие материалы к физиологии условного торможения. Диссертация. 1912.
7. Э. Л. Горн. Материалы к физиологии внутреннего торможения условных рефлексов. Доклад в Обществе русских врачей 8 марта 1912 г. Труды Об-ва русских врачей, т. 79, стр. 163.
8. Э. Л. Горн. Материалы к физиологии внутреннего торможения условных рефлексов. Диссертация. 1912.
9. С. С. Фридеман. Дальнейшие материалы к физиологии диференцирования внешних раздражений. Диссертация. 1912.
10. П. Н. Васильев. Диференцирование температурных раздражителей собакой. Диссертация. 1912.
11. Г. В. Фольборт. Тормозные условные рефлексы. Диссертация. 1912.
12. Б. П. Бабкин. Основные черты деятельности звукового анализатора собаки, лишенной задних частей больших полушарий. Доклад в Обществе русских врачей 10 мая 1912 г. Труды Об-ва русских врачей, т. 79.
13. С. П. Кураев. Исследование собак с нарушенными передними долями больших полушарий в позднейший послеоперационный период. Диссертация. 1912.
14. И. П. Павлов. Главнейшие законы деятельности центральной нервной системы, как они выясняются при изучении условных рефлексов. Доклад на Сеченовском заседании Общества русских врачей 15 марта 1912 г. Двадцатилетний опыт, изд. 1923 г.
15. И. П. Павлов. Сводка результатов опытов с экстирпацией различных участков больших полушарий по методу условных рефлексов. Доклад в Обществе русских врачей 27 сентября 1912 г. Двадцатилетний опыт, изд. 1923 г.
16. И. П. Павлов. Внутреннее торможение, как функция больших полушарий. Статья в сборнике, посвященная К. Рише, 1912 г. Двадцатилетний опыт, изд. 1923 г.
17. Н. А. Рожанский. К физиологии сна. Доклад в Обществе русских врачей 12 января 1912 г. Труды Об-ва русских врачей, т. 79, стр. 107. (См. следующую главу).










![Глава x - 1912 [1948 майоров ф.п. - история учения об условных рефлексах]](http://mediaex.ru/wp-content/uploads/e/e/c/eec42f49a0275fe03470c32f4adf9fea.jpeg)
![Основы генетики [1992 власов н.н., камерницкий а.в., медведева и.м. - охотничье собаководство]](http://mediaex.ru/wp-content/uploads/d/1/b/d1bd5b9cf0f465a27d4f0af4800e1bc1.jpeg)








![Глава x - 1912 [1948 майоров ф.п. - история учения об условных рефлексах]](http://mediaex.ru/wp-content/uploads/c/c/3/cc31d39bd0e9eadc35858e197d006565.png)
![Основы генетики [1992 власов н.н., камерницкий а.в., медведева и.м. - охотничье собаководство]](http://mediaex.ru/wp-content/uploads/3/0/0/30022c18eb2755b9cb4408ce24947a13.jpeg)






![Глава x - 1912 [1948 майоров ф.п. - история учения об условных рефлексах]](http://mediaex.ru/wp-content/uploads/2/8/c/28c2c20617c2036f1f0b2ee3afff353f.png)