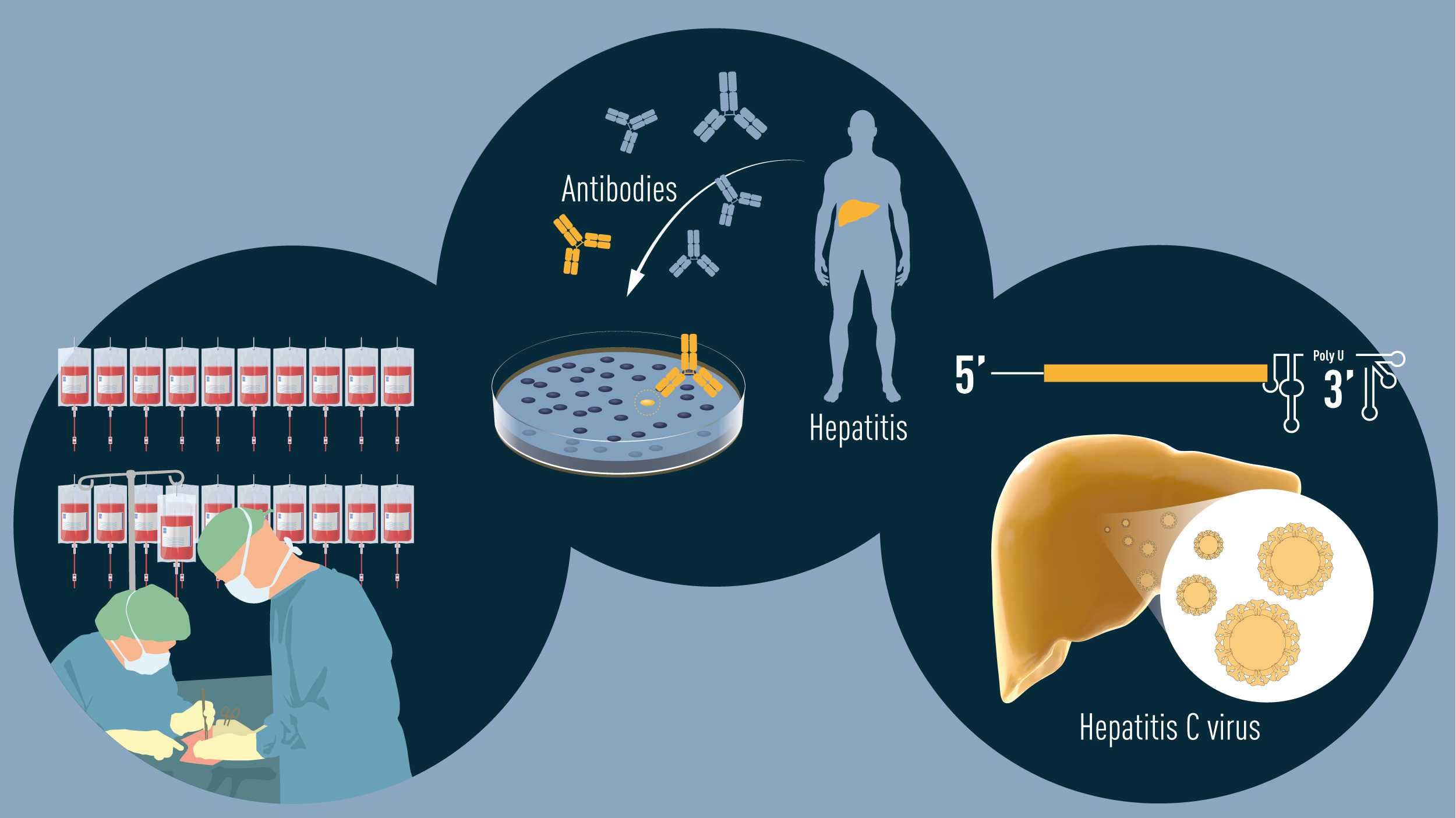
Вместо ботокса
Недавно на рынке появились пептидные кремы, которые стали альтернативой ботоксу. В основе этой косметологической революции лежит нобелевское открытие Мартина Родбелла (1994) о том, что нервные импульсы влияют на мышечную активность. Эти кремы против мимических морщин содержат особые вещества — пептиды, которые блокируют напряжение лицевых мышц, в результате чего разглаживаются морщинки на лице и шее. Ботокс разрывает соединения между нервами и мышцами, поэтому мимика человека «замораживается». А пептиды нетоксичны и не влияют на мимику лица, но также эффективно борются с морщинами.
Гликаны
За работы в этой области присуждено семь Нобелевских премий – согласитесь, хорошая рекомендация. А вообще гликаны играют важную роль в организме – например, от них зависит, какая у человека группа крови. Также гликаны отвечают за межклеточную коммуникацию: они передают сигналы окружающим клеткам и так запускают метаболические процессы, можно сказать, отдают «команды» клеткам поддерживать упругость кожи. Пока в коже достаточно гликанов, она молодая. К сожалению, с возрастом их количество снижается. Знаменитая гиалуроновая кислота — одно из тысячи соединений, называемых гликанами. Структура гликанов настолько сложна, что с трудом поддается изучению — например, в 70-х годах из-за недостатка научной базы исследования в области гликобиологии были прекращены. Сейчас известно, что эти соединения способны влиять на все слои кожи: на поверхности они придают ей сияние, в дерме — укрепляют межклеточные связи.
Резюме
Рак убивает миллионы людей каждый год и до сих пор остается одним из важнейших вызовов, брошенных человечеству, с точки зрения медицины. Благодаря стимулированию уже имеющейся способности иммунной системы атаковать опухолевые клетки нобелевские лауреаты этого года сделали возможным создание противоопухолевой терапии, основанной на совершенно новых принципах.
Джеймс П. Эллисон изучил открытый ранее белок, который работал в качестве «тормоза» иммунной системы. Он осознал потенциальную возможность выключения этого «тормоза», что привело бы к нападению иммунных клеток на опухоль. Затем он начал работать над превращением этой идеи в конкретные методы лечения пациентов.
Параллельно с ним Тасуку Хондзе обнаружил другой белок на поверхности иммунных клеток, и после тщательного исследования его функции пришел к выводу, что он также работает в качестве «тормоза», но его действие основано на несколько других механизмах. Методы лечения, основанные на его открытии, могут быть очень эффективны в борьбе против онкологических заболеваний.
Эллисон и Хондзе продемонстрировали, как разные стратегии в ингибировании этих «тормозов» иммунной системы могут быть использованы в качестве противоопухолевой терапии. Результаты трудов двух нобелевских лауреатов являются настоящей вехой в нашей борьбе против рака.
Коэнзим Q10
За открытие Q10 профессор Митчелл получил Нобелевскую премию в 1978 году. Это настоящий энергетик для наших клеток. Сегодня многие испытывают спад жизненной энергии, апатию и сонливость, даже если спят достаточное для себя количество часов. Затем проявляются первые признаки сбоев в работе сердечно-сосудистой системы – постоянно холодные руки и ноги, онемение шеи и плеч, частые головные боли. И лишь немногие догадываются, что это проявление возрастного дефицита коэнзимаQ10. «Уставшее лицо» — вот, что многие могут сказать про себя.
В свое время формула с коэнзимом совершила революцию средикосметических средств. А компания «Байерсдорф» (марка Nivea и другие) первая в мире предложила решение по промышленному синтезу и последующей стабилизации Q10 в формуле косметического крема. В наши дни обновленная линия NIVEAVisageQ10 PLUS содержит еще в два раза больше коэнзимаQ10, чем разработанная в те годы, благодаря чему она стала более эффективной. А семейство Q10, разумеется, пополнилось многочисленными новинками.
Ингибиторы контрольных точек в лечении рака сегодня и в будущем
После первых работ, показывающих эффект блокады CTLA-4 и PD-1 началось бурное изучение этого вопроса. Теперь мы знаем, что метод лечения, часто называемый «ингибирование контрольных точек», радикально влияет на исход нескольких групп пациентов с тяжелыми стадиями онкологических заболеваний. Также как и в случае с другими вариантами противоопухолевой терапии, наблюдаются побочные эффекты, в том числе и жизнеугрожающие. Они связаны с гиперактивацией иммунного ответа, что приводит к аутоиммунным реакциям, но это, как правило, управляемый процесс. И сейчас исследования направлены на то, чтобы лучше понимать механизм действия, что позволит улучшить само лечение и уменьшить побочные эффекты от него.
Доказано, что ингбирование PD-1 более эффективно, чем CTLA-4, и позволяет добиться лучшего исхода при раке легких, почки, некоторых лимфомах и меланоме. Новые клинические исследования выявили, что комбинированная терапия, направленная как на CTLA-4, так и на PD-1, может быть более эффективной, особенно у пациентов с меланомой. Поэтому Эллисон и Хондзе вдохновили исследователей на комбинирование различных стратегий, направленных на выключение «тормозов», что в итоге приводило бы к уничтожению опухолевых клеток намного более эффективно. Большое количество вариантов такого лечения уже проходят клинические испытания в качестве терапии онкологических заболеваний, а в качестве мишеней такой терапии исследуются все новые виды белков.
В течение более ста лет ученые пытались вовлечь иммунную систему в борьбу против рака. До тех пор, пока сегодняшние лауреаты Нобелевской премии по физиологии и медицине не совершили свои плодотворные открытия, не было значительного прогресса в клиническом применении этих подходов. Но терапия ингибирования контрольных точек произвела революцию в лечении онкологических заболеваний и фундаментально изменила наши взгляды на злокачественные новообразования.
Ритм жизни
Циркадные ритмы — это суточные изменения деятельности организма. Они включают регуляцию сна и бодрствования, выделения гормонов, температуры тела и других параметров, которые изменяются в соответствии с суточным ритмом, поясняет врач-сомнолог Александр Мельников. Он отметил, что исследователи вели разработки в этом направлении несколько десятков лет.
«Прежде всего, нужно отметить, что это открытие не вчерашнего и не сегодняшнего дня. Эти исследования велись многие десятилетия — с 80-х годов прошлого века до настоящего времени — и позволили открыть один из глубинных механизмов, регулирующих природу организма человека и других живых существ. Механизм, которые открыли учёные, очень важен для влияния на суточный ритм организма», — рассказал Мельников.
По словам эксперта, эти процессы происходят не только из-за смены дня и ночи. Даже в условиях полярной ночи суточные ритмы будут продолжать действовать.
«Эти факторы очень важны, но очень часто у людей они нарушены. Эти процессы регулируются на генном уровне, что подтвердили лауреаты премии. В наше время люди очень часто меняют часовые пояса и подвергаются разным стрессам, связанным с резкими изменениями циркадного ритма. Напряжённый ритм современной жизни может влиять на правильность регулировки и возможности для отдыха организма», — заключил Мельников. Он уверен, что исследование Янга, Холла и Росбаша даёт возможность разработать новые механизмы воздействия на ритмы человеческого организма.
Можем ли мы вовлечь нашу иммунную систему в борьбу с раком?
Злокачественные новообразования представляют из себя неоднородную группу заболеваний, но все они характеризуются неконтролируемой пролиферацией атипичных клеток, а также их способностью проникать в здоровые органы и ткани. Существует множество методов терапии онкологических заболеваний, в том числе хирургическое вмешательство, лучевая терапия и другие стратегии лечения, многие из которых были отмечены предыдущими Нобелевскими премиями. В их числе гормональная терапия рака простаты (Хаггинс, 1966 год), химиотерапия (Элион и Хитчинс, 1988), а также трансплантация костного мозга при лейкемии (Томас, 1990). Однако запущенные опухоли все еще тяжело поддаются лечению, и разработка новых терапевтических стратегий является первостепенной задачей.
В конце XIX и начале XX вв. возникла идея, согласно которой активация иммунной системы и последующая атака опухолевых клеток может быть стратегией лечения рака. Предпринимались попытки заражения пациентов бактериями, чтобы активировать защитные системы организма. Результаты были весьма посредственными, но в сильно измененном виде этот подход дошел до наших дней в виде методики лечения рака мочевого пузыря. Тогда исследователям стало ясно, что имеющихся знаний недостаточно. Множество ученых были вовлечены в исследования фундаментальных принципов, лежащих в основе регулирования иммунной системы, и это помогло понять механизмы обнаружения опухолевых клеток иммунной системой. Несмотря на значительный научный прогресс, разработка новых методов лечения рака оставалась сложной задачей.
Теломераза
В 2009 году Кэролу Грейдеру совместно с Элизабет Блэкбёрн и Джеком Шостаком вручили Нобелевскую премию по медицине «за открытие механизмов защиты хромосом теломерами и фермента теломеразы».
Каждая клетка организма постоянно обновляется, у нее есть свой жизненный цикл, когда она рождается, живет, делится и умирает. В более молодом возрасте человека клетки обновляются быстрее, чем старше он становится, тем этот процесс идет медленнее. Процесс обновления клеток называется регенерацией. Есть теория «предела Хейфика»: не все с ней согласны, но мнение, что клетка может делится не более 32 раз – доказательство тому наши морщины. Теломеразу считают ключом к клеточному бессмертию. Этот фермент позволяет клеткам быстро размножаться без старения. Стволовые клетки эмбрионов, например, вырабатывают теломеразу, которая позволяет им непрерывно делиться, формируя ткани и органы. У взрослых ее производство опять же замедленно.
Лаборатория Payot в 2007 году создала запатентованную формулу, которая стимулирует теломеразу, — крем PAYOTAOX. Anti-age курс нужно начинать в 30–35 лет, не позже, так как в этом возрасте еще можно стимулировать процессы регенерации.
От наших чувств к рецепторам
Когда мы идем босиком по росе, то ощущаем одновременно тепло солнца, дыхание ветра, чувствуем текстуру травы, ее температуру и влажность. Когда залезаем в ванную с температурой выше 43 °C, то тут же выскакиваем из воды — горячо! От леденца с ментолом во рту становится холодно, а еда с перцем всегда согревает. Почему так происходит? Каким образом наш организм реагирует на окружающую среду? Это одна из великих загадок, с которой сталкивается человечество, отмечается в пресс-релизе Нобелевского комитета.
Дэвид Джулиус и Ардем Патапутян проводили свои исследования в США независимо друг от друга и ответ искали в области молекулярной биологии. Джулиус из Калифорнийского университета сосредоточился на реакции человеческих клеток на температуру и после продолжительных экспериментов с острым перцем чили (а точнее, веществом капсаицин) отыскал в мембране клеток человека своеобразный «датчик тепла» — рецептор TRPV1, особый чувствительный белок, который похожим образом реагирует на повышенную температуру и жгучий вкус. В опытах было установлено, что мыши-мутанты с дефицитом TRPV1 меньше реагируют на горячее и, кроме того, у них снижена способность воспринимать боль, вызванную воспалениями и онкологическими болезнями.
Дэвид Джулиус посвятил около 20 лет жизни изучению этих рецепторов: исследовал их механизмы, трехмерное устройство, определил 3D-структуру и указал на применение. Сегодня рецептор TRPV1 — один из самых знаменитых в этой области. Он сам и связанные с ним ионные каналы уже сегодня могут служить в медицине: они являются целями для разработки новых обезболивающих препаратов.
Другой нобелевский лауреат — уроженец Ливана армянского происхождения Ардем Патапутян, который много лет работает в Калифорнии в Институте Скриппса, — исследовал рецепторы осязания. Он и его команда провели долгие поиски и отсмотрели большой список генов-кандидатов, ответственных за механическое воздействие, прежде чем смогли идентифицировать единственный ген, чье подавление сделало клетки нечувствительными к прикосновениям. Так был открыт новый и совершенно неизвестный механочувствительный ионный канал, получивший название Piezo1 (от греческого слова, обозначающего давление). Благодаря сходству с Piezo1 был открыт второй ген, названный Piezo2.
Позже выяснилось, что Piezo2 играет также ключевую роль в критически важном восприятии положения и движения тела. Оба открытых канала Piezo регулируют такие важные физиологические процессы, как артериальное давление, дыхание и контроль мочевого пузыря
Впоследствии независимо друг от друга Дэвид Джулиус и Ардем Патапутян использовали ментол для идентификации TRPM8 — рецептора, который, как было доказано, активируется холодом. Проще говоря, они нашли ответ на вопрос, почему мятные конфетки имеют прохладный вкус.
В целом революционные открытия рецепторов TRPV1, TRPM8 и каналов Piezo позволили нам понять, как тепло, холод и механическая сила рождают нервные импульсы, через которые человек имеет возможность воспринимать окружающий мир и адаптироваться к нему. Эти знания станут фундаментом для разработки новых методов лечения широкого спектра заболеваний. В том числе это может помочь людям с редкой мутацией, которые не ощущают боль и не реагируют на температуру.
Победу Дэвида Джулиуса и Ардема Патапутяна можно было предугадать, так как в 2020 году они получили еще одну авторитетную награду — премию Кавли, которую часто называют «преднобелевской премией».
Кверцитин
Кверцетин относится к витаминным препаратам группы₽ Лучше натуральное антигистаминное, противовоспалительное и иммуномодулирующее средство. В 1996 году ученые Ферри и Смит доказали, что кверцитин заставляет клетки, «свернувшие» на путь старения (и даже опухоли), покончить жизнь самоубийством.
Научно-исследовательская лаборатория KORRES 5 лет проводила исследования омолаживающих механизмов на клеточном уровне. Исследование фокусировалось на функционировании протеасомы — важнейшем защитном механизме клеточных протеинов, таких как коллаген и эластин, и его активации для защиты и продления жизни клетки. Достижение — растительный кверцитин, выделенный из коры дуба.
Новый принцип иммунотерапии
В 1990-х Джеймс П. Эллисон в своей лаборатории Калифорнийского университета в Беркли изучал белок Т-клеток CTLA-4. Он оказался одним из многих ученых, чьи наблюдения позволили установить, что CTLA-4 работает в качестве «тормоза» Т-клеток. Другие научные группы использовали этот «тормоз» в качестве мишени при лечении аутоиммунных заболеваний. Но у Эллисона была совершенно иная идея. Он уже разработал антитела, которые могли связываться с CTLA-4 и блокировать его функцию (рис. 1). Теперь он мог попробовать посмотреть, сможет ли блокада CTLA-4 выключить «тормоз» Т-клеток и заставить иммунную систему атаковать раковые клетки. Эллисон и соавторы провели первый эксперимент в конце 1994 года, и, к их восторгу, его удалось успешно повторить уже после Рождества. Больная раком мышь была вылечена с помощью антител, которые ингибировали «тормоз» и открывали возможность для противоопухолевой активности Т-клеток. Несмотря на почти полное равнодушие фармацевтических компаний, Эллисон продолжил свои труды в попытке создать новые методы лечения онкологических заболеваний у человека
Многообещающие результаты вскоре были представлены разными научными группами, а в 2010 году было проведено важное клиническое испытание, в котором была продемонстрирована чрезвычайно высокая эффективность лечения у пациентов с меланомой. У некоторых пациентов полностью исчезли клинические признаки меланомы
Такие выдающиеся результаты никогда ранее не были выявлены у таких пациентов.
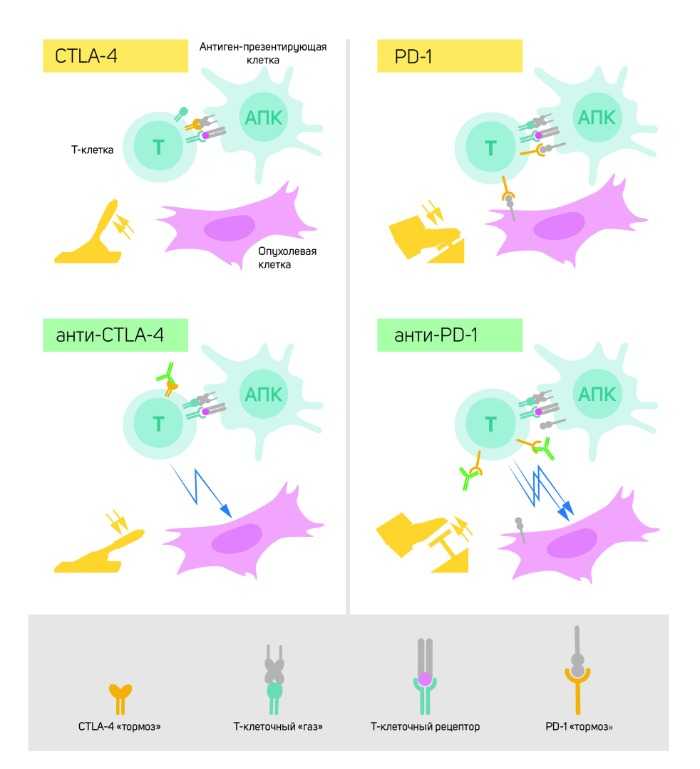
Рисунок
Вверху слева: для активации Т-клеток требуется, чтобы Т-клеточный рецептор связывался со структурами на других иммунных клетках, чтобы распознать объект как «не свой». Белок, функционирующий в качестве «акселератора» Т-клеток, также необходим для активации Т-клеток. CTLA-4 служит «тормозом» Т-клеток и ингибирует функции «акселератора».
Внизу слева: антитела (зеленые) против CTLA-4 блокируют функцию «тормоза», что приводит к активации Т-клеток и вынуждает их нападать на опухолевые клетки.
Вверху справа: PD-1 является еще одним «тормозом» Т-клеток, который ингибирует их активацию.
Внизу справа: антитела против PD-1 ингибируют функцию «тормоза», что позволяет Т-клеткам с высокой эффективностью уничтожать опухолевые клетки.
Стволовые клетки
В области медицины ее получили два ученых — британский специалист по клеточной биологии Джон Гердон, японец СиньяЯманака. За превращение взрослой клетки в юную для возможности выращивания сложных человеческих органов и тканей — например нервной, сосудистой ткани, глазных нервов, сетчатки. Интересно, что основу этой научной области заложили русские ученые. Русский ученый гистолог Александр Максимов в 1908 году впервые выделил стволовые клетки костного мозга.
Одна из основных современных теорий старения – это замедление синтеза стволовых клеток, из которых, в общем-то, и рождаются в итоге все новые клетки тканей и сосудов.
Косметика и препараты, стимулирующие работу стволовых клеток, — это будущее эстетической медицины и косметологии, тк с их помощью можно по сути достичь любого нужного результата – лучше, моложе или… больше объема?
Фон
Нобель интересовался экспериментальной физиологией и создал собственные лаборатории.
Альфред Нобель родился 21 октября 1833 года в Стокгольме , Швеция, в семье инженеров. Он был химиком, инженером и изобретателем, сколотившим состояние при жизни, большую часть которого он получил благодаря 355 изобретениям, самым известным из которых является динамит . Он интересовался экспериментальной физиологией и создал собственные лаборатории во Франции и Италии для проведения экспериментов по переливанию крови. Будучи в курсе научных открытий, он был щедр на пожертвования лаборатории Ивана Павлова в России и с оптимизмом смотрел на прогресс, достигнутый в результате научных открытий, сделанных в лабораториях.
В 1888 году Нобель с удивлением прочитал во французской газете собственный некролог под названием «Торговец смертью мертв». Так случилось, что умер брат Нобеля Людвиг , но Нобель, недовольный содержанием некролога и обеспокоенный тем, что его наследие плохо отразится на нем, был вдохновлен изменить свое завещание. В своем последнем завещании Нобель просил, чтобы его деньги были использованы для создания серии премий для тех, кто приносит «наибольшую пользу человечеству» в физике , химии , мире , физиологии или медицине и литературе . Хотя Нобель написал несколько завещаний при жизни, последнее было написано чуть более чем за год до его смерти в возрасте 63 лет. Поскольку его завещание оспаривалось, оно не было одобрено стортингом (парламентом Норвегии) до 26 апреля 1897 года.
После смерти Нобеля был создан Нобелевский фонд для управления завещанными активами. В 1900 году новый устав Нобелевского фонда был обнародован шведским королем Оскаром II . Согласно завещанию Нобеля, Каролинский институт в Швеции, медицинская школа и исследовательский центр, отвечает за премию в области физиологии и медицины. Сегодня эту премию обычно называют Нобелевской премией по медицине.
Аквапорины
Открытие Питером Эгером аквапоринов – специальных белков в мембранах клеток – было удостоено Нобелевской премии по химии в 2003 году. Специфические белки, формирующие поры в мембранах клеток. По сути, аквапорины – это «водные ворота», через которые вода попадает внутрь клетки и удерживается там. Каждая клеточная мембрана может содержать несколько сотен таких «ворот», через которые ежесекундно в клетку проникает до 3 миллиардов молекул воды. Именно аквапорины отвечают за способность кожи постоянно поддерживать свой внутренний водный баланс.Аквапорины были открыты относительно недавно – в 2003 году. На сегодняшний день описано уже более 200 видов. Аквапорины-3 – «самые красивые»: они присутствуют в клетках эпидермиса и предназначены специально для увлажнения кожи. С возрастом, а также под воздействием ультрафиолета количество аквапоринов в клетках кожи постепенно сокращается. Объем поступающей в клетки воды неизбежно снижается, и происходит обезвоживание кожи. Визуально это выражается в том, что кожа утрачивает свежесть и сияние, становится тусклой, приобретает серо-землистый цвет, на ней появляются морщинки и пигментация.
Открытие PD-1 и почему это важно для лечения рака
В 1992 году, за несколько лет до открытия Эллисона, Тасуку Хондзе обнаружил PD-1, другой белок, экспрессирующийся на поверхности Т-клеток. Преисполненный решимости разгадать его роль, он тщательно изучил его функцию в серии нескольких изящно поставленных экспериментов, которые он провел в своей лаборатории в университете Киото. Результаты этих экспериментов показали, что PD-1 близок по своим функциями «тормоза» к CTLA-4, но механизмы его работы несколько отличаются (Рис. 1). В опытах на животных, которые провел Хондзе и другие научные группы, блокада PD-1 также показала многообещающие перспективы для создания противоопухолевой терапии. Это открыло дорогу в клиники для PD-1 как терапевтической мишени
Вскоре начались клинические разработки и, наконец, в 2012 году было проведено важное клиническое исследование, которое явно продемонстрировало эффективность этого подхода в лечении пациентов с различными видами рака. Результаты были просто поразительными: наблюдались долгосрочная ремиссия и, возможно, полное излечение нескольких пациентов с метастазами, состояние которых было столь тяжелым, что их считали неизлечимо больными
Сбылись ли пророчества?
Имена лауреатов Нобелевской премии по физиологии и медицине стали известны сегодня во время прямой трансляции на канале «Наука». Собеседник Алексея Семихатова — кандидат физико-математических наук, старший научный сотрудник Института биоорганической химии РАН, сооснователь и главный редактор проекта «Биомолекула» Антон Чугунов — прокомментировал это событие в режиме реального времени.
«Мне очень приятно услышать эти результаты, — сказал эксперт, — потому что я знаком с этими рецепторами, работаю с ними, изучаю. Интересно, что Clarivate Analytics (компания, которая ежегодно пытается предсказывать результаты Нобелевской премии, составляя список самых цитируемых ученых. — Прим. ред.) хотя и не угадала в очередной раз, но все-таки первый кандидат тоже был рецепторный
Стало быть, вопрос рецепторов привлекает довольно большое внимание»
Чугунов отметил, что и другой эксперт, мнение которого мы публиковали недавно в обзоре «Кто получит Нобелевскую премию — 2021?», тоже почти угадал — правда, он говорил о практическом применении открытых рецепторов. «В материале сайта канала «Наука» я увидел, что научный журналист Алексей Паевский высказал одно из предположений о том, что Нобелевскую премию должны дать за оптогенетику. И как раз с рецептором ТRP, который открыл Джулиус, связана другая область, которую разрабатывают в нашем институте, — она называется «термогенетика». Ее разрабатывает Всеволод Белоусов (я уверен, что ему сегодня много раз позвонят), он работает с этим самым рецептором ТRP: встраивает его в те нейроны, в которых его нет. Зачем? Чтобы можно было их активировать температурой, в том числе с медицинскими целями.
Есть способы нагревать очень прицельно отдельные участки внутри тела — микроволнами, или ультразвуком, или еще чем-нибудь. И тогда можно заставить работать некоторые нейронные контуры, которые функционируют не так, как нужно. В перспективе это поможет в лечении разных неврологических заболеваний, до которых сейчас не добраться. Потому что, чтобы до них добраться, надо что-то сделать с нейронами, которые у нас спрятаны где-то в мозгах или глубоко внутри тела. При помощи генетических технологий можно эти рецепторы доставить в эти нейроны, а при помощи физических технологий заставить их работать так и тогда, как нам нужно, и разработать новый протокол лечения. Так что фундаментальные изучения рецепторов обязательно находят или найдут в будущем практические применения».
Чугунов отметил, что изучение рецепторов, представляющих собой в большинстве случаев мембранный белок, стало возможным только в новейшее время — в связи с развитием технологий. «Мы существа многоклеточные, у нас 100 трлн клеток (грубо говоря), и в каждой клетке есть обязательно мембрана, то есть это то, куда она заключена, — объяснил эксперт. — В этой мембране находятся рецепторы, которые отвечают за все межклеточные коммуникации. В том числе за все чувства, которые у нас есть. Размеры белка очень маленькие — это 5–10 нанометров, его невозможно увидеть глазом и даже в микроскоп. В микроскоп мы можем увидеть 200 нанометров в лучшем случае, а молекула — в 10–20 раз меньше.
Поэтому, чтобы его изучать, потребовались очень сложные современные технологии, которые появились только в последние несколько десятков лет: это и рентгеноструктурный анализ, и ядерный магнитный резонанс, и криоэлектронная микроскопия… Все эти методики позволили изучить эти рецепторы, и благодаря им в том числе были сделаны эти достижения, которые сегодня отметил Нобелевский комитет. Также понадобилось компьютерное моделирование — пусть оно не изучает молекулы напрямую, но зато позволяет моделировать то, что не будет доступно экспериментальным методом, скорее всего, никогда».
Напоминаем, что завтра состоится объявление лауреатов по физике. Смотрите прямую трансляцию на канале «Наука» в 12:25!
Тормоз и газ иммунной системы
Фундаментальным свойством нашей иммунной системы является наличие системы, которая отличает «своих» от «чужих», что позволяет уничтожать вторгающиеся бактерии, вирусы или иные опасности. Т-клетки — это тип лейкоцитов, являющихся ключевыми участниками в этой защите. У Т-клеток были обнаружены рецепторы, которые связываются с определенными структурами, опознанными как чужеродные, а затем через различные взаимодействия происходит активация иммунной системы, чтобы «поднять тревогу». Но для запуска полноценного иммунного ответа этого мало, нужны также дополнительные белки, которые служат «акселераторами» для Т-клеток (рис. 1)
Множество ученых, участвующих в этом важном фундаментальном исследовании, определили другие белки, которые работают в качестве «тормоза» Т-клеток, ингибируя иммунный ответ. Этот сложный баланс между «акселератором-газом» и «тормозом» иммунной системы необходим для точного контроля иммунного ответа
Это позволяет иммунной системе успешно уничтожать чужеродные микроорганизмы и в тоже время избегать чрезмерной активации, которая привела бы к аутоиммунному поражению здоровых тканей и органов.