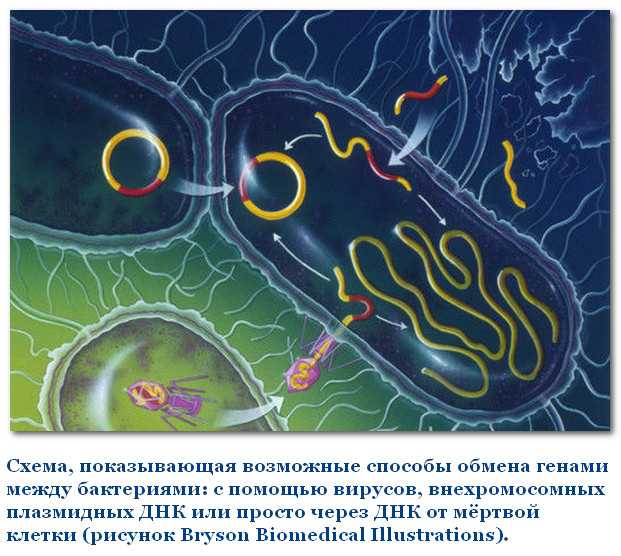
Какие бактерии
Бактерии — это прокариоты, у которых отсутствуют мембраносвязанные органеллы. Они имеют пептидогликановую клеточную стенку. Бесполое размножение бинарным делением является основным методом размножения у бактерий. Бактерии могут содержать два типа генетического материала внутри бактерии, и это бактериальный геном и плазмиды. Геном представляет собой двухцепочечную кольцевую хромосомную ДНК, а плазмиды представляют собой двухцепочечные, маленькие кольцевые молекулы ДНК. Бактериальная хромосомная ДНК находится в нуклеоиде. Размер Кишечная палочка геном составляет 4,6 миллиона пар оснований и состоит из приблизительно 4300 генов. Плазмиды или нехромосомная бактериальная ДНК меньше, чем бактериальная хромосома, и на бактериальную клетку можно найти от нескольких до более чем тысяч плазмид. Бактерии в культуре показаны в Рисунок 1.
Рисунок 1: Бактерии
Как викинги червей победили
Примерно так же развилась наследственная предрасположенность к эмфиземе легких — заболеванию, при котором альвеолы теряют эластичность, газообмен ухудшается и начинается дыхательная недостаточность. Диагноз распространен среди скандинавов и практически не встречается у выходцев из Азии.
Объяснение простое: мутация, повышающая риск развития этой болезни, впервые появилась у викингов как побочный эффект защиты организма от гельминтов. К такому выводу пришли британские исследователи, изучившие палеогенетические данные и ДНК современных людей.
Археологические раскопки древних скандинавских поселений показывают: викинги часто страдали от паразитов, в том числе шистосом — плоских червей, которые обитают в венозной крови и повреждают внутренние органы. Заражение, как правило, происходит через воду — когда человек купается или пьет.
Вероятно, выходом для древних скандинавов стала мутация гена альфа-1-антитрипсина, которая со временем все чаще встречалась в их популяции. Этот белок защищает ткани от повреждения собственным ферментом — трипсином.
Эта мутация сопутствует варианту гена иммуноглобулина Е, который кодирует его изоформу IgE-tp. Соединяясь с мутантным антитрипсином, она не разрушается под действием ферментов, вырабатываемых паразитическими червями. А вот обычная молекула иммуноглобулина E не может им противостоять.
В лабораторных условиях исследователи заражали клетки крови шистосомами. Среди них были биологические образцы пациентов с диагностированной эмфиземой легких и здоровых людей. Как и ожидалось, первые успешнее противостояли паразитам.
Какое отношение эти различные организмы имеют друг к другу и эволюции?
Совсем немного, считает биолог-эволюционист Оксфордского университета (Oxford University) и автор нового исследования Николас Ирвин (Nicholas Irwin).
Вирусы и эукариоты зависят друг от друга. Первые используют свои гены, полученные от хозяина, для репликации и клеточного контроля, зачастую кодируя информационные и операционные гены клеточного происхождения, позволяя вирусам адаптироваться и выживать. Эукариоты могут включать вирусную ДНК в свои геномы. Эта новая ДНК, ранее считавшаяся неактивной, теперь, как было обнаружено, обеспечивает новую функциональность их хозяевам-эукариотам.
Соавторы исследования из Университета Британской Колумбии (University of British Columbia) в Ванкувере, Канада, и Оксфордского университета (University of Oxford), Соединенное Королевство, сотрудничали с доктором Ирвином, чтобы раскрыть новаторские открытия в области перемещения генов между вирусами и эукариотами, называемые горизонтальным переносом генов.
Как бактерии обмениваются генетической информацией
Генетическая информация может передаваться от одной бактерии к другой в форме ДНК. Передача генетической информации между бактериями не всегда считается истинным обменом, поскольку одна бактерия служит донором, а другая — только получателем. Более того, переносятся только небольшие кусочки бактериальных хромосом.
Для обмена генетической информацией между бактериями используются три способа: конъюгация, трансформация и трансдукция.
конъюгация
Процесс, который обменивается генетической информацией между двумя бактериями посредством прямого межклеточного контакта, называется конъюгацией. Он опосредуется конъюгативными плазмидами, которые кодируются эффективными механизмами передачи ДНК. Конъюгация является однонаправленным процессом, и только донорская бактерия имеет конъюгирующие плазмиды. Конъюгативные плазмиды грамотрицательных бактерий кодируются для полового пилуса, который облегчает передачу ДНК бактерии-реципиенту. Прямой контакт между двумя бактериями достигается через половой пилус, образуя супружеский мост. Этапы бактериальной конъюгации показаны на фигура 2.
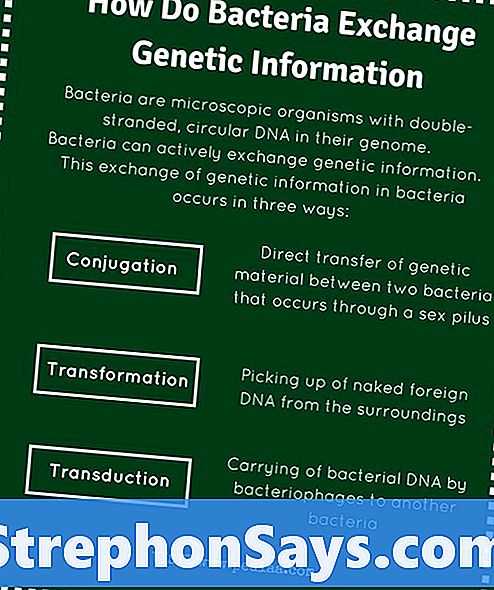
Рисунок 2: Спряжение
1- Донорская клетка производит пилус. 2- Pilus прикрепляется к ячейке получателя, объединяет две ячейки. 3. Подвижная плазмида разрезается, и одна нить ДНК затем переносится в клетку реципиента. 4. Обе клетки рециркулируют свои плазмиды, синтезируют вторые цепи и воспроизводят пили; обе клетки в настоящее время являются жизнеспособными донорами.
преобразование
Процесс изъятия бактериями свободных фрагментов ДНК из окружающей среды называется трансформацией. Только компетентные бактериальные клетки могут поглощать ДНК путем трансформации. Ограниченные типы бактерий могут подвергаться трансформации естественным образом, такой как бацилла, стрептококк, Neisseria, Haemophilusи т. д. Кроме того, большинство бактерий, таких как Кишечная палочка может быть сделан компетентным искусственно путем воздействия на среду с хлоридом кальция. Плазмиды используются в качестве носителей ДНК при трансформации во время экспериментов по клонированию ДНК.
трансдукция
Процесс переноса бактериальной ДНК из одной клетки в другую посредством заражения бактериями вирусов известен как трансдукция. Он считается эффективным методом переноса ДНК, поскольку чужеродная ДНК защищена внутри бактериофага. ДНК, переносимая бактериофагами, постоянно интегрируется в бактериальный геном реципиента путем гомологичной рекомбинации.
Заключение
Обмен генетическим материалом между ДНК происходит тремя способами; сопряжение, преобразование и преобразование. Конъюгация — это прямая передача генетического материала между двумя бактериями с помощью полового пилуса. Трансформация — это поглощение обнаженных фрагментов ДНК бактериями из окружающей среды. Трансфекция — это передача бактериальной ДНК через заражающие бактерии вирусы.
Ссылка:
1. Роджерс, Кара и Роберт Дж. Каднер. «Бактерии».Энциклопедия Британника, Encyclopædia Britannica, Inc., 22 февраля 2018 г.,
Исследования бледной трепонемы методами протеомики и функциональной геномики
 Исследования особенностей бледной трепонемы в течение долгого времени были затруднены из-за невозможности длительного культивирования патогенных штаммов T. pallidum на искусственных средах. Это же служило препятствием для изучения иммунологических и физико-химических свойств большинства белков, входящих в структуру T. pallidum.
Исследования особенностей бледной трепонемы в течение долгого времени были затруднены из-за невозможности длительного культивирования патогенных штаммов T. pallidum на искусственных средах. Это же служило препятствием для изучения иммунологических и физико-химических свойств большинства белков, входящих в структуру T. pallidum.
После расшифровки генома возбудителя сифилиса, осуществленного группой американских исследователей в 1998 году, произошел качественный скачок в области изучения бледной трепонемы, как и многих других микроорганизмов, геномы которых были расшифрованы в начале 90-х годов. Если раньше изучением структуры, функций и механизмов работы отдельных наборов генов занималась классическая генетика, то возникшая как область знаний геномика стала изучать огромные объемы данных о последовательностях нуклеотидов, полученные в результате исследований ДНК.
Хотя наличие данных по геному — это настоящая сокровищница информации для исследователей, однако геномные последовательности дают только «взгляд с высоты птичьего полёта» на биологические процессы, свойственные микроорганизмам. Рекордное обилие сведений по ДНК, которое нарабатывается методами современной геномики становится основанием для глобальной экспериментальной платформы — протеомики. Современные глобальные методы протеомики сочетают компьютерные и биологические подходы.
Протеомика — современное направление молекулярной биологии, занимающееся сравнительным изучением белков, которые могут быть экспрессированы микроорганизмом в определенную фазу жизнедеятельности, предсказанием функциональной роли отдельных белков путем экспериментального сопоставления их качественного и количественного составов в разных клетках, а также установлением взаимосвязи структуры белка и его функций.
Благодаря развитию методов протеомики стало возможным широкомасштабное изучение белкового состава различных организмов, в том числе и возбудителя сифилиса.
Состав белков T. pallidum в настоящее время изучается методами протеомики и функциональной геномики, что значительно расширило знания об антигенной структуре микроорганизма. С использованием протеомных методов исследования было выявлено и охарактеризовано более сотни новых иммуногенных белков T. pallidum. В частности, появилась серия работ по изучению протеома возбудителя сифилиса с целью выявления новых белков, представляющих интерес для создания вакцины или диагностикумов на их основе.
Недостаток этого подхода в том, что вычислительные программы могут предсказать белковый состав трепонем, но не позволяют определить расположение белка в клетке.
Основополагающими исследованиями в этой области стали работы М. Brinkman и соавт. (2006), которые провели серологический скрининге библиотеки рекомбинантных белков T. pallidum. Серологический скрининг нативных белков, разделенных методом двумерного электрофореза, был представлен в работе М. McGill и соавт. (2010).
Лихорадка от чумы
Среди населения Средиземноморья, выжившего после чумных эпидемий в Средние века, были носители редкой тогда мутации в гене, отвечающем за выработку пирина — белка, вызывающего выделение провоспалительных цитокинов. В организме образовывался дефектный белок, который не давал чумной палочке Yersinia pestis подавить воспалительный ответ иммунитета. Неудивительно, что мутация закрепилась и распространилась в регионе: сегодня там каждый десятый — носитель мутантного варианта гена.
Обратной стороной приобретенной противочумной защиты стала средиземноморская лихорадка — наследственная аутоиммунная болезнь, симптомы которой — высокая температура и острые боли, как при воспалении кишечника.
По данным международной команды ученых, изучивших геномы более двух тысяч жителей современной Турции, мутации могли возникнуть около двух-трех тысяч лет назад. Однако отбор по ним начал действовать позже — во время первой (541—767 годы) и второй (1346—1875 годы) пандемий чумы. Причем вторая сильнее повлияла на закрепление мутаций.
Строение бледной трепонемы
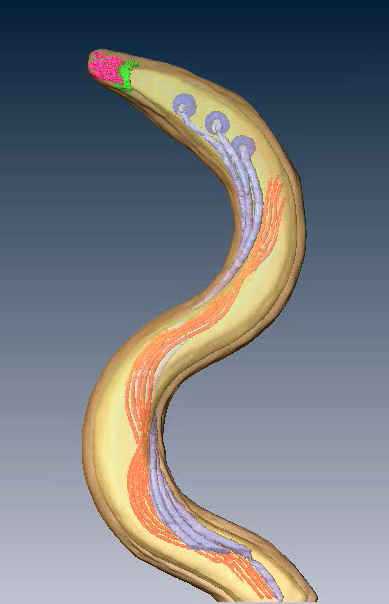 Трехмерная рендер-модель бактерии T. pallidum. Изображены внешняя и цитоплазматическая мембрана (прозрачный желтый), базальные тела (темно-лиловый), аксиальные фибриллы (светло-лиловый), цитоплазматические нити (оранжевый), серповидная «шапочка» возле закругленного конца цитоплазматической мембраны (зеленый), и коническая структура на полюсе (розовый). Пептидогликановый слой не отображен на рендер-модели.
Трехмерная рендер-модель бактерии T. pallidum. Изображены внешняя и цитоплазматическая мембрана (прозрачный желтый), базальные тела (темно-лиловый), аксиальные фибриллы (светло-лиловый), цитоплазматические нити (оранжевый), серповидная «шапочка» возле закругленного конца цитоплазматической мембраны (зеленый), и коническая структура на полюсе (розовый). Пептидогликановый слой не отображен на рендер-модели.
Строение бледной трепонемы (T. pallidum подв. pallidum) было изучено более подробно и изучается в настоящий момент параллельно с развитием иммунологии и электронной микроскопии, начиная с 70-80 годов XX века.
Строение T. pallidum во многом похоже на строение других спирохет.
Проведенные с помощью электронной микроскопии исследования морфологии бледной трепонемы показали, что центральной структурой клетки Т. pallidum является спирально извитой протоплазматический цилиндр.
Протоплазматический цилиндр снаружи окружен цитоплазматической мембраной и плотно прилегающей к нему тонкой клеточной стенкой, основу которой составляет пептидогликан.
Кроме этого, бледная трепонема имеет осевые фибриллы, которые плотно обвиваются вокруг протоплазматического цилиндра. Полагают, что именно они обеспечивают подвижность трепонем, хотя полная функциональность фибрилл не описана в достаточной степени.
Пептидогликан, также известный как муреин, является сложным полимером. Он поддерживает структурную целостность цитоплазматической мембраны и стабилизирует фибриллярный двигательный комплекс. Этот полимер достаточно эластичный, чтобы не мешать сгибательным движениям трепонем.
Бактерия имеет наружную (внешнюю) мембрану. Наружная мембрана охватывает протоплазматический цилиндр и фибриллы.
Аксиальные (осевые) фибриллы располагаются в периплазматическом пространстве, между клеточной стенкой и наружной мембраной. Эти нитчатые структуры тянутся вдоль клетки трепонемы, обвиваясь вокруг её тела в периплазматическом пространстве. Они берут начало от базальных тел, расположенных на обоих концах клетки, и заканчиваются, пройдя середину клеточного цилиндра. Они идут от обоих концов к центру микроорганизма и перекрывают друг друга в центре.
Каждая фибрилла одним концом прикреплена вблизи конца клетки, а другой ее конец свободен. На обоих концах клетки прикреплено одинаковое число фибрилл; в середине или по всей длине клетки фибриллы перекрывают друг друга. В совокупности аксиальные фибриллы называются аксостилем (фибриллярным пучком).
По своим свойствам аксиальные фибриллы напоминают жгутики бактерий. Отличие заключается в том, что аксиальные фибриллы трепонем — внутриклеточные структуры и поэтому называются эндофлагеллами, т.е. внутренними жгутиками.
Т.к. пептидогликановый слой не защищает наружную мембрану, то она легко разрушается при экспериментальных манипуляциях. Фибриллы тоже при этом повреждаются и отстают от тела бактерии, что хорошо видно на многих снимках, полученных в результате электронной микроскопии.
Кроме того, внутри протоплазматического цилиндра также содержатся другие нитевидные структуры, функция которых до сих пор не ясна — цитоплазматические фибриллы, направленные параллельно периплазматическим эндофлагеллам (аксиальным фибриллам).
На концах трепонем наблюдаются структуры конической формы, расположенные в периплазматическом пространстве. По всей видимости, эти уникальные структуры состоят из липопротеинов, упорядоченных в виде спиральной решетки, примыкающей к наружной мембране.
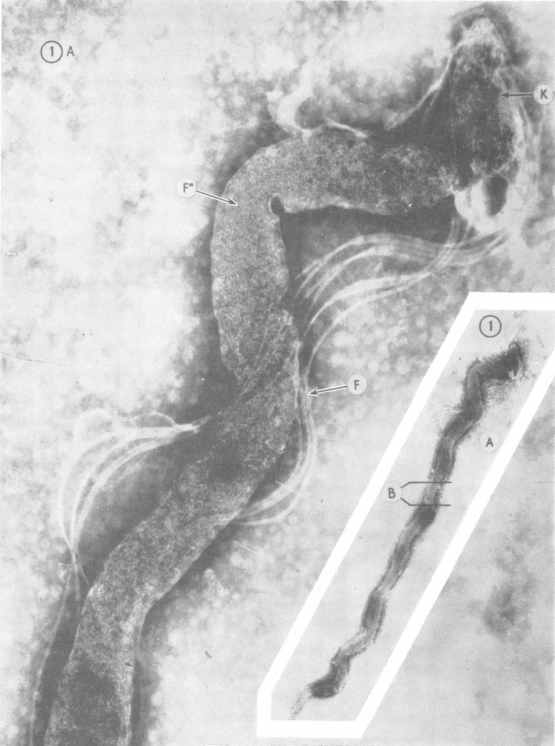 Трепонема, штамм Казань. Электронная микроскопия. K — головная структура. F — фибриллы. F» — цитоплазматические нити.
Трепонема, штамм Казань. Электронная микроскопия. K — головная структура. F — фибриллы. F» — цитоплазматические нити.
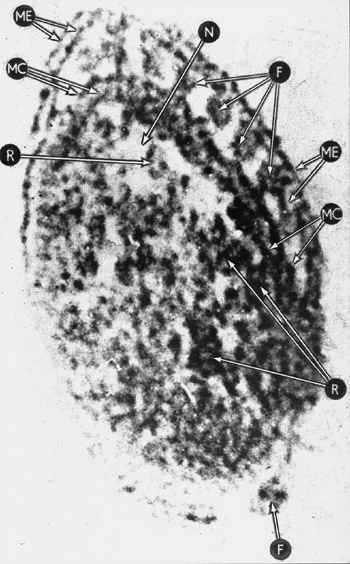 Срез бледной трепонемы (электронная микроскопия). (ME) — наружная мембрана. (MC) — цитоплазматическая мембрана. (F) — фибриллы. (R) — рибосомы. (N) — вакуоли.
Срез бледной трепонемы (электронная микроскопия). (ME) — наружная мембрана. (MC) — цитоплазматическая мембрана. (F) — фибриллы. (R) — рибосомы. (N) — вакуоли.
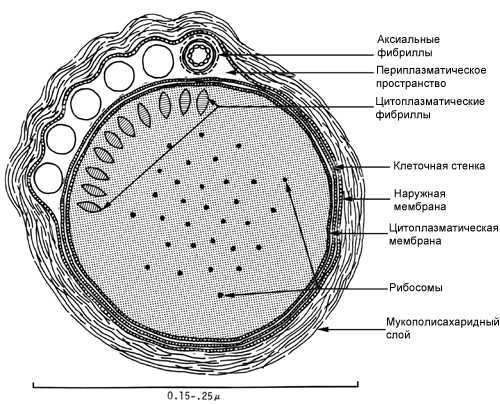 Схема среза бледной трепонемы
Схема среза бледной трепонемы
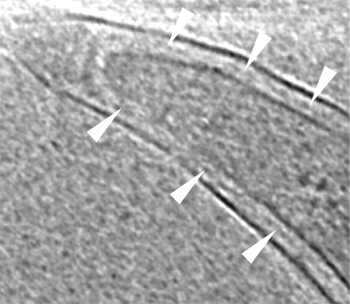 Срез концевого сегмента бледной трепонемы на крио-электронной томограмме. Белые треугольники указывают на пептидогликановый слой клеточной стенки, который хорошо видно рядом с концом клетки.
Срез концевого сегмента бледной трепонемы на крио-электронной томограмме. Белые треугольники указывают на пептидогликановый слой клеточной стенки, который хорошо видно рядом с концом клетки.
Большинство (50—80%) свежеизолированных штаммов T. pallidum окружены слоем кислых мукополисахаридов, напоминающим капсулу. Однако не все уверены, что это собственный продукт трепонем, а не производное соединительной ткани хозяина. Если это так, то правильнее говорить о псевдокапсуле.
Геном бледной трепонемы
Так как бледная трепонема весьма важна с медицинской точки зрения, и не поддается культивированию на искусственных средах, то она стала одним из первых микроорганизмов, чей геном расшифровали исследователи. Для секвенирования был выбран штамм Nichols, выделенный в США еще в 1912 году. Геном микроорганизма представлен кольцевой двуцепочечной молекулой ДНК размером 1 138 006 пар оснований. ДНК содержит 1041 предсказанную кодирующую последовательность. Впоследствии были полностью секвенированы еще несколько штаммов T. pallidum. Ученые выяснили, что геномы штаммов отличаются, хотя и не очень значительно.
У микроорганизма идентифицировано 42 семейства генов, ответственных за основные жизнеобеспечивающие функции: механизмы репликации ДНК, транскрипции, трансляции, энергетический метаболизм, процессы клеточного деления и секреции белков.
Наличие небольшого генома с лимитированием процессов биосинтеза объясняет некоторые свойства этой бактерии. Помимо своего небольшого размера, геном бледной трепонемы имеет еще и другие своеобразные черты в виде повторяющихся генов или генов с внутренними повторами.
После расшифровки генома трепонем было выяснено, что 55% генома бледной трепонемы — это гены с предсказанной биологической ролью, 28% — ранее неизвестные гены и 17% генов не уникальны для T. pallidum, т.е. соответствуют белкам других видов бактерий.
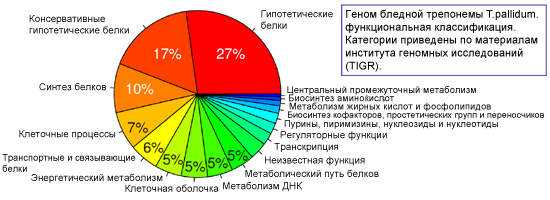
Важную роль в жизнедеятельности возбудителя сифилиса играет транспорт необходимых питательных веществ из окружающей среды. Этим объясняется присутствие широкого спектра транспортных белков с большим выбором субстратных специфичностей, кодируемых 5,7 % генома. Транспортные белки — это переносчики, связывающиеся с соответствующими субстратами внешней среды и транспортирующие их от наружной мембраны к цитоплазматической.
Как высокоспециализированный патоген, Т. pallidum не имеет в своем геноме генов, отвечающих за синтез ферментов, расщепляющих жирные кислоты, она использует сахара, содержащиеся в жидких средах организма хозяина. В качестве источников энергии микроорганизм использует глюкозу, галактозу, мальтозу и глицерин. Пути использования аминокислот как источника углерода и энергии в настоящее время не известны. Предполагают, что Т. pallidum не способна использовать аминокислоты как альтернативный источник энергии.
Одной из важнейших функций Treponema pallidum является движение, что обусловливает ее высокую инвазивность и возможность распространяться по жидкостям организма: внутрисуставной, глазной, экстрацеллюлярном матриксе и в коже. Двигательная активность обеспечивается 36 генами, кодирующими белки жгутиковых структур.
От кого родился, тем и заразился
Нидерландские ученые выяснили: мутации, которые защитили древних людей от смертельных инфекций, подарили современному человечеству целую россыпь аутоиммунных заболеваний. Причем набор зависит от того, где обитали наши предки и куда мигрировали в последние несколько тысяч лет.
Так, люди африканского и европейского происхождения имеют иммунитет к патогенам, с которыми контактировали доисторические жители Африки и Евразии. После каждой эпидемии, разразившейся в конкретном регионе, выжившие становились менее восприимчивыми к определенной инфекции — развивалась устойчивая мутация ДНК. Она передавалась потомкам и позже могла спровоцировать новые аутоиммунные заболевания — болезнь Крона, волчанку или воспаление кишечника.
Правда, в прошлом эти болезни практически не замечали — люди жили значительно меньше и реже достигали возраста, когда проявляются многие аутоиммунные нарушения. Поэтому, как отмечают авторы работы, польза от приобретенных мутаций перевешивала, они становились агентами естественного отбора. Теперь же продолжительность жизни увеличилась, а человечество столкнулось с серьезными последствиями инфекций, перенесенных предками.
В частности, сегодня многие африканцы зрелого возраста подвержены сердечно-сосудистым заболеваниям. По мнению исследователей, это плата за защиту от малярии. Комар Plasmodium sp. заражал африканское население миллионы лет, и в результате эволюционного отбора сформировалась популяция, устойчивая к малярийным плазмодиям. Но постоянное воспаление, связанное с противостоянием этим микроорганизмам, приводит к развитию атеросклероза — а он, в свою очередь, провоцирует инфаркт или инсульт.
Похожим образом люди, в чьей ДНК присутствуют неандертальские гены, защищены от ВИЧ первого типа и стафилококковых инфекций, но чаще других склонны к развитию аллергий, астмы и сенной лихорадки.
Люди, жившие в разных частях Земли, формировали иммунный ответ к различающимся наборам патогенов. В результате среди их потомков чаще встречаются носители мутаций, которые защищают от инфекционных болезней, характерных для определенного региона. Однако именно эти мутации в преклонном возрасте могут спровоцировать развитие аутоиммунных заболеваний
Особенности эукариот
При классификации всех живых организмов ученые используют таксономию — систему наименований — для объединения сходных организмов. Самые крупные группировки называются доменами. Например, люди, все животные, растения, грибы и многоклеточные организмы являются доменами, называемыми эукариотами. У всех эукариотических клеток есть одна важная общая черта: они размещают свою ДНК в ядре. Ядро клетки расположено в центре и связано с мембраной. Прокариоты включают бактерии и археи, одноклеточные организмы, ДНК которых неплотно упакована и окружена клеточной мембраной.
Вирусы еще проще. Они состоят только из ДНК или РНК и имеют только одну защитную белковую оболочку, называемую капсидом, окружающую их.
Вирусный дарвинизм?
Ученые пришли к выводу, что и вирусы, и эукариоты «захватывают» ДНК друг друга, и обнаружили, что эукариотические гены передаются вирусам примерно в два раза чаще, чем вирусные гены, передаваемые эукариотам. Доктор Ирвин объяснил, что может быть несколько причин, по которым вирусы были главными победителями в конкурсе генов. Доктор отметил, что гены могут часто передаваться от вируса к эукариоте, но они могут не сохраняться из-за естественного отбора. Но вирусы могут сохранять те гены, которые они приобретают у своих хозяев, поскольку они полезны для вируса. И для того, чтобы ген сохранялся, организм должен выживать и размножаться — черта, в которой вирусы очень искусны.
Затем исследователи применили все свои знания о генетике этих многочисленных эукариот и вирусов и сравнили их с хорошо зарекомендовавшим себя эволюционным древом. Таким образом, они могли бы приблизить время событий переноса генов относительно того, когда виды расходились или видоизменялись, что относится к превращению в новый тип видов.
Доктор Ирвин описал три отдельных случая в эволюции, в которых присутствуют вирусные гены и иллюстрируют эволюцию под влиянием вирусов: Гены животных участвуют в производстве гиалуроновой кислоты, важного компонента тканей животных. Паразиты трипаносомы, возбудитель сонной болезни и болезни Шагаса, обладают множеством вирусных генов в своих митохондриях
Паразиты трипаносомы, возбудитель сонной болезни и болезни Шагаса, обладают множеством вирусных генов в своих митохондриях.
Вирусные гены присутствуют и функционируют в процессе развития плаценты, что указывает на то, что эти гены, возможно, способствовали эволюции плацентарных млекопитающих.
Возбудитель сифилиса — бледная трепонема
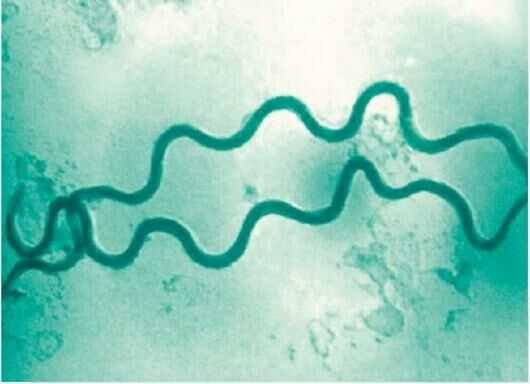 Возбудителем сифилиса является бактерия спиралевидной формы (т.наз. спирохета) — бледная трепонема . Латинское название — Treponema pallidum подвид pallidum.
Возбудителем сифилиса является бактерия спиралевидной формы (т.наз. спирохета) — бледная трепонема . Латинское название — Treponema pallidum подвид pallidum.
Она была открыта в 1905 году Шаудином и Хоффманом (F. Schaudinn и Е. Hoffman) и получила свое название из-за слабой способности воспринимать окраску лабораторными красителями. В активном патогенном состоянии она имеет диаметр 0,2-0,4 мкм и длину от 6 до 14 мкм. В организме человека размножается поперечным делением через каждые 30-33 часа.
Существуют и другие патогенные трепонемы:
Treponema pallidum подвид pertenue — возбудитель фрамбезии,
Treponema pallidum подвид endemicum — возбудитель беджеля,
Treponema carateum — возбудитель пинты
Указанные возбудители и вызываемые ими болезни (трепонематозы) встречаются в регионах с жарким и влажным климатом. Это страны Африки, Азии, Латинской Америки и Тихоокеанского региона, расположенные в зонах тропических лесов.
Бледная трепонема является облигатным паразитом — микроорганизмом, живущим исключительно за счет организма хозяина и неспособным выживать и размножаться вне его.
Традиционно считалось, что, эта бактерия является строгим анаэробом, то есть может существовать только при отсутствии в среде обитания молекулярного кислорода (т.е. в анаэробных условиях). Но к настоящему времени выяснилось, что бледная трепонема относится к микроаэрофилам и растет в условиях пониженных концентраций кислорода (по сравнению с содержанием кислорода в обычном воздухе).
Несмотря на активные попытки исследователей вырастить эти бактерии вне живых организмов («in vitro»), трепонема не культивируется на простых питательных средах. Те культуральные трепонемы, которые удается вырастить комплексными методами на питательных средах, утрачивают свою вирулентность (патогенность), но частично сохраняют антигенные свойства. Разработаны сложные среды, в которых болезнетворные трепонемы не размножаются, но сохраняют свою жизнеспособность в течение 18-21 дней. Возбудители других трепонематозов также не удается вырастить in vitro.
Обычно T. pallidum культивируется путём заражения кроликов. Проявления сифилиса, наиболее сопоставимые у людей и у кроликов с экспериментальным сифилисом, получают при заражении кроликов в яичко патогенными бледными трепонемами (сифилитический орхит). Для этого используют лабораторный штамм Никольса (Nichols), специально адаптированный для животных.
Штамм Никольс был выделен в 1912 году из спинномозговой жидкости пациента с ранним нейросифилисом (работа американских ученых Nichols and Hough, 1913). Этот штамм стал эталонным в лабораторных исследованиях сифилиса и уже более столетия пассируется (перевивается) на кроликах. Штамм Никольс остается заразным и для человека; несмотря на многолетнее культивирование на кроликах, известны случаи случайного лабораторного заражения работников лабораторий.
Технология получения новых лабораторных штаммов из клинических изолятов, выделенных непосредственно от больных сифилисом, трудоемка и занимает длительное время. Это связано, в частности, с тем, что до настоящего времени не разработано эффективной технологии поддержания жизнедеятельности патогенных бледных трепонем в лабораторных условиях.
Трепонема способна размножаться в узком температурном диапазоне — около 37 °C.
В окружающей среде бледная трепонема слабоустойчива, при 55 °С гибнет в течение 15 мин, чувствительна к высыханию, свету, солям ртути, висмуту, мышьяку, пенициллину. При 60°С она гибнет через 10-15 минут, а при кипячении (при 100°С) гибнет мгновенно. При комнатной температуре во влажной среде трепонемы сохраняют подвижность до 12 часов. Кроме того, возбудитель сифилиса довольно чувствителен к большинству антисептических средств. К низким температурам бледные трепонемы устойчивы.
Грамотрицательные бактерии — бактерии, которые не окрашиваются кристаллическим фиолетовым при окрашивании по Граму. В отличие от грамположительных бактерий, которые сохранят фиолетовую окраску даже после промывания обесцвечивающим растворителем (спирт), грамотрицательные полностью обесцвечиваются. Бледная трепонема является грам-отрицательной бактерией.







![Горизонтальный обмен генами. рождение сложности [эволюционная биология сегодня: неожиданные открытия и новые вопросы]](http://mediaex.ru/wp-content/uploads/e/3/1/e31e8288620e1d8bb258a3edcd6ea182.jpeg)












![Горизонтальный обмен генами. рождение сложности [эволюционная биология сегодня: неожиданные открытия и новые вопросы]](http://mediaex.ru/wp-content/uploads/5/5/5/555a432a0a71df8d753c27573de84cfd.jpeg)