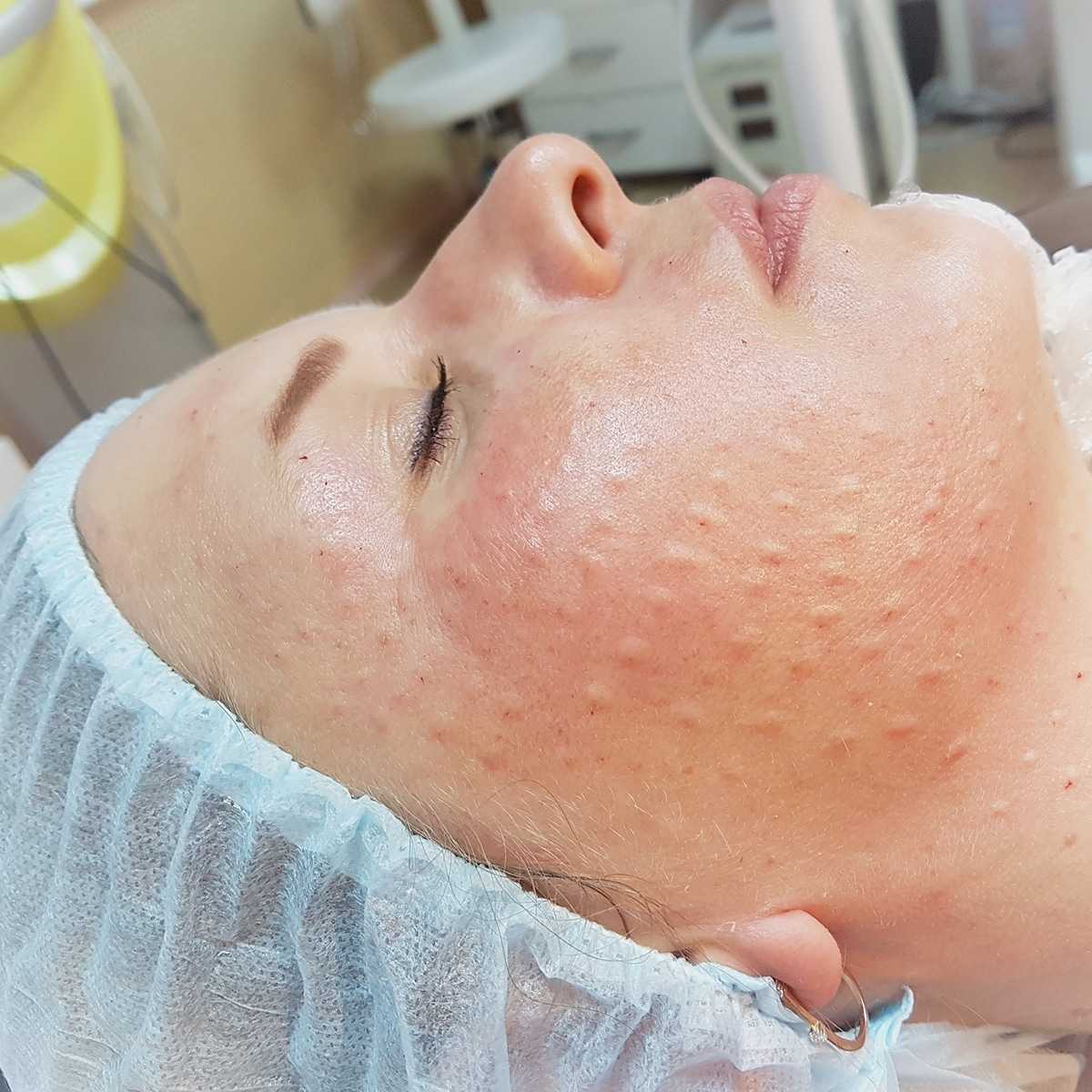
Проведение
Выполнение инъекций может проводиться несколькими (разными) методами, разновидность выбирается косметологом в зависимости от зоны и состояния кожных покровов.
Папульная техника
Препарат вводят в средние и поверхностные слои дермы. Иглу располагают под острым углом (примерно 15 градусов) и держат ее срезом вверх. На поверхности кожи образуются небольшие возвышения – папулы, заполненные введенным веществом, которое постепенно распределяется в окружающих тканях. При использовании средств на основе синтезированной гиалуроновой кислоты процесс восстановления может занять до 3-х дней. При использовании препарата CURACEN – от 20 до 60 минут. Последствия такой косметической процедуры положительные, биоревитализация отличается долговременным сохранением эффекта благодаря замедленному рассасыванию препарата.
Средний размер бугорков составляет около 4 мм. В особо нежных участках (вокруг глаз и губ) создают папулы меньшего размера, диаметром до 2-х мм.
Бугорковая или микропапульная техника
Уколы делают иглой длиной 4 мм, под углом 45 градусов. За счет этого действующие вещества попадают в самые глубокие слои дермы. Внешне кожа остается ровной, визуально заметны только следы от инъекций.
Линейно-ретроградная техника
Суть методики состоит во введении состава длинной иглой (до 13 мм), которую после прокола проводят параллельно поверхности кожи через средние слои. На обратном движении шприца вводят действующее вещество.
За счет использования этой техники специалистам удается снизить количество уколов, а глубокое проникновение иглы дополнительно стимулирует регенеративные процессы кожи. На сколько хватит эффекта от биоревитализации лица таким способом, во многом зависит от мастерства косметолога, индивидуальных особенностей пациента и домашнего ухода. В среднем этот срок составляет от 6 месяцев до 1 года.
Темновая фаза фотосинтеза
Что образуется при фотосинтезе в темновую фазу? В строме хлоропластов с помощью энергии АТФ и восстановителя НАДФН, полученных в световую фазу, образуются простые сахара, из которых в ходе других процессов образуется крахмал. Ферментативные процессы не нуждаются в наличии света. Важнейший процесс, происходящий в темновую фазу фотосинтеза, — фиксация углекислого газа воздуха. Синтез и превращения сахаров в хлоропластах имеют циклический характер и носят название цикл Кальвина.
В нём можно выделить три этапа:
- Фаза карбоксилирования (введение CO2 в цикл).
- Фаза восстановления (используются АТФ и НАДФН, полученные в световую фазу).
- Фаза регенерации (превращения сахаров).
В строме хлоропластов находится производное простого пятиуглеродного сахара рибозы. С помощью особого фермента (Рубиско) к производному рибозы присоединяется CO2 (реакция карбоксилирования) — образуется неустойчивое шестиуглеродное соединение, которое быстро распадается на две трехуглеродные молекулы. Дальше, с затратой АТФ и НАДФН, полученных в ходе световых процессов, трехуглеродное соединение модифицируется — образуется восстановленное соединение с атомом фосфора и альдегидной группой в составе. Теперь перед клеткой стоит проблема: необходимо получить шестиуглеродное соединение — глюкозу для синтеза крахмала, а также пятиуглеродное — производное рибозы для того, чтобы эти процессы могли начаться заново. Для решения этих проблем в фазу регенерации из полученных ранее трехуглеродных соединений под действием ферментов образуются четырёх-, пяти-, шести- и семиуглеродные сахара. Из шестиуглеродной молекулы образуется глюкоза, из которой синтезируется крахмал. Из пятиуглеродной молекулы образуется производное рибозы и цикл замыкается. Остальные сахара также используются клеткой в других биохимических процессах.
Отдельно стоит сказать про крайне важный фермент первой фазы цикла Кальвина — рибулозо-1,5-дифосфаткарбоксилазу (Рубиско). Это сложный фермент, состоящий из 16 субъединиц, с молекулярной массой в 8 раз больше, чем у гемоглобина. Является одним из важнейших ферментов в природе, поскольку играет центральную роль в основном механизме поступления неорганического углерода (из CO2) в биологический круговорот. Содержание Рубиско в листьях растений очень велико, он считается самым распространённым ферментом на Земле.
Рис.3. Суммарные уравнения и частные реакции фотосинтеза.
Формирование
Основной путь производства ЧАС+3 является реакцией ЧАС+2 и H2.
- ЧАС+2 + H2 → ЧАС+3 + H
Концентрация ЧАС+2 это то, что ограничивает скорость этой реакции в природе: единственный известный естественный источник ее — ионизация H2 по космический луч в межзвездном пространстве за счет ионизации H2:
- ЧАС2 + космический луч → ЧАС+2 + е− + космический луч
Космические лучи обладают такой большой энергией, что на них почти не влияет относительно небольшая энергия, передаваемая водороду при ионизации H2 молекула. В межзвездных облаках космические лучи оставляют за собой след ЧАС+2, и поэтому ЧАС+3. В лабораториях, ЧАС+3 производится по тому же механизму в плазменных разрядных ячейках, при этом потенциал разряда обеспечивает энергию для ионизации H2.
Инъекционная биоревитализация лица
Методику можно условно разделить на три этапа. Перед ее применением обязательно нужно проконсультироваться со специалистом для исключения противопоказаний. Например, технику нельзя использовать в период беременности, при наличии острых воспалительных заболеваний.
Все этапы занимают около 30-40 минут, в отдельных случаях до 1 часа. Причем большую часть времени (15-20 мин) уходит на ожидание действия анестетика. Сами инъекции выполняют за 10-15 минут.
Подготовка к процедуре
В процессе консультации косметологи проводят внешний осмотр кожи, опрашивают пациента. Затем выбирается область воздействия, оптимальный препарат, метод его введения. Хорошо себя зарекомендовал CURACEN – это многокомпонентное средство, оказывающее комплексный восстановительный эффект – снижение темпов старения кожи, предупреждение появления морщин, профилактика и лечение пигментации.
Ход процедуры
Перед посещением специалиста стоит избегать стрессов и употребления алкоголя, а также не курить за пару часов до сеанса. Перед биоревитализацией и до того, как нужно колоть вещество, косметологи соблюдают следующий алгоритм:
- Снятие косметики с лица клиента.
- Обработка кожи антисептическим раствором и разметка области введения состава.
- Нанесение местного анестетика.
- Инъекции препарата выполняются с помощью японских игл NANONEEDLE. Они позволяют сделать процедуру менее болезненной и травматичной. А это означает, что и период реабилитации будет проходить быстрее.
Женщинам желательно проводить манипуляции после 14-го дня менструального цикла. Это связано с увеличенной болевой чувствительностью, значительными гормональными изменениями, которые наблюдаются у большинства клиенток до этого времени.
Закрепление результата
После окончания сеанса на кожу наносят лечебную косметику с успокаивающим и противовоспалительным эффектом, а в летнее время крем с SPF. Далее врач-косметолог оценивает состояние пациента, дает рекомендации по дальнейшему домашнему уходу.
Как изменяют гиалуроновую кислоту для производства наполнителей
Поскольку каждый из вариантов гиалуроновой кислоты по-своему полезен, молекулы с разной молекулярной массой сшивают, образуя соединения, питающие кожу и работающие как филлеры. Так действуют двухфазные наполнители – Restylane, Perlane, Macrolane, Profhilo.
Молекулы гиалуроновой кислоты имеют достаточно большую длину и по форме напоминают спагетти, поэтому их можно соединять между собой различными способами, чтобы изготавливать препараты для улучшения внешнего вида лица, шеи, рук, зоны декольте. Эта органическая кислота практически не вступает во взаимодействие с другими веществами, что позволяет её смешивать с разными компонентами.
Существует несколько основных типов гиалуроновой кислоты, входящей в состав косметологических средств:
- Несшитая (нативная). Гиалуронка в виде длинных природных молекул. Основное предназначение такой формы – напитать кожу влагой, поскольку это вещество «умеет» прекрасно притягивать и удерживать воду. Средства на основе несшитой гиалуроновой кислоты применяются при сухости кожи, шелушении, воспалительных процессах. Они улучшают рост волос, делают их более густыми, сильными, блестящими, уменьшают или полностью останавливают выпадение.
- Сшитая. Длинные волокна гиалуроновой кислоты сшиваются (ретикулируются). Сшивать их можно в разных направлениях, получая более плотные поперечно-сшитые варианты или соединять в трехмерные частицы, максимально увеличивающие объем тканей. Разные методы сшивания дают возможность применять гиалуроновую кислоту для увеличения или коррекции различных зон лица и тела. Благодаря сшивке фермент гиалуронидаза очень долго не может «распознать» и разложить наполнитель, поэтому филлер остается в тканях до полутора лет и более.
- Обработанная на наковальне Бриджмена. Такая гиалуроновая кислота обогащена молекулами других веществ. С помощью наковальни без каких-либо химических реакций, на гиалуронку «навешивают» полезные компоненты – витамины, микроэлементы, пептиды, улучшающие состояние кожи и волос. Полученные соединения обладают высокой прочностью и не содержат примесей. Фермент гиалуронидаза не «узнаёт» такую гиалуроновую кислоту, поэтому очень долго ее не разлагает. Препарат борется с морщинами, увлажняет кожу и питает её полезными веществами.
- Стабилизированная. Эту кислоту изменяют очень слабо, менее, чем на 1%, только чтобы увеличить её стойкость. В результате образуются крепкие межмолекулярные связи, дольше удерживающие препарат в тканях.
- Этерифицированная. Кислота, к молекуле которой присоединены эфиры. Притягивает и удерживает влагу в количестве, значительно превышающем ее объём. Препараты с ней работают как суперэффективные филлеры, однако их нельзя применять при склонности к отекам.
- Гиалуронат натрия. Это вещество может удерживать воды в 1000 раз больше своего веса. Его молекулы имеют небольшой размер и быстро проникают в кожу. Гиалуронат натрия менее подвержен окислению и дольше задерживается в тканях.
Препараты одного и того же типа могут содержать разный процент гиалуроновой кислоты. Это позволяет подобрать средство для кожи, в зависимости от ее общего состояния. Более концентрированные средства применяются для пациентов с явно выраженными возрастными изменениями тканей, высокой степенью сухости кожи, которая воспаляется и шелушится. Чем сильнее выражены негативные процессы, тем выше должен быть процент содержания гиалуронки во вводимом средстве.
Очистка гиалуроновой кислоты
Что такое «зеркальные» вещества
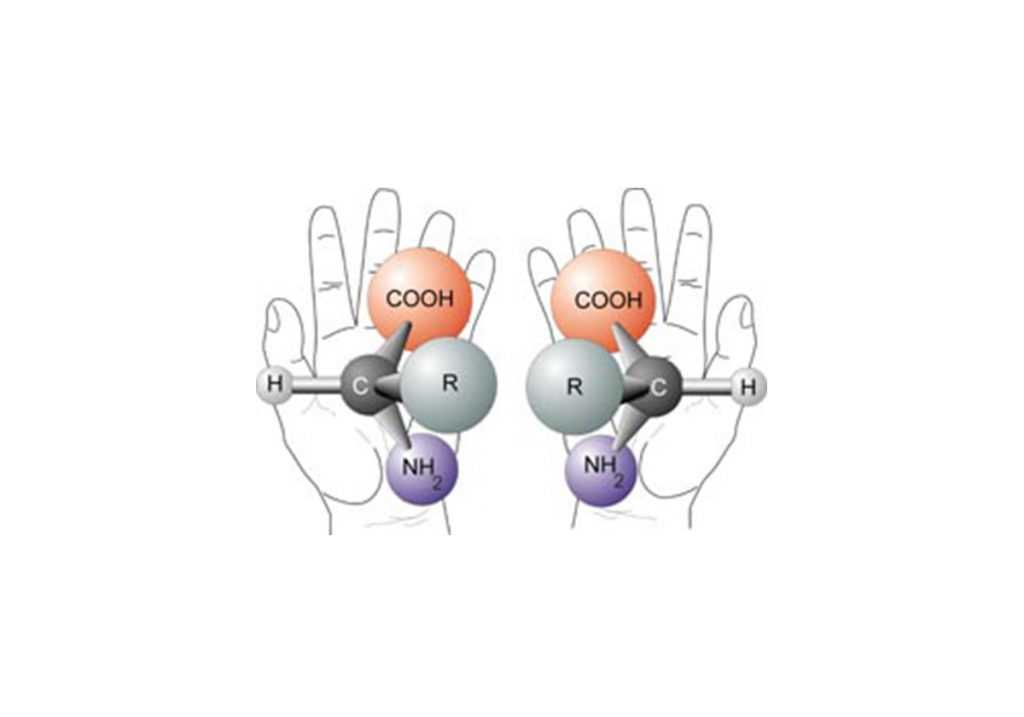
«Зеркальные» вещества называются оптическими изомерами. Термин, кстати, не самый удачный, так как он описывает лишь вращение поляризации света при его прохождении через растворы различных оптических изомеров одного и того же вещества. Более широко используемый термин — энантиомеры. Это понятие лучше всего проиллюстрировать картинкой из «Википедии»:
 Источник
Источник
В химии соединение принимает лишь одну конфигурацию — энергетически выгодную, которая обусловлена взаимодействием электронных оболочек атомов. В данном случае трехгранная пирамида (тетраэдр) является такой выгодной конфигурацией взаимного расположения атомов, связанных с центральным атомом углерода. И расположение ее «углов» может быть либо как на левой руке, либо как на правой, причем эти «отражения» невозможно совместить, как бы вы их ни крутили. Кстати, химики особо не задумываются и так и называют оптические изомеры — левовращающие (L-изомеры) и правовращающие (D-изомеры).
Из этого правила, конечно же, есть исключения: в природе встречаются D-аминокислоты, но их мало, у них весьма специфические свойства (например, регуляция метаболизма у некоторых бактерий), и они не включаются в состав белков.
В знаменитом эксперименте Миллера — Юри, воспроизводящем условия древней Земли и так называемого этапа абиогенеза — образования органических соединений из неорганики, на выходе получалась равная смесь L- и D-аминокислот. Существует несколько гипотез, объясняющих преобладание L-форм (например, что излучение «молодого» Солнца было частично поляризовано и поглощалось D-аминокислотами с последующим их разрушением), но на данный момент они мало продвинулись в объяснении того, почему ранние протоорганизмы всё-таки «выбрали» L-аминокислоты для самовоспроизведения.
Однако все ученые сходятся на одном: явление «гомохиральности», то есть использования исключительно L- либо D-аминокислот, — одно из ключевых пунктов в стабильности белковых молекул.
Астрономическое обнаружение [ править ]
ЧАС+ 3был обнаружен в двух типах небесных сред: планетах Юпитера и межзвездных облаках. На планетах Юпитера он был обнаружен в ионосферах планеты, в области, где высокоэнергетическое излучение Солнца ионизирует частицы в атмосфере. Поскольку в этих атмосферах высокий уровень H 2 , это излучение может производить значительное количество H 2.+ 3. Кроме того, с широкополосным источником, таким как Солнце, есть много излучения, чтобы накачать H+ 3 в более высокие энергетические состояния, из которых он может расслабиться за счет стимулированного и спонтанного излучения.
Планетарные атмосферы править
Обнаружение первого H+ 3эмиссионные линии были представлены в 1989 г. Drossart et al. , найдены в ионосфере Юпитера. Дроссарт обнаружил в общей сложности 23 H+ 3линий с плотностью столбцов 1,39 × 10 9 / см 2 . Используя эти линии, они смогли присвоить температуру H+ 3около 1100 К (830 ° C), что сопоставимо с температурами, определенными по эмиссионным линиям других веществ, таких как H 2 . В 1993 году , Н+ 3был обнаружен на Сатурне Geballe et al. и в Уране Trafton et al.
Молекулярные межзвездные облака править
ЧАС+ 3не был обнаружен в межзвездной среде до 1996 года, когда Geballe & Oka сообщили об обнаружении H+ 3в двух направлениях молекулярного облака, GL2136 и W33A. Оба источника имели температуру H+ 3около 35 К (-238 ° C) и плотности колонки около 10 14 / см 2 . С тех пор H+ 3был обнаружен во многих других молекулярных облаках, таких как AFGL 2136, Mon R2 IRS 3, GCS 3-2, GC IRS 3, и LkHα 101.
Рассеянные межзвездные облака править
Неожиданно три H+ 3линии были обнаружены в 1998 г. McCall et al. в зоне видимости диффузного облака Cyg OB2 № 12. До 1998 года считалось , что плотность H 2 слишком мала, чтобы произвести обнаруживаемое количество H+ 3. МакКолл обнаружил температуру ~ 27 К (-246 ° C) и плотность столбцов ~ 10 14 / см 2 , такую же плотность столбцов, как у Geballe & Oka. С тех пор H+ 3был обнаружен на многих других объектах обзора диффузных облаков, таких как GCS 3-2, GC IRS 3, и ζ Persei.
Прогнозы стационарной модели править
Чтобы аппроксимировать длину пути H+ 3в этих облаках Ока использовал стационарную модель для определения прогнозируемой плотности числа в диффузных и плотных облаках. Как объяснялось выше, как диффузные, так и плотные облака имеют один и тот же механизм образования H+ 3, но разные доминирующие механизмы разрушения. В плотных облаках перенос протонов с CO является доминирующим механизмом разрушения. Это соответствует прогнозируемой плотности 10 -4 см -3 в плотных облаках.
- п ( H+ 3) = ( ζ / k CO ) [ n (H 2 ) / n (CO)] ≈ 10 −4 / см 3
- п ( H+ 3) = ( ζ / k e ) [ n (H 2 ) / n (C + )] ≈ 10 −6 / см 3
В диффузных облаках доминирующим механизмом разрушения является диссоциативная рекомбинация. Это соответствует прогнозируемой плотности 10 -6 / см 3 в диффузных облаках. Следовательно, поскольку плотности столбцов для диффузных и плотных облаков примерно одного порядка величины, диффузные облака должны иметь длину пути в 100 раз больше, чем для плотных облаков. Следовательно, используя H+ 3 как зонд этих облаков, можно определить их относительные размеры.
Формирование [ править ]
Основной путь производства H+ 3является реакцией H+ 2и H 2 .
- ЧАС+ 2+ H 2 → H+ 3 + H
Концентрация H+ 2это то , что ограничивает скорость этой реакции в природе: единственный известный природный источник нем посредством ионизации Н 2 с помощью космических лучей в межзвездном пространстве путем ионизации H 2 :
- H 2 + космические лучи → H+ 2+ e — + космический луч
Космические лучи обладают такой большой энергией, что на них почти не влияет относительно небольшая энергия, передаваемая водороду при ионизации молекулы H 2 . В межзвездных облаках космические лучи оставляют за собой след H+ 2, а значит, H+ 3. В лабораториях H+ 3производится с помощью того же механизма в плазменных разрядных ячейках, при этом потенциал разряда обеспечивает энергию для ионизации H 2 .
Разрушение
Информация для этого раздела также была взята из статьи Эрика Хербста. Есть много реакций разрушения для ЧАС+3. Основной путь разрушения в плотных межзвездных облаках — перенос протона с нейтральным партнером по столкновению. Наиболее вероятный кандидат на роль разрушительного партнера при столкновении — вторая по распространенности молекула в космосе, CO.
- ЧАС+3 + CO → HCO+ + H2
Важным продуктом этой реакции является HCO.+, важная молекула для межзвездной химии. Его сильный диполь и высокая численность делают его легко обнаруживаемым радиоастрономия. ЧАС+3 также может реагировать с атомарным кислород образовать ОН+ и H2.
- ЧАС+3 + O → ОН+ + H2
ОЙ+ затем обычно реагирует с большим количеством H2 создавать дальше гидрогенизированный молекулы.
- ОЙ+ + H2 → ОЙ+2 + H
- ОЙ+2 + H2 → ОЙ+3 + H
На данный момент реакция между ОЙ+3 и H2 в межзвездных облаках больше не является экзотермическим. Наиболее распространенный путь уничтожения ОЙ+3 является диссоциативная рекомбинация, что дает четыре возможных набора продуктов: H2О + Н, ОН + Н2, ОН + 2Н и О + Н2 + H. Хотя воды является возможным продуктом этой реакции, это не очень эффективный продукт. Различные эксперименты показали, что вода создается где-то в 5–33% случаев. Образование воды на зерна до сих пор считается основным источником воды в межзвездной среде.
Самый распространенный путь разрушения ЧАС+3 в диффузных межзвездных облаках происходит диссоциативная рекомбинация. Эта реакция имеет несколько продуктов. Основным продуктом является диссоциация на три атома водорода, которая происходит примерно в 75% случаев. Второстепенный продукт — H2 и H, что происходит примерно в 25% случаев.
Астрономическое обнаружение триводорода
H 3 +был обнаружен в двух типах сред: межзвездных облаках и атмосфере газовых гигантов планет типа Юпитер . В последнем случае , trihydrogen была обнаружена в ионосфере , где плотность молекулярного водорода является значительной и , где это водород получает солнечное излучение в количествах , достаточных для получения больших количеств Н 3 + ионов.возбужденные, которые возвращаются в свое основное состояние , создавая характерные эмиссионные линии, которые позволяют их обнаруживать.
- Планетарные атмосферы
О первом обнаружении триводорода сообщили в 1989 г. Drossart et al. в атмосфере Юпитера, которая наблюдала в общей сложности двадцать три линии выбросов H 3 +. По этим линиям они смогли оценить температуру окружающей среды этих катионов на уровне около 1100 К , что сопоставимо с оценками, полученными для других видов, таких как H 2..
Катион H 3 +был идентифицирован на Сатурне в 1993 году Geballe et al. и в том же году на Уране Trafton et al. .
- Молекулярные межзвездные облака
H 3 +была обнаружена в межзвездной среде только в 1996 году Гебалле и Окой в направлении двух молекулярных облаков, GL2136 и W33A, с температурой порядка 35 К и концентрацией ионов примерно 10 14 см -2 в сечении. С тех пор количество наблюдений в плотных молекулярных облаках увеличилось.
- Рассеянные межзвездные облака
Что еще более неожиданно, три линии иона H 3 +были обнаружены в 1998 г. McCall et al. в сторону Cygnus OB2 No. 12; это было неожиданно, потому что плотность этой среды считалась слишком низкой, чтобы позволить образование обнаруживаемых количеств ионов H 3 +.. Однако если расчетная температура составляла всего 27 К , концентрация ионов H 3 + был обнаружен того же порядка величины, что и измеренный двумя годами ранее Гебалле и Ока на линии прямой видимости плотных облаков GL2136 и W33A.
Впоследствии H 3 + обнаружен во многих диффузных образованиях.
Орто / пара-Н 3 + [ править ]
Столкновение орто- H+ 3и пара-H 2 .
Протоны + может быть в двух разных спиновых конфигурациях , называемых орто и пара. Орто- H+ 3все три спина протонов параллельны, что дает общий ядерный спин 3/2. Пара- H+ 3 имеет два параллельных протонных спина, а другой — антипараллельный, что дает общий ядерный спин 1/2.
Самая распространенная молекула в плотных межзвездных облаках — это 1ЧАС2который также имеет орто- и пара- состояния с полными ядерными спинами 1 и 0 соответственно. Когда H+ 3молекула сталкивается с молекулой H 2 , может происходить перенос протона. Передача по-прежнему дает H+ 3молекулы и молекулы H 2 , но потенциально может изменить общий ядерный спин двух молекул в зависимости от ядерных спинов протонов. Когда орто- H+ 3и пара-H 2 сталкиваются, результатом может быть пара- H+ 3и орто-H 2 .
Внешние ссылки [ править ]
- ЧАС+ 3 Ресурсный центр
- База данных UMIST по астрохимии 2012 / astrochemistry.net
- ЧАС+ 3 , Интернет-книга NIST по химии
| vтеОбнаружены молекулы в космическом пространстве | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Молекулы |
|
|||||||||||||||||||
| Дейтерированные молекулы |
|
|||||||||||||||||||
| Неподтвержденный |
|
|||||||||||||||||||
| Связанный |
|
|||||||||||||||||||
|
Отличия от аниона
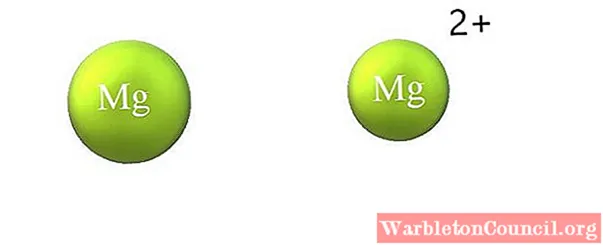
Различия между катионом и анионом перечислены ниже:
-Катион в целом меньше, чем анион. На изображении выше показано, как атомный радиус Mg уменьшается за счет потери двух электронов и превращения Mg в катион.2+; с анионами происходит обратное: они становятся более объемными.
-У него больше протонов, чем электронов, а у аниона больше электронов, чем протонов.
— Чем меньше размер, тем выше плотность заряда и, следовательно, большая поляризующая сила; то есть деформирует электронные облака соседних атомов.
-Катион движется в том же направлении, что и приложенное электрическое поле, а анион движется в противоположном направлении.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
-
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
-
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
-
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Одноатомный
Одноатомные катионы происходят в основном из металлов (за некоторыми исключениями, такими как H+). В остальном крайне редко можно рассматривать катион, полученный из неметаллического элемента.
Будет видно, что многие из них двух- или поливалентны, и что величина их зарядов согласуется с числом их групп в периодической таблице.
-Li+
-На+
-K+
-Rb+
-Cs+
-Пт+
-Ag+
Все они имеют общий заряд «1+», который записывается без необходимости вводить число и также происходит из группы 1: щелочные металлы. Кроме того, есть катион Ag+, один из самых распространенных переходных металлов.
-Быть2+
-Mg2+
-AC2+
-Мистер2+
-Ба2+
-Ра2+
Эти двухвалентные катионы являются производными соответствующих металлов, принадлежащих к группе 2: щелочноземельных металлов.
-Для3+
-Ga3+
-В3+
-Tl3+
-Nh3+
Трехвалентные катионы группы бора.
До сих пор эти примеры характеризовались как имеющие одну валентность или заряд. Другие катионы проявляют более одной валентной или положительной степени окисления:
-Sn2+
-Sn4+ (банка)
-Co2+
-Co3+ (кобальт)
-Au+
-Au3+ (золото)
-Вера2+
-Вера3+ (железо)
А другие металлы, такие как марганец, могут иметь еще больше валентностей:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Чем выше заряд, тем меньше и сильнее поляризуется катион.
Заключение
Из-за разности длин волн у CO2 лазера (10 600 нм) и Er:YAG (2 940 нм) различается и степень поглощения лазерной энергии хромофором воды. Излучаемая эрбиевым лазером энергия поглощается хромофором воды в 12-15 раз больше, чем у CO2 лазерной системы, благодаря чему мы видим совершенно разные клинические эффекты. CO2 лазер справляется с выраженными гипертрофическими рубцами, глубокими инволютивными морщинами, однако практически всегда имеет длительный период десоциализации и реабилитации для пациента, в то время как эрбиевый лазер прекрасно справляется с нормо- и атрофическими рубцами кожи, «подтяжкой лица», возрастными изменениями кожи с коротким периодом реабилитации.



















![Трехводородный катионсодержание а также история [ править ]](http://mediaex.ru/wp-content/uploads/b/f/8/bf85d24a3f7222177118aeb535984454.jpeg)