История
FOXP2 и его ген были обнаружены в результате исследований в английской семье, известной как семья KE , половина из которых (15 человек в трех поколениях) страдала речевым и языковым расстройством, называемым вербальной диспраксией в процессе развития . Их случай изучался в Институте здоровья детей Университетского колледжа Лондона . В 1990 году Мирна Гопник , профессор лингвистики в Университете Макгилла , сообщила, что в семье К.Е., пострадавшей от этого расстройства, был серьезный дефект речи с непонятной речью, в значительной степени характеризовавшейся грамматическими нарушениями. Она выдвинула гипотезу, что причиной была не обучаемость или когнитивная неспособность, а генетические факторы, влияющие в основном на грамматические способности. (Ее гипотеза привела к популяризации существования «грамматического гена» и спорному понятию грамматико-специфического расстройства.) В 1995 году исследователи Оксфордского университета и Института детского здоровья обнаружили, что это расстройство было чисто генетическим. Примечательно, что наследование заболевания от одного поколения к другому соответствовало аутосомно-доминантному наследованию, то есть мутации только одного гена на аутосоме (неполовой хромосоме ), действующей доминантным образом. Это один из немногих известных примеров менделевского (моногенного) наследования расстройства, влияющего на речь и языковые навыки, которые обычно имеют сложную основу, включающую несколько генетических факторов риска.
Ген FOXP2 расположен на длинном (q) плече хромосомы 7 в положении 31.
В 1998 году генетики Оксфордского университета Саймон Фишер , Энтони Монако , Сесилия С.Л. Лай, Джейн А. Херст и Фаранех Варга-Хадем определили аутосомно-доминантное моногенное наследование, которое локализовано на небольшом участке хромосомы 7 из образцов ДНК, взятых у пострадавших и незатронутые участники. Хромосомный участок (локус) содержал 70 генов. Комитет по номенклатуре генома человека дал этому локусу официальное название «SPCH1» (от «расстройство речи и языка-1»). Картирование и секвенирование хромосомной области выполняли с помощью бактериальных искусственных хромосомных клонов. Примерно в это же время исследователи определили человека, который не имел отношения к семье KE, но имел похожий тип речевого и языкового расстройства. В этом случае у ребенка, известного как CS, произошла хромосомная перестройка ( транслокация ), при которой часть хромосомы 7 была заменена частью хромосомы 5. Место разрыва хромосомы 7 было расположено в области SPCH1.
В 2001 году команда ученых определила в CS, что мутация находится в середине гена, кодирующего белок. Используя комбинацию биоинформатики и анализа РНК , они обнаружили, что ген кодирует новый белок, принадлежащий к группе факторов транскрипции forkhead-box (FOX) . Таким образом, ему было присвоено официальное название FOXP2. Когда исследователи секвенировали ген FOXP2 в семействе KE, они обнаружили гетерозиготную точечную мутацию, характерную для всех затронутых людей, но не у здоровых членов семьи и других людей. Эта мутация происходит из-за аминокислотной замены, которая ингибирует ДНК-связывающий домен белка FOXP2 . Дальнейший скрининг гена выявил несколько дополнительных случаев нарушения FOXP2 , включая различные точечные мутации и хромосомные перестройки, что свидетельствует о том, что повреждения одной копии этого гена достаточно, чтобы сорвать развитие речи и языка.
Структура и функции
Как белок FOX , FOXP2 содержит домен вилочного бокса. Кроме того, он содержит полиглутаминовый тракт , цинковый палец и лейциновую молнию . Белок присоединяется к ДНК других белков и контролирует их активность через домен вилочного блока. Идентифицировано лишь несколько генов-мишеней, однако исследователи полагают, что могут быть до сотен других генов, нацеленных на ген FOXP2. Белок P2 из вилочного бокса активен в головном мозге и других тканях до и после рождения, многие исследования показывают, что он имеет первостепенное значение для роста нервных клеток и передачи между ними. Ген FOXP2 также участвует в синаптической пластичности, что делает его необходимым для обучения и памяти.
FOXP2 необходим для правильного развития мозга и легких. Нокаутные мыши, имеющие только одну функциональную копию гена FOXP2 , в качестве детенышей значительно снижали вокализацию. Нокаутные мыши без функциональных копий FOXP2 бегают, демонстрируют аномалии в областях мозга, таких как слой Пуркинье , и умирают в среднем через 21 день после рождения из-за неадекватного развития легких.
FOXP2 экспрессируется во многих областях мозга, включая базальные ганглии и нижнюю лобную кору , где он важен для созревания мозга и развития речи и языка. Было обнаружено, что у мышей экспрессия гена у самцов была в два раза выше, чем у самок, что коррелировало с почти двукратным увеличением количества звуков, издаваемых самцами при разлучении с матерью. Напротив, у человеческих детей в возрасте 4–5 лет было обнаружено, что ген на 30% больше экспрессируется в областях Брока у детей женского пола. Исследователи предположили, что ген более активен в «более коммуникативном сексе».
Экспрессия FOXP2 является предметом посттранскрипционной регуляции , особенно микроРНК (miRNA), которая связывается с множеством сайтов связывания miRNA в неокортексе , вызывая репрессию нетранслируемой области FOXP2 3 ‘ .
Три аминокислотные замены отличают человеческий белок FOXP2 от белка, обнаруженного у мышей, в то время как две аминокислотные замены отличают человеческий белок FOXP2 от белка, обнаруженного у шимпанзе, но только одно из этих изменений является уникальным для человека. Данные, полученные с помощью генетически модифицированных мышей и моделей нейронных клеток человека, предполагают, что эти изменения влияют на нейронные функции FOXP2 .
Клинические исследования FOXP1
-
NCT03718923
Идет набор
Синдром FOXP1: Центр исследований и лечения аутизма Seaver характеризует нарушения развития нервной системы, связанные с FOXP1, с использованием генетических, медицинских и нейропсихологических показателей.
Заболевания: FOXP1, Умственная отсталость с нарушением речи и с аутистическими чертами или без них, Расстройство аутистического спектра
-
NCT01238250
Идет набор
Онлайн-исследование людей с генетическими изменениями и выявлением аутизма: Simons Searchlight
Заболевания: 16P11.2 Deletion Syndrome, 16p11.2 Дубли, 1Q21.1 Удаление, 1Q21.1 Синдром микродупликации (расстройство), ACTL6B, АДНП, AHDC1, АНК2, АНКРД11, ARID1B, ASH1L, BCL11A, ЧЕМПИОН1, ИБС2, ИБС8, ЦСНК2А1, CTBP1, Мутация гена CTNNB1, КУЛ3, DDX3X, ДНМТ3А, ДСКАМ, DST (дистонин), связанный с простым буллезным эпидермолизом, ДЫРК1А, FOXP1, ГРИН2А, ГРИН2Б, Интеллектуальная инвалидность, связанная с HIVEP2, HNRNPH2, КАТНАЛ2, КДМ5Б, КДМ6Б, Мутация гена KMT2C, КМТ2Е, КМТ5Б, MBD5, МЭД13Л, PACS1, PBRM1, Интеллектуальная инвалидность, связанная с PPP2R5D, PTCHD1, ОТДЫХ, SCN2A Энцефалопатия, Мутация гена SETBP1, SETD5, Мутация гена SMARCA4, SMARCC1, СМАРСС2, STXBP1 Энцефалопатия с эпилепсией, Интеллектуальная инвалидность, связанная с SYNGAP1, ТБР1, АРХГЭФ9, ХНРНПУ, PPP3CA, PPP2R1A, SLC6A1, 2p16.3 Удаление, Делеции 5q35, 5q35 Дупликации, 7q11.23 Дублирование, 15Q13.3 Синдром делеции, 16p11.2 Трипликации, 16P12.2 Микроделеция, 16P13.11 Микроделеционный синдром (расстройство), 17Q12 Синдром микроделеции (расстройство), Синдром дублирования 17Q12, 17Q21.31 Синдром делеции, 17q21.3 Дупликации, АКТБ, АДСЛ, АФФ2, ALDH5A1, АНК3, АРКС, Мутация гена ATRX, Синдром AUTS2, БАЗ2Б, БКДК, БРСК2, CACNA1C, КАПРИН1, БОЧКА, CASZ1, ИБС3, CIC, CNOT3, Мутация гена CREBBP, CSDE1, CTCF, ГЛУХОЙ1, DHCR7, ДЛГ4, ДМПК, EBF3, ЭХМТ1, Генная мутация EP300, GIGYF1, GIGYF2, ГРИН1, ГРИН2Д, Синдромная умственная отсталость, связанная с IQSEC2, IRF2BPL, КАНСЛ1, KCNB1, КДМ3Б, НЕКСМИФ, КМТ2А, MBOAT7, МЭИС2, MYT1L, НАА15, НБЭА, NCKAP1, НИПБЛ, NLGN2, NLGN3, NLGN4X, NR4A2, NRXN1, NRXN2, NRXN3, Мутация гена NSD1, PHF21A, ПХФ3, ФИП, ПОМГНТ1, ПСМД12, РЕЛН, RERE, RFX3, ОПРАВЫ1, РОРБ, SCN1A, SCN8A Энцефалопатия, Мутация гена SETD2, ХОЛОСТЬ2, SIN3A, SLC9A6, СЫН, SOX5, СПАСТЬ, СРКАП, ТАОК1, ТАНК2, TCF20, ТЛК2, ТРИО, ПОЕЗДКА12, ТШЗ3, УПФ3Б, USP9X, VPS13B, ВААК, ВДФИ3, ЗБТБ20, ZNF292, ЗНФ462, Синдром делеции 2Q37, 9q34 Дупликации, Делеции 15q15, 15Q24 Удаление, NR3C2, СИНКРИП, Дополнительные генетические изменения, связанные с аутизмом, могут быть добавлены как выявленные, 2q34 Дупликация, 2q37.3 Удаление, 6q16 Делеция, 15q11.2 Делеция BP1-BP2, 16p13.3 Удаление, 17Q11.2 Синдром микродупликации (расстройство), 17п13.3, Дублирование Xq28, CLCN4, ЦНК2Б, DYNC1H1, EIF3F, ГНБ1, МЕД13, MEF2C, РАЛГАПБ, SCN1B, ГГ1, XP11.22 Дублирование
Клиническое значение
Ген FOXP2 участвует в нескольких когнитивных функциях, включая: общее развитие мозга, язык и синаптическая пластичность. Область гена FOXP2 действует как фактор транскрипции для белка P2 бокса вилки. Факторы транскрипции влияют на другие области, и было высказано предположение, что белок P2 бокса вилки также действует как фактор транскрипции для сотен генов. Это активное вовлечение открывает возможность того, что ген FOXP2 намного более обширен, чем первоначально предполагалось. Другие мишени транскрипции были исследованы без корреляции с FOXP2. В частности, корреляция FOXP2 с аутизмом и дислексией была исследована, однако в качестве причины мутации не было обнаружено. Одна четко обозначенная цель — это язык. Хотя некоторые исследования не согласны с этой корреляцией, большинство исследований показывает, что мутировавший FOXP2 вызывает наблюдаемый дефицит продукции.
Есть некоторые свидетельства того, что языковые нарушения, связанные с мутацией гена FOXP2 , не являются просто результатом фундаментального дефицита моторного контроля. Визуализация головного мозга пораженных людей указывает на функциональные нарушения в связанных с языком областях корковых и базальных ганглиев, демонстрируя, что проблемы выходят за пределы двигательной системы.
Мутации в FOXP2 относятся к нескольким (26 генов плюс 2 межгенных) локуса, которые коррелируют с диагнозом СДВГ у взрослых — клинический СДВГ — это зонтичный ярлык для гетерогенной группы генетических и неврологических явлений, которые могут быть результатом мутаций FOXP2 или других причин.
Полногеномное ассоциативное исследование (GWAS) 2020 года предполагает участие однонуклеотидных полиморфизмов (SNP) FOXP2 в восприимчивости к расстройству, вызванному употреблением каннабиса .
Языковое расстройство
Предполагается, что транслокация области 7q31.2 гена FOXP2 вызывает серьезное нарушение речи, называемое вербальной диспраксией развития (DVD) или детской апраксией речи (CAS). мир, включая оригинальное семейство KE. Миссенс-мутация, вызывающая замену аргинина на гистидин (R553H) в ДНК-связывающем домене, считается аномалией в KE. Это приведет к тому, что обычно щелочной остаток будет довольно кислым и будет иметь высокую реактивность при рН организма. Гетерозиготная нонсенс-мутация, вариант R328X, продуцирует усеченный белок, участвующий в речевых и языковых трудностях у одного человека с KE и двух из его близких членов семьи. Мутации R553H и R328X также влияли на ядерную локализацию, ДНК-связывание и свойства трансактивации (повышенной экспрессии гена) FOXP2.
Эти люди имеют делеции, транслокации и миссенс-мутации. Когда им было поручено повторять и генерировать глаголы, эти люди с DVD / CAS снизили активацию в области скорлупы и Брока в исследованиях фМРТ. Эти области обычно известны как области языковой функции. Это одна из основных причин того, что FOXP2 известен как языковой ген. У них задержка начала речи, трудности с артикуляцией, невнятная речь, заикание и плохое произношение, а также диспраксия. Считается, что большая часть этого речевого дефицита происходит из-за неспособности координировать движения, необходимые для нормальной речи, включая формирование рта и языка. Кроме того, существуют более общие нарушения с обработкой грамматических и лингвистических аспектов речи. Эти данные свидетельствуют о том, что эффекты FOXP2 не ограничиваются моторным контролем, поскольку они включают понимание среди других когнитивных языковых функций. Общие легкие двигательные и когнитивные нарушения отмечаются повсеместно. Клинически эти пациенты также могут испытывать затруднения при кашле, чихании и / или откашливании.
Хотя было высказано предположение, что FOXP2 играет решающую роль в развитии речи и языка, это мнение оспаривается тем фактом, что этот ген также экспрессируется у других млекопитающих, а также у птиц и рыб, которые не говорят. Также было высказано предположение, что фактор транскрипции FOXP2 — это не столько гипотетический «языковой ген», сколько часть регуляторного механизма, связанного с экстернализацией речи.
Взаимодействия
Известно, что FOXP2 регулирует CNTNAP2 , CTBP1 , SRPX2 и SCN3A .
FOXP2 подавляет CNTNAP2 , член семейства нейрексинов, обнаруженных в нейронах. CNTNAP2 связан с распространенными формами языковых нарушений.
FOXP2 также подавляет SRPX2 , «белок X-связанный 2, содержащий суши- повторы ». Он напрямую снижает свою экспрессию, связываясь с промотором своего гена . SRPX2 участвует в формировании глутаматергических синапсов в коре головного мозга и более высоко экспрессируется в детстве. SRPX2, по-видимому, специфически увеличивает количество глутаматергических синапсов в головном мозге, оставляя тормозные ГАМКергические синапсы неизменными и не влияя на длину или форму дендритных шипов . С другой стороны, активность FOXP2 действительно уменьшает длину и форму дендритных шипов в дополнение к их количеству, указывая на то, что он выполняет другие регуляторные роли в морфологии дендритов.
Какие функции выполняют белки RAS?
Семейство RAS включает три гена: KRAS, NRAS и HRAS. Гены HRAS и KRAS были идентифицированы в качестве онкогенов в 80-х годах прошлого столетия в опухолях у мышей после заражения вирусом саркомы Кирстен и Харви. Отсюда, соответственно, латинские буквы K и H в начале их названий. Ген NRAS был впервые идентифицирован в клетках нейробластомы — злокачественной опухоли из незрелых нервных клеток-нейробластов.
Ген KRAS кодирует два типа одноименных белков — A и B. Гены NRAS и HRAS кодируют по одному варианту белков. Все эти белки являются мембраносвязанными, они находятся внутри клетки и являются частью каскада биохимических реакций, запускающегося при активации белка-рецептора EGFR.
EGFR — рецептор эпидермального фактора роста. Этот белок встроен в клеточную мембрану. Он работает как молекулярная антенна: принимает сигналы извне и передает их внутрь клетки. Когда EGFR активируется, он запускает каскад биохимических реакций. Сбой в этих сигнальных путях играет огромную роль в развитии и прогрессировании злокачественных опухолей.
В норме каскад EGFR регулирует репликацию (синтез копий) ДНК, размножение и гибель клеток. Когда он постоянно активируется, клетки начинают бесконтрольно делиться, приобретают способность к инвазии (вторжению в окружающие ткани), метастазированию (миграции в организме с образованием вторичных очагов в различных органах). Причины активации сигнального пути бывают разными:
- мутации, которые приводят к увеличению количества рецепторов EGFR на поверхности клетки;
- мутации, которые меняют структуру EGFR и переводят его в постоянное активное состояние;
- изменения в генах, кодирующих другие звенья каскада, в результате чего он активируется вне зависимости от состояния EGFR.
Мутации RAS относятся к третьей категории.
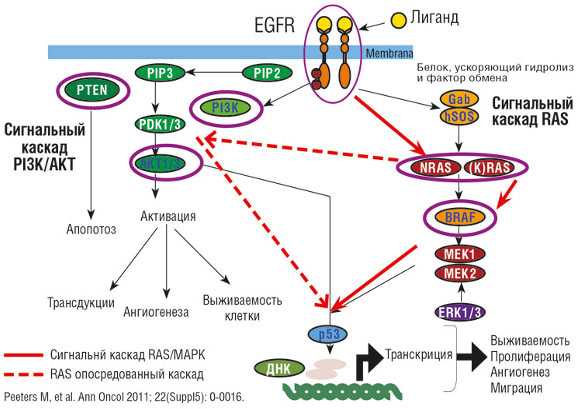
Каскад EGFR, молекулы, которые принимают в нем участие, и роль белков RAS.
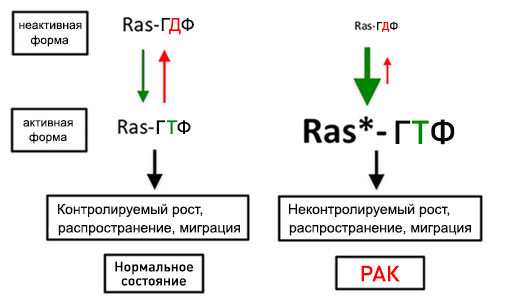
По своей природе белки RAS являются ГТФ-азами. Они способны связывать энергетическую молекулу гуанозинтрифосфат и работают как переключатели. В норме большая часть этих белков находится в неактивной, ГДФ(гуанозиндифосфат)-связанной форме. Это состояние «выкл». При активации EGFR RAS переходят в активную — ГТФ-связанную — форму. Сигнальный путь начинает работать, и в клетке происходят соответствующие события. Затем ГТФ-связанная форма переходит обратно в ГДФ-связанную, и сигнал прерывается.
При определенных мутациях белки RAS постоянно находятся во «включенном» состоянии. Их можно сравнить с автомобилем, в котором педаль «газа» заклинило, а педаль «тормоза» перестала работать. Клетке больше не нужны сигналы извне — она сама себе дает команду постоянно размножаться.
Эволюция
Ген человека FOXP2 и его эволюционная консервация показаны в множественном выравнивании (внизу рисунка) на этом изображении из браузера генома UCSC
Обратите внимание, что консервация имеет тенденцию группироваться вокруг кодирующих областей ( экзонов ).. Ген FOXP2 высоко консервативен у млекопитающих
Человеческий ген отличается от такового у нечеловеческих приматов заменой двух аминокислот: замены треонина на аспарагин в положении 303 (T303N) и замены аспарагина на серин в положении 325 (N325S). У мышей он отличается от человека тремя заменами, а у зебрового вьюрка — семью аминокислотами. Одно из двух аминокислотных различий между человеком и шимпанзе также возникло независимо у хищников и летучих мышей. Подобные белки FOXP2 можно найти у певчих птиц , рыб и рептилий, таких как аллигаторы .
Ген FOXP2 высоко консервативен у млекопитающих . Человеческий ген отличается от такового у нечеловеческих приматов заменой двух аминокислот: замены треонина на аспарагин в положении 303 (T303N) и замены аспарагина на серин в положении 325 (N325S). У мышей он отличается от человека тремя заменами, а у зебрового вьюрка — семью аминокислотами. Одно из двух аминокислотных различий между человеком и шимпанзе также возникло независимо у хищников и летучих мышей. Подобные белки FOXP2 можно найти у певчих птиц , рыб и рептилий, таких как аллигаторы .
Взятие образцов ДНК из костей Homo neanderthalensis показывает, что их ген FOXP2 немного отличается, хотя и во многом похож на ген Homo sapiens (т. Е. Человека ). Предыдущий генетический анализ показал, что ген FOXP2 H. sapiens закрепился в популяции около 125 000 лет назад. Некоторые исследователи считают, что находки неандертальцев указывают на то, что этот ген вместо этого распространился по населению более 260000 лет назад, до нашего последнего общего предка с неандертальцами. Другие исследователи предлагают альтернативные объяснения того, как версия H. sapiens могла появиться у неандертальцев, живших 43000 лет назад.
Согласно исследованию 2002 года, ген FOXP2 показал признаки недавнего положительного отбора . Некоторые исследователи предполагают, что положительный отбор имеет решающее значение для эволюции языка у людей . Другие, однако, не смогли найти четкой связи между видами с изученной вокализацией и подобными мутациями в FOXP2 . Анализ большой выборки глобально распределенных геномов 2018 года подтвердил отсутствие доказательств положительного отбора, предполагая, что исходный сигнал положительного отбора может быть обусловлен составом образца. Введение обеих человеческих мутаций в мышей, чья версия FOXP2 в остальном отличается от версий человека и шимпанзе только одной дополнительной парой оснований, вызывает изменения вокализации, а также другие поведенческие изменения, такие как снижение исследовательских тенденций и уменьшение количества оснований. время обучения лабиринту. Также наблюдается снижение уровня дофамина и изменения морфологии некоторых нервных клеток.
Не заговорили, но поумнели
Надежда Маркина, «Газета.Ру»
Ученые «очеловечили» мышей, изменив у них ген, отвечающий у человека за речь. Результат – мыши успешнее обучались находить приманку в лабиринте. Возможно, так ученые нашли изменения в мышином мозге, когда-то позволившие человеку заговорить.
Способность к членораздельной речи – главная черта, отличающая человека даже от самых высокоорганизованных животных. Но речь не возникла на пустом месте. Если человек произошел от обезьяны, как предположил Дарвин, а доказала современная антропология, то и наш совершенный мозг – предмет гордости человека, это продукт эволюции. И что-то такое с ним у наших предков произошло, что сделало возможным появление речи. Но все происходящее с мозгом берет начало в генах.
Современные генетики, раскладывая по полочкам данные анализа генома человека, обращают внимание на ген FOXP2 как наиболее близкий к тому, чтобы называться геном речи. Этот ген открыл шведский ученый Сванте Паабо, знаменитый тем, что прочитал геном неандертальца, а потом и денисовского человека
Выяснилось, что люди, у которых ген FOXP2 функционально неактивен хотя бы в одной хромосоме, страдают расстройством речи, как устной, так и письменной.
Надо сказать, что этот «ген речи» имеется не только у человека, но и у всех млекопитающих, в том числе у мышей. Мы вообще по набору генов от мышей очень мало отличаемся. Но у человека он приобрел некоторые изменения, ключевые мутации, которые и делают его необходимым для формирования речевых навыков.
Что будет, если эти изменения внести в ген FOXP2 у мышей, решили посмотреть исследователи из Массачусетского технологического института. Они произвели в мышином гене две замены, сделав его человеческим.
Эта операция радикально повлияла на грызунов. Нет, говорить «очеловеченные» мыши не научились, но стали умнее своих собратьев, о чем авторы эксперимента написали в журнале PNAS (Schreiweis et al., Humanized Foxp2 accelerates learning by enhancing transitions from declarative to procedural performance).
Мышей обычных и с человеческим геном FOXP2 обучали находить приманку в лабиринте в форме буквы Т. Чтобы его получить, мышам нужно было, дойдя до развилки, бежать либо направо, либо налево. На местонахождение приманки им указывали различные ключи-подсказки.
И вот здесь «очеловеченные» мыши показали свое преимущество: они обучались быстрее и с меньшим количеством ошибок.
Далее ученые решили посмотреть, какие изменения происходили в мозге «очеловеченных» мышей. В наиболее интересующих их областях мозга они проанализировали все активные гены (для этого собрали всю РНК, которая синтезируется на матрице ДНК, в то время как ген работает). И обнаружили, что «очеловечение» одного гена сильно повлияло на уровень активности многих других генов. Далее, оказалось, что человеческий ген изменил уровень дофамина – важнейшего передатчика нервного сигнала в некоторых частях мозга мышей. А также увеличил пластичность синапсов – контактов между нейронами. Это важнейшее условие хорошего обучения.
Мыши стали более умными, прекрасно. Но при чем здесь речь, казалось бы? Но тут выяснилось, что изменения в мозге очеловеченных мышей касаются как раз того, чего не хватает людям с дефектным геном FOXP2 и с нарушением речи.
Так что ученые предположили, что им удалось в какой-то степени смоделировать развитие мозга человека на пути к развитию членораздельной речи.
В общем, еще чуть-чуть, и можно доэкспериментироваться до говорящих мышей. А если серьезно, то понять, как удалось заговорить нашим предкам.
Виды опухолей по гормональному статусу
Выделяют отрицательные и положительные опухоли:
- Тройной негативный по гормональным рецепторам или отрицательный является отрицательным по эстроген-рецепторам (ER-отрицательный) и отрицательным по прогестерон-рецепторам (PR-отрицательный). Такие виды опухолей рецепторы гормонов не экспрессируют. Это означает, что у них их мало или их нет.
- Положительный по гормональным рецепторам рак, определяется как положительный по эстроген-рецепторам (ER-положительный) и положительным по прогестерон-рецепторам прогестерона (PR-положительный). Такие виды опухолей экспрессируют гормональные рецепторы. Это означает, что у них их много.
Все виды рака молочной железы проверяются на статус гормональных рецепторов. Этот показатель опухоли помогает определить лечение.
Если установлена ER- и PR-положительная опухоль, лечение включает гормональную терапию (например, препараты тамоксифен или ингибитор ароматазы). Гормональная терапия препятствует тому, чтобы клетки опухоли получали гормоны, необходимые для роста, и может остановить рост опухоли.




![Foxp2 forkhead box p2 [homo sapiens (human)] - gene - ncbi](http://mediaex.ru/wp-content/uploads/7/5/7/7575b3bf9fc1c7d447c151b1eedc8712.jpeg)















![Foxp2 forkhead box p2 [homo sapiens (human)] - gene - ncbi](http://mediaex.ru/wp-content/uploads/d/7/f/d7f2441eb735ad12b00b0fe20e036847.jpeg)