Какие показатели определяют при сдаче анализов
Высокое содержание белковых составляющих можно заподозрить по пене в моче. Невысокая их концентрация на внешний вид урины не влияет. Для определения белковых концентраций проводятся следующие исследования:
Анализ на микроальбуминурию – выделение альбумина. За сутки потеря этого вещества должна быть не более 30 мг. Повышение нормы называется микро- и макроальбуминурией.
<
p style=”text-align: justify;”>
| Альбуминурия | Показатель мг/сут |
| Норма | 0-30 |
| Микроальбуминурия | 30-300 |
| Макроальбуминурия | Более 300 |
Анализ на креатинин, концентрация этого вещества в суточной моче зависит от пола пациента. Это естественно, ведь мышечная масса у мужчин больше, чем у женщин.
| Пол | Показатель |
| Женщины | 5,3-15,9 ммоль/сут |
| Мужчины | 7,1-17,7 ммоль/сут. |
Общий белок мочи. В этом анализе, кроме альбуминового содержания, учитывается концентрация других белков, в небольшом количестве обнаруживаемых при различных патологиях в урине, – микроглобулинов, иммуноглобулинов, лизоцима, белка Бенс-Джонса.
Норма общего белка мочи
| Показатель | Норма |
| Утренняя моча | 0,15 г/л |
| Суточная моча в покое | 0,14 г/сут |
| Суточная моча при физической нагрузке | 0,3 г/сут. |
Соотношение альбумин/креатинин основано на определении соотношения концентрации этих двух веществ. Оно позволяет уточнить отношение потери «нужных» белков и тех, которые должны были покинуть организм, но остались. Чем меньше выделяется креатинина и больше теряется альбуминовых соединений, тем хуже работают почки.
| Соотношение | Соотношение мг альбумина / г креатинина |
| Оптимальное | Менее 10 |
| Высоконормальное | 10-29 |
| Высокое | 30-299 |
| Очень высокое | 300-1999 |
| Нефротическое | Более 2000 |
Эволюция
20S-протеасома есть у всех эукариот и необходима для жизнедеятельности эукариотической клетки. У ряда прокариот, в числе которых многие археи и бактерии порядка Actinomycetales, имеются гомологи 20S-протеасомы. У большинства же бактерий есть гены теплового шока hslV и hslU, белковые продукты которых формируют мультимерную протеазу, состоящую из двух колец. Было высказано предположение, что белок hslV, возможно, похож на предка 20S-протеасомы. Как правило, hslV не является строго необходимым для бактериальной клетки и обнаруживается не у всех бактерий, однако у некоторых протистов есть и 20S-протеасома, и hslV. У многих бактерий выявляются другие гомологи протеасомы и связанной АТФазы, например, ClpP и ClpX. Многообразием гомологов протеасомы можно объяснить то, что система HslUV не является строго необходимой для бактериальных клеток.
Анализ последовательностей показал, что каталитические β-субъединицы в ходе эволюции обособились раньше, чем α-субъединицы, играющие преимущественно структурную роль. У бактерий, имеющих 20S-протеасому, последовательности β-субъединиц очень похожи на таковые у архей и эукариот, а последовательности α-субъединиц схожи в гораздо меньшей степени. Бактерии могли получить 20S-протеасому посредством горизонтального переноса генов, а диверсификация субъединиц протеасомы у эукариот есть следствие множественных дупликаций генов.
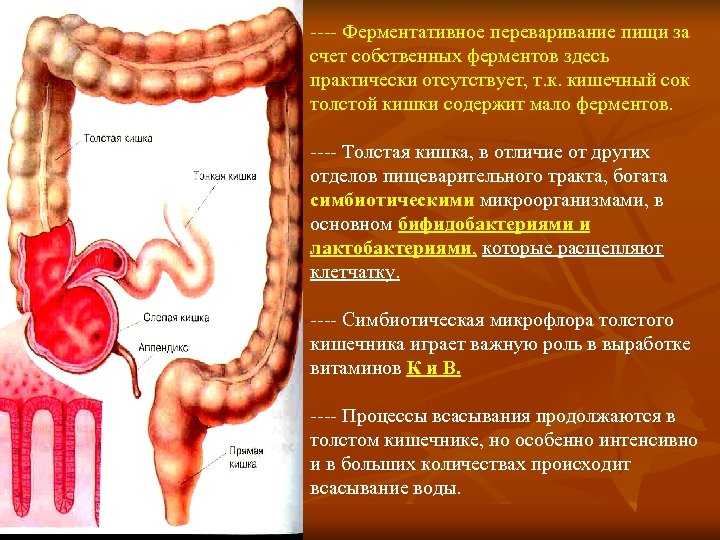
Как работает пищеварительная система?
Как мы уже сказали, пищеварение начинается в полости рта, где пища измельчается в процессе жевания и смешивается со слюной. Слюна не так агрессивна, как желудочный сок, но и она содержит определённые ферменты, которые запускают процесс пищеварения и способны расщеплять крахмал. Когда человек проглатывает пищу, она попадает в пищевод, этот участок находится между глоткой и желудком. Чтобы проглотить пищу, человек должен приложить некоторые усилия, потому что на стыке пищевода и желудка находятся кольцевые мышцы, своеобразный клапан, роль которого выполняет нижний сфинктер пищевода. Он открывается при давлении поступившей пищи и пропускает её в желудок.
В желудке происходит сразу три важных процесса:
- хранение пищи;
- смешивание пищи с желудочным соком;
- транспортировка пищи в тонкий кишечник.
Когда человек ест, желудок работает преимущественно как “мешок” или накопитель, куда попадает вся съеденная пища и выпитые жидкости. Чтобы принять весь этот груз, желудок должен уметь увеличиваться в размере, в этом ему помогают мышцы, которые находятся в верхней части желудка. В процессе потребления человеком пищи они расслабляются, что позволяет стенкам желудка растягиваться.
Смешивание пищи с желудочным соком происходит в нижней части желудка. Небольшое количество желудочного сока присутствует там всегда, но для расщепления большого количества пищи организм вырабатывает дополнительный объём желудочного сока. У желудочного сока сложных химический состав, основу которого составляют соляная кислота и пищеварительные ферменты, которые расщепляют белок. Сама по себе соляная кислота опасна и для стенок желудка, но их покрывает большое количество слизи, которая не даёт кислоте воздействовать на стенки.
Смешанная с желудочным соком пища переходит в двенадцатиперстную кишку, где под воздействием ферментов тонкого кишечника и сока поджелудочной железы перевариваются белки, жиры и углеводы. Дополнительная обработка происходит желчью, которая в остальное время накапливается в желчном пузыре, а во время еды порционно впрыскивается в двенадцатиперстную кишку. Желчные кислоты преимущественно воздействуют на жир, разбивая его на мелкие частицы, которые легко расщепляются ферментами.
Полученные в процессе расщепления пищи вещества всасываются через стенки тонкого кишечника в кровь и разносятся по всему организму. Частицы, которые переварить не удалось, перемещаются в толстый кишечник. В толстом кишечнике из непереваренных частиц всасывается вода и оставшиеся витамины, которые могут быть полезны для организма. Отходы же организм считает бесполезными и непригодными для дальнейшего использования, поэтому из них формируются каловые массы, которые попадают в прямую кишку и естественным образом выводятся. Считается, что выведение скопившихся каловых масс должно происходить ежедневно, таким образом организм самоочищается.
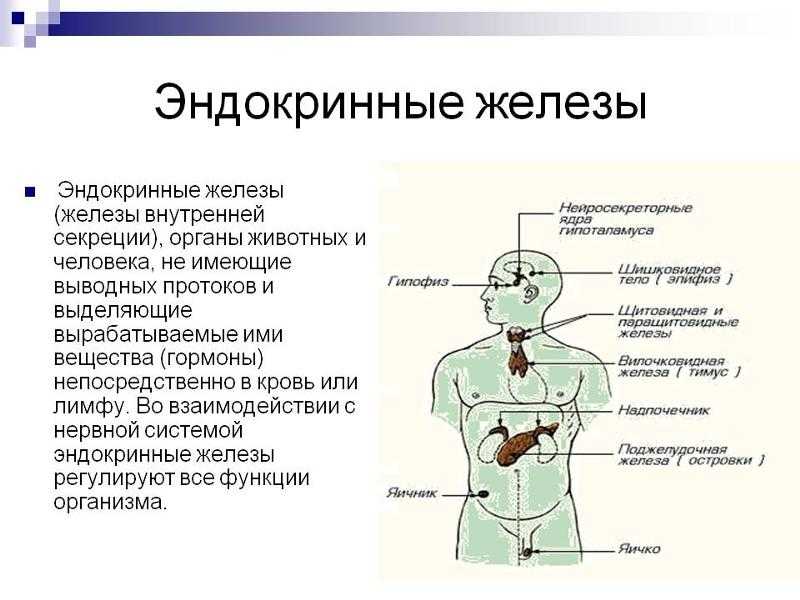
База данных
В сотрудничестве с практикующими специалистами-неврологами создана постоянно обновляемая база данных, позволяющая сопоставлять, отслеживать и оценивать огромный массив данных, включающий демографическую информацию, данные о частоте рецидивов, изменениях в неврологическом статусе (оценке по шкале EDSS), эффективности иммуномодулирующего лечения и т.д.
К большому сожалению, пока в этом реестре нет информации о пациентах из постсоветских государств:
В отличие от большинства протоколов клинических исследований, создатели MS Base сделали акцент на долгосрочных оценках: ежегодно врач-невролог вносит данные о количестве рецидивов у того или иного пациента, результатах основных диагностических тестов и процедур (МРТ, вызванные потенциалы и т.п.), прогрессировании заболевания (изменениях в оценках по шкале EDSS), о получаемом лечении. В MS Base нет критериев исключения: в базу данных на анонимной основе может быть включена информация о любом больном рассеянным склерозом вне зависимости от типа течения, накопленного неврологического дефицита, длительности заболевания.
Для специалистов MS Base является уникальной платформой для проведения глобальных наблюдательных исследований, сотрудничества и обмена опытом. Частично доступ к информации открыт и для пациентов, что позволяет сделать очередную попытку оценить возможные перспективы, сравнить свой уровень накопления неврологического дефицита, длительность заболевания, частоту обострений с информацией о других пациентах, живущих с РС (калькулятор тяжести РС см. ниже).
Открытая информация содержит следующие данные:
Гендерная статистика заболеваемости рассеянным склерозом
Возрастная структура заболеваемости рассеянным склерозом Продолжительность заболевания РС
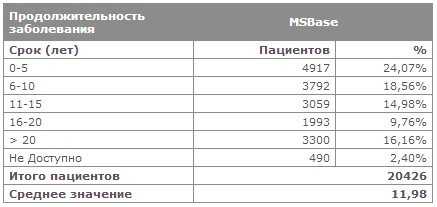
Оценка инвалидизации (по шкале EDSS)
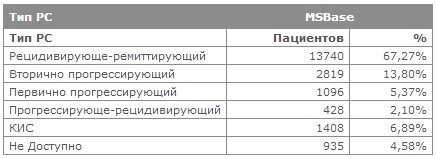
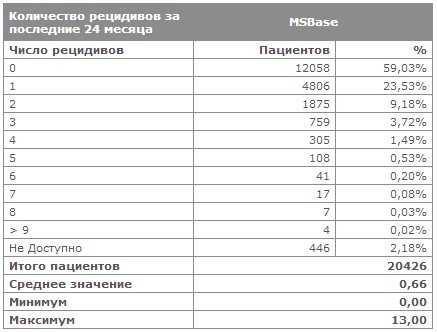
Частота рецидивов (обострений) рассеянного склероза
Еще один инструмент, содержащийся на сайте MS Base — калькулятор, который предоставляет вам возможность получить общее представление о текущей степени тяжести рассеянного склероза и сравнить ее с информацией о других пациентах, имеющих аналогичную длительность заболевания.
Плюсы и минусы системы Куртцке
Предложенная Куртцке система ЕДСС применяется во всем мире, и Россия – не исключение. Эта методика позволяет тщательно и комплексно проанализировать состояние пациента, страдающего рассеянным склерозом. Расширенный индекс применяют на последующих приемах для отслеживания динамики болезни и оценки эффективности назначенной терапии.
В этом заключаются основные преимущества шкалы ЕДСС. Кроме того, EDSS позволяет установить группу инвалидности при рассеянном склерозе.
Экспертами выделен и ряд недостатков методики Куртцке:
значительный упор на способность передвигаться;
шкала EDSS не принимает во внимание когнитивную дисфункцию;
сложность расчета и как следствие – неоднозначность полученного результата;
модель не учитывает изменения состояния при длительно текущем патологическом процессе.
Обычная и расширенная шкалы
Модель FS разработана для определения состояния проводящих систем организма и включает семь подразделов. Каждый из них представлен в виде балльной градации нарушений определенной системы по степени выраженности расстройства. Сумма баллов по каждой шкале рассчитывается отдельно. Применение системы дает углубленное представление о стадии заболевания и позволяет осуществлять постоянный мониторинг за течением патологического процесса.
Расширенную шкалу EDSS применяют для установления степени инвалидизации. Это наиболее распространенная система для отслеживания прогрессирования болезни. В расчете определяется индекс ходьбы, указывающий на способность больного пройти расстояние до 500 метров без чьей-либо помощи, до 100 метров с помощником и т. д.
Шкала состояния функциональных систем объединяет группы симптомов:
- повреждения зрительного нерва;
- расстройства черепных нервов (за исключением второй пары);
- признаки повреждения пирамидного пути;
- расстройства координации;
- расстройства чувствительности;
- дисфункция тазовых органов;
- интеллектуальные расстройства.
Система оценки степени инвалидизации включает следующие параметры:
- присутствие минимальных симптомов;
- легкая слабость, незначительные нарушения походки;
- умеренная слабость, шаткость походки, ослабление произвольных движений;
- полное самообслуживание, относительная слабость, способность держаться в вертикальном положении до полусуток;
- самостоятельное перемещение на короткие дистанции, сокращенный рабочий день;
- перемещение только с поддержкой;
- самостоятельное передвижение в инвалидном кресле, больной может сам в него садиться;
- ограничение движений кроватью или креслом-каталкой, самообслуживание при помощи рук;
- полная беспомощность, пациент прикован к кровати.
Сборка
Сборка протеасомы — очень сложный процесс, при котором множество отдельных белковых молекул должны объединиться с образованием активного комплекса. β-субъединицы синтезируются с N-концевыми «пропептидами», которые при сборке 20S-частицы подвергаются посттрансляционным модификациям, чтобы потом войти в состав каталитического активного центра. 20S-частица собирается из двух половин, каждая из которых содержит β-кольцо, состоящее из семи субъединиц и связанное с семичленным α-кольцом. Полная 20S-частица формируется при соединении двух половин посредством β-колец, которое сопровождается треонинзависимым автолизом пропептидов, в результате чего образуется активный центр протеасомы. Взаимодействие β-колец опосредовано соляными мостиками и гидрофобными взаимодействиями консервативных α-спиралей, причём мутации в них делают невозможной сборку протеасомы. Сборка каждой половины протеасомы начинается с образования гептамерного кольца из α-субъединиц, которое служит в качестве матрицы для сборки β-кольца. Механизм сборки α-кольца не изучен.
Регуляторная частица 19S собирается из двух частей — основания и крышечки. Сборка основания происходит при участии четырёх шаперонов Hsm3/S5b, Nas2/p27, Rpn14/PAAF1 и Nas6/ганкирин (первое название — у дрожжей, второе — у млекопитающих). Шапероны взаимодействуют с ААА-АТФазными субъединицами и обеспечивают формирование из них правильного гексамерного кольца. Сборке основания также способствует деубиквитинирующий фермент Ubp6/Usp14, однако он не является строго необходимым. Пока что неизвестно, связана ли сборка 19S-частицы со сборкой 20S-частицы. Крышечка собирается отдельно от основания без участия шаперонов.
Убиквитинирование и таргетинг
Белки нацелены на деградацию протеасомой посредством ковалентной модификации остатка лизина, что требует скоординированных действий трех ферментов . Во-первых, фермент, активирующий убиквитин (известный как E1), гидролизует АТФ и аденилирует молекулу убиквитина. Затем молекула переносится на остатки цистезина активного центра E1 вместе с аденилированием второй молекулы убиквитина. Эта аденилированная молекула впоследствии передается цистеину второго фермента (E2). Затем член очень разнообразного класса ферментов, известных как лигазы убиквитина (E3), распознает конкретный белок, который должен быть «убиквитирован», и катализирует перенос убиквитина от E2 к белку-мишени. Целевой белок должен быть помечен как минимум четырьмя мономерами убиквитина (в форме полиубиквитиновой цепи), прежде чем он будет распознан одним из двух концов протеасомы. Следовательно, именно белок E3 придает системе специфический субстрат . Количество экспрессируемых белков E1, E2 и E3 зависит от организма и типа клетки, но у человека присутствует много различных ферментов E3, что указывает на огромное количество мишеней для d-системы убиквитина.
Механизм, с помощью которого полиубиквитинированный белок переносится в протеасому, полностью не изучен. Белки рецептора убиквитина имеют N-концевую зону типа «убиквитин-подобный» (UBL) и одну или несколько зон, связанных с убиквитином (UBA для «убиквитин-ассоциированный»). Зоны UBL распознаются капсулами 19S протеасомы, а зоны UBA связывают убиквитин посредством трехспиральных пучков. Эти рецепторные белки, вероятно, сопровождают полиубиквитинированные белки в протеасому, хотя детали этих взаимодействий и их регуляция неясны.
Белок убиквитин состоит из 76 аминокислот и обязан своим названием своей повсеместной природе, поскольку он имеет высококонсервативную последовательность и обнаружен во всех известных эукариотических организмах.
Гены, кодирующие убиквитин, у эукариот расположены парами, что, безусловно, связано с высокой потребностью этих генов в выработке достаточного количества убиквитина для клеток. Выдвигается гипотеза, что убиквитин является самым медленно эволюционирующим белком, идентифицированным на сегодняшний день.
Первая помощь алкоголику в делирии
Белая горячка — очень тяжелый металкогольный психоз, который устраняется только в условиях стационара. Развернутый делирий невозможно вылечить в домашних условиях. Единственно возможная первая помощь алкоголику — как можно раньше заменить признаки абстиненции и отвезти больного в клинику.
Если у человека уже начались галлюцинации, необходимо вызывать скорую помощь, уточнив оператору причину вызова. До приезда скорой алкоголика следует изолировать от окружающих, заперев его в комнате без тяжелых и острых предметов. В крайнем случае (если психическое состояние человека вызывает серьезные опасения, а скорая долго не едет), допускается дать больному успокоительное — 1-2 таблетки Феназепама, Диазепама или около 250 капель Корвалола.
Белая горячка: причины развития, первые признаки и однозначные симптомы
На первый взгляд, волевой отказ алкоголика от спиртного — благо, ведь прекращение злоупотребления положительно отразится на здоровье и социальной жизни человека. Однако алкогольная аддикция очень коварная: зависимость от этанола развивается и на психологическом, и на физическом уровне. Нервная система алкоголика настолько «привыкает» к этиловому спирту, что не может полноценно функционировать без него. Именно из-за физической зависимости после отказа от спиртного возникает абстиненция — алкогольный делирий.
Вопреки распространенному мнению, белая горячка не имеет ничего общего с опьянением. Делирий развивается у запойных алкоголиков, резко прекративших пить. В более 70% случаев причиной прерывания запоя выступает либо сильное ухудшение самочувствия, либо необходимость вернуться к работе. Первые признаки синдрома отмены чаще всего проявляются на 2-3 сутки после отказа от алкоголя, когда весь этанол уже вывелся из организма. Но в отдельных случаях делирий может развиться и позже — на 4-6 день трезвости.
Синдром отмены грозит в первую очередь алкоголикам с 2 и 3 степенью зависимости, злоупотребляющим спиртным не менее 5-7 лет. Но изредка «белочка» диагностируется у больных с 1 стадией зависимости и лиц, употребивших суррогаты алкоголя (косметические лосьоны, технические жидкости, др.).
Ингибиторы протеасом
Ингибиторы протеасом демонстрируют выраженную противоопухолевую активность в культурах клеток, вызывая апоптоз нарушением деградации белков. Благодаря селективному проапоптотическому действию на раковые клетки ингибиторы протеасом прошли успешные клинические испытания на животных и людях.
Первым идентифицированным ингибитором протеасом непептидной природы стал лактацистин, синтезируемый бактериями рода Streptomyces. Лицензией на лактацистин обладает компания Takeda Pharmaceutical. Он нашёл широкое применение в исследовательской работе в области биохимии и клеточной биологии. Лактацистин ковалентно модифицирует N-концевые остатки треонина β-субъединиц, особенно субъединицы β5, которая обладает химотрипсин-подобной активностью. Благодаря лактацистину удалось установить, что протеасома является аминоконцевой треониновой протеазой (первой представительницей нового класса протеаз).
Бортезомиб (торговое название Велкад), разработанный компанией Millennium Pharmaceuticals, стал первым ингибитором протеасом, который начал использоваться в противораковой химиотерапии. Его используют для лечения множественной миеломы. При множественной миеломе в плазме крови выявляется высокий уровень пептидов протеасомного происхождения, который снижается до нормального при лечении бортезомибом. Исследования на животных показали, что бортезомиб может быть эффективен при раке поджелудочной железы. С начала XXI века проводятся доклинические и клинические испытания эффективности бортезомиба при лечении других видов рака B-клеточного происхождения, в частности, некоторых неходжкинских лимфом. Клинические испытания показали эффективность бортезомиба в сочетании со стандартной химиотерапией в борьбе с B-клеточной острой лимфобластной лейкемией. Ингибиторы протеасом в условиях культуры клеток убивают клетки некоторых лейкемий, которые устойчивы к глюкокортикоидам.
Препарат ритонавир (торговое название Норвир) был разработан как ингибитор протеаз для лечения ВИЧ-инфекции. Однако оказалось, что он подавляет не только свободные протеазы, но и протеасомы — точнее, блокирует химотрипсиноподобную активность протеасомы, при этом немного повышая трипсиноподобную активность. Исследования на животных показали, что ритонавир может подавлять рост клеток глиомы.
Как показали эксперименты на животных моделях, ингибиторы протеасом могут быть эффективны при лечении аутоиммунных расстройств. Изучение мышей с пересаженной человеческой кожей показало, что под действием ингибиторов протеаз размер язв, вызванных псориазом, уменьшался. Ингибиторы протеаз также оказались эффективны против астмы на животных моделях.
Мечение и подавление протеасом имеет важное значение для изучения работы протеасом как in vitro, так и in vivo. Чаще всего в исследовательской практике применяют такие ингибиторы протеасом, как лактацистин и пептидный альдегид MG132
Для мечения активных сайтов протеасом были разработаны специфические флуоресцентные ингибиторы.
История открытия
До открытия убиквитин-зависимой системы деградации белков считалось, что деградация белков в клетке происходит, главным образом, за счёт лизосом. Лизосомы — это мембранные органеллы с кислой внутренней средой, содержащей протеазы. Они способны утилизировать экзогенные белки, захваченные клеткой в процессе эндоцитоза, белки, связанные с мембранами, и повреждённые органеллы. Однако в 1977 году Альфред Голдберг доказал существование АТФ-зависимой системы деградации белка в ретикулоцитах, которые лишены лизосом. Это позволило предположить, что существует как минимум ещё один механизм внутриклеточного расщепления белков. В 1978 году было показано, что соответствующая протеаза состоит из полипептидных цепей нескольких типов. Кроме того, при исследовании посттрансляционных модификаций гистонов была обнаружена неожиданная ковалентная модификация: присоединение к боковой цепи лизина в гистоне C-концевого остатка глицина убиквитина — небольшого белка с неизвестной функцией. Было установлено, что описанный ранее АТФ-зависимый фактор протеолиза 1 и убиквитин являются одним и тем же белком. В дальнейшем АТФ-зависимый белковый комплекс, ответственный за убиквитин-опосредованную деградацию белка, был выделен из лизата клеток и назван 26S-протеасомой.
Большая часть ранних работ, которые впоследствии привели к открытию протеасомной системы деградации белков, была выполнена в конце 1970-х — начале 1980-х годов в лаборатории Аврама Хершко в Технионе, где Аарон Чехановер был аспирантом. Ключевые концептуальные идеи Хершко выработал за год работы в лаборатории Ирвина Роуза, хотя Роуз впоследствии и преуменьшал свою роль в открытии. Все трое разделили Нобелевскую премию по химии в 2004 году за открытие этой системы.
Хотя электронно-микроскопические данные, указывающие на то, что структура протеасомы представляет собой несколько колец, уложенных в стопку, были доступны уже в середине 1980-х годов, первая структура коровой части протеасомы, составленная на основе данных рентгеноструктурного анализа, была получена только в 1994 году.
Как в моче появляется альбумин
Выделение этого соединения с мочой – альбуминурия – указывает на неполадки в работе организма, которые не всегда связаны с почечными проблемами. Как же вещество попадает в урину?
Система фильтрации почек, забирающая лишнюю жидкость из кровотока и преобразующая ее в мочу, устроена таким образом, чтобы избежать выведения белка. Даже если белковые молекулы попадут в почечные структуры, они отфильтруются в канальцах, по которым выводится моча.
Этот защитный механизм создан эволюцией для предохранения организма от белковой потери. Однако при некоторых заболеваниях этот процесс нарушается.
Все причины альбуминурии можно разделить на группы:
Клубочковые – при этом нарушении структуры почек – клубочки, в которых проходят сосуды, – не могут полноценно отфильтровать жидкость из плазмы. Причина такого состояния – почечные и сосудистые патологии. В этой ситуации увеличивается проницаемость тканей для белков, что вызывает появление их в моче.
Такое состояние вызывают:
- Различные формы нефритов – воспалений почечной ткани.
- Аутоиммунные нарушения, при которых иммунная система принимает почечные ткани за «чужой белок» и начинает их «атаковать» и разрушать. К таким патологиям относятся IgA-нефропатия, ревматические поражения и волчаночный нефрит.
- Сахарный диабет, сопровождающийся патологическими изменениями в стенках мелких сосудиков-капилляров, проходящих через клубочки.
- Токсикозы беременных. В этот период у женщин очень часто появляется белок в моче, вызванный повышенной нагрузкой на мочевыделительную систему и кровоток.
- Различные инфекции – ВИЧ, гепатит, стрептококковая инфекция, малярия.
- Длительное употребление спиртного и препаратов, действующих на клубочки (нефротоксичных). Такое состояние может возникнуть после длительного приема обычных анальгина, аспирина или парацетамола.
- Злокачественные и некоторые доброкачественные опухоли.
Канальцевые – после фильтрации в клубочках жидкость, называемая первичной мочой, проходит через канальцы, где повторно фильтруется, чтобы вернуть обратно неотфильтрованные до этого белки. Но при заболеваниях, сопровождающихся поражением канальцев, фильтрация не происходит и белковые частицы попадают в мочу.
Причины появления альбуминурии при неправильной работе канальцев – подагра, длительное применение антибиотиков, синдром Фальконе – наследственное заболевание, сопровождающееся неправильной работой мочевыводящих структур.
Преренальные, при которых в плазме увеличивается количество белка, которое не могут отфильтровать почки. Такое состояние возникает при патологиях кроветворения и раке костей. Клубочки просто не в состоянии справиться с возросшим объемом белковой фильтрации. Степень нарушения напрямую зависит от тяжести основного заболевания.
Иногда эти причины могут объединяться с возникновением смешанной альбуминурии. Такое состояние, как правило, наблюдается при тяжелых почечных и внепочечных патологиях.
Доброкачественная альбуминурия вызывается значительными физическими нагрузками, стрессом, большим количеством употребленной белковой пищи, травмами, инфекциями, высокой температурой.
Белок в моче может появляться из-за искривления позвоночника. У больных сколиозом при долгом нахождении в сидячем положении возникает застой в почечных венах и возникает альбуминурия, которую называют ортостатической.
Как правило, серьезных нарушений при таких причинах не появляется, поэтому лечить почки этим больным не нужно. В большинстве случаев достаточно периодической контрольной сдачи анализов.
Предположить, какая именно патология вызвала появление белка, можно по его суточному выделению:
- При поражении клубочков белковые потери могут быть существенными – 30 г/сутки и более.
- При остальных заболеваниях этот показатель находится на уровне 3-4 г/сут.
- При доброкачественной альбуминурии и нарушении работы он не превышает 0,15-2,0 г/сут.
Обнаружение белка в концентрации до 0,15 г/л, если такая ситуация не является постоянной, не должно стать поводом для беспокойства. При появлении высоких концентраций, особенно если это происходит часто или регулярно, нужно выяснить причину этого явления и лечиться.
Как переваривается пища в организме?
Пищеварение — это химический процесс, в ходе которого пища сначала смешивается с желудочным соком, а затем проходит по желудочно-кишечному тракту, постепенно распадаясь на составляющие. Пищеварение начинается даже не в желудке, а во рту, ведь в процессе пережёвывания человек уже измельчает пищу и частично смешивает её со слюной, чтобы облегчить глотание. С этого момента уже можно говорить о начале процесса пищеварение, которое закончится только в тонком кишечнике. Это не такой уж короткий путь.
Желудочно-кишечный тракт состоит из нескольких участков. Желудок и кишечник — это большие полые органы с мышечным слоем, который позволяет приводить в движение их стенки, чтобы пища и жидкость могли продвигаться через пищеварительную систему. Без такой помощи процесс пищеварения был бы невозможен, пища бы просто застаивалась в желудке. Процесс сокращения органов ЖКТ называют перистальтикой и сравнивает с волной, которая проходит вдоль пищеварительного тракта и помогает пище и жидкости медленно продвигаться вперёд. Если пища была предварительно тщательно пережёвана и жидкости было достаточно, то продвигать её по пищеварительному тракту будет проще.
Сможет ли алкоголик вернуться к нормальному образу жизни
Очевидно, что алкогольный делирий не возникает на пустом месте. Его причинами становятся серьезные проблемы со здоровьем, связанные с продолжительным злоупотреблением алкоголя. Лечение приступа проводится в клинике. Его длительность определяется лечащим врачом на основе истории болезни, диагностики и наличия хронических заболеваний.
Следует сказать, что справиться с белой горячкой в домашних условиях невозможно, требуется госпитализация в стационар, где пациент будет под круглосуточным наблюдением медицинского персонала.
“Белочка” наносит ощутимый вред психике человека. Больной даже после лечения может страдать потерей памяти от частичной до полной, повышенной тревожностью, снижением работоспособности. В тяжелых случаях, возможна полная потеря работоспособности и развитие паралича конечностей.
После лечения в стационаре пациенту назначают профилактическое лечение, связанное с полным отказом от спиртного.
Длительность терапевтических мероприятий для последствий “белой горячки” может составлять от нескольких месяцев до нескольких лет. При этом никто не может дать гарантии, что здоровье восстановится полностью.
В заключении отметим, что если продолжить употреблять горячительные напитки, то следующий приступ “белочки” принесет с собой не только более серьезные последствия для здоровья, но и риск летального исхода.
Помогите близкому вернуться к трезвому образу жизни, позвоните по телефону горячей линии центра помощи при алкоголизме “АлкоЗдрав”: 8-800-775-32-63 и запишитесь на первичную консультацию специалиста, чтобы подробнее узнать о лечении алкогольной зависимости.
Легкие цепи иммуноглобулина: κ – каппа, λ – лямбда
Иммуноглобулины синтезируются плазматическими клетками. Каждый иммуноглобулин основан на фрагменте, состоящем из двух идентичных тяжелых полипептидных цепей и двух идентичных легких полипептидных цепей, связанных дисульфидными связями.
Класс и подкласс иммуноглобулинов определяются их тяжелыми цепями. Есть два типа легких цепей иммуноглобулина: κ и λ. Оба варианта легкой цепи присутствуют в каждом классе иммуноглобулинов. Не было обнаружено функциональных различий между иммуноглобулинами с легкими цепями κ или λ. У человека соотношение κ варианты иммуноглобулина к варианту λ составляет 2: 1.
Около 10% легких цепей не связаны с тяжелыми цепями, они свободны. Свободные легкие цепи иммуноглобулина часто встречаются в виде димеров и полимеров. Поскольку антитела к свободным легким цепям часто не реагируют со своими димерными и полимерными формами.
Повышенные значения:
- миелома;
- бессимптомная моноклональная гаммапатия IgA;
- хронические заболевания печени – портальная гипертензия, гепатит;
- хронические инфекции – туберкулез, грибковые заболевания;
- аутоиммунные заболевания – красная волчанка, ревматоидный артрит;
- муковисцидоз, врожденная нейтропения, IgA-нефропатия.
Сниженные значения:
- повышенный метаболизм;
- иммуносупрессивная терапия.