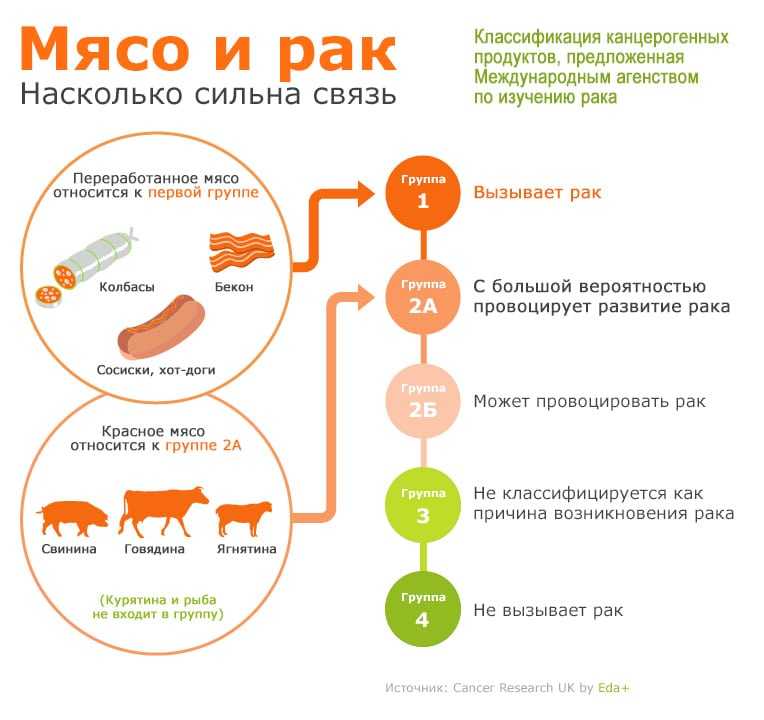
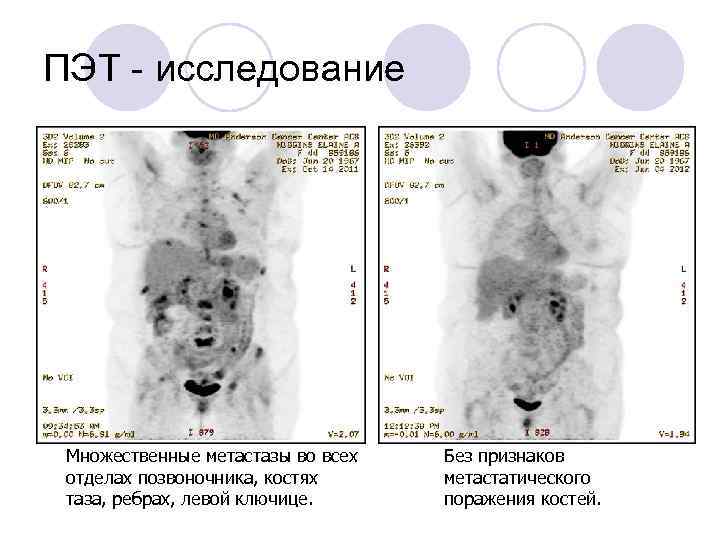
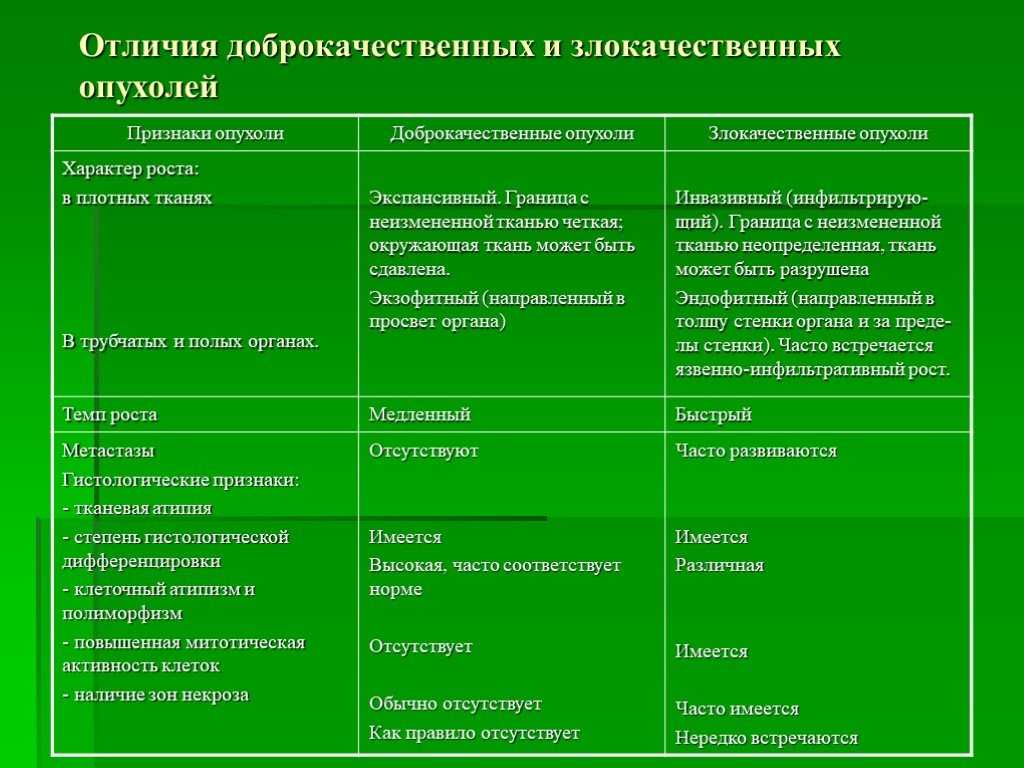
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
- бета-интерфероны (останавливают течение заболевания, снижают риск возникновения рецидивов и инвалидности);
- иммуномодуляторы (воздействуют на активность иммунной системы);
- миорелаксанты (способствуют восстановлению двигательных функций);
- ноотропы (восстанавливают проводниковую активность);
- противовоспалительные (снимают воспалительный процесс, вызвавший разрушение миелина);
- нейропротекторы (предупреждают повреждение нейронов мозга);
- обезболивающие и противосудорожные препараты;
- витамины и антидепрессанты;
- фильтрация ликвора (процедура, направленная на очищение спинномозговой жидкости).
3.Заболевания костного мозга
Все заболевания костного мозга относятся к тяжёлым, поскольку несут серьёзную угрозу жизни. Нарушения в составе крови снижают способность организма адекватно реагировать на угрозы, приходящие извне; усложняется поддержание внутренней стабильности организма; нарушается продуктивность происходящих процессов; возникает дефицит или чрезмерное накопление определённых веществ в органах и тканях; угнетаются иммунные и нервно-психические реакции.
По симптоматике и характеру нарушений выделяют основные заболевания костного мозга:
Апластическая анемия диагностируется, если происходит прекращение функционирования стволовых клеток. Поскольку они не обладают способностью к восстановлению и воспроизводству самих себя, позднее выявление этого заболевания очень опасно. Со временем красный костный мозг полностью замещается жировыми тканями. Причиной такого опасного заболевания, как правило, являются паразиты. Продукты жизнедеятельности гельминтов приводят к интоксикации, угнетающей стволовые клетки костного мозга; Железодефицитная анемия возникает при остром дефиците железа в организме. Причиной такого состояния могут стать большие кровопотери, плохое питание, а также болезни желудочно-кишечного тракта, при которых железо не усваивается, даже если пища разнообразна и включает железосодержащие продукты (яблоки, мясо, яйца, рыбу, печень, ягоды); Лучевая болезнь. Заболевание возникает в результате облучениями большими дозами радиоактивного и иных опасных излучений. Стволовые клетки мозга подвергаются столь серьёзному разрушительному воздействию, что это может стать началом опаснейших трудноизлечимых заболеваний. Экстренные меры здесь должны быть направлены на нейтрализацию воздействия и выведение из организма радиоактивных веществ; Острый лейкоз — нарушение иммунологического контроля над появляющимися время от времени клетками с мутациями. В норме иммунные механизмы вовремя выявляют образование клеток с опасными злокачественными нарушениями и уничтожают их, не давая возможности приступить к самовоспроизводству. Если появляются достаточно устойчивые раковые клетки или их образование под действием каких-то факторов слишком ускоряется, иммунные механизмы не справляются и позволяют клеткам-мутантам начать бесконтрольный рост и размножение. В результате здоровые клетки крови и костного мозга постепенно вытесняются больными, что очень опасно. Происходят нарушения во всех процессах жизнедеятельности, поскольку кровь уже не может в полной мере выполнять свои функции. Лишь своевременная диагностика и лечение дают больному шанс на выздоровление.
Костный мозг — это жизненно важный орган. Любые нарушения в его работе несут серьезную угрозу для всего организма. При малейшем подозрении на заболевание костного мозга нельзя медлить с обращением к врачу, поскольку чаще всего прогноз для таких больных напрямую зависит от стадии заболевания, на которой начато лечение.
Функции
Основными функциями миелиновой оболочки являются:
- изоляция аксона;
- ускорение проведения импульса;
- экономия энергии за счет сохранения ионных потоков;
- опора нервного волокна;
- питание аксона.
Как работают импульсы
Нервные клетки изолированы благодаря своей оболочке, но все же взаимосвязаны между собой. Участки, в которых клетки соприкасаются, называются синапсы. Это место, где встречаются аксон одной клетки и сома или дендрит другой.
Электрический импульс может передаваться внутри одной клетки или от нейрона к нейрону. Это сложный электрохимический процесс, который основан на перемещении ионов через оболочку нервной клетки.
В спокойном состоянии внутрь нейрона попадают только ионы калия, а ионы натрия остаются снаружи. В момент возбуждения они начинаются меняться местами. Аксон положительно заряжается изнутри. Затем натрий перестает поступать через мембрану, а отток калия не прекращается.
Изменение напряжения из-за движения ионов калия и натрия называется «потенциал действия». Он распространяется медленно, но миелиновая оболочка, обволакивающая аксон, ускоряет это процесс, препятствуя оттоку и притоку ионов калия и натрия из тела аксона.
Проходя через перехват Ранвье, импульс перескакивает с одного участка аксона на другой, что и позволяет ему двигаться быстрее.
После того, как потенциал действия пересекает разрыв в миелине, импульс останавливается, и возвращается состояние покоя.
Такой способ передачи энергии характерен для ЦНС. Что касается вегетативной нервной системы, в ней часто встречаются аксоны, покрытые малым количеством миелина или вообще не покрытые им. Скачки между шванновскими клетками не осуществляются, и импульс проходит гораздо медленнее.
Определение, классификация, группы риска и принципы диагностики
Амилоидоз – группа заболеваний, отличительным признаком которых является отложение в тканях и органах
фибриллярного гликопротеида амилоида. Специфическое свойство амилоида, отличающее его от других фибриллярных
белков стромы, – способность к двойному лучепреломлению, что проявляется свечением в поляризованном свете
предварительно окрашенных конгокрасным препаратов амилоида с изменением красного цвета конгофильных амилоидных
отложений на яблочно-зеленый (дихроизм).
В основе амилоидогенеза лежит синтез большого количества нестабильных белковпредшественников, которые
агрегируются с образованием амилоидной фибриллы. Клю чевое значение имеет амилоидогенность основного
белка-предшественника амилоида, специфичного для каждой формы амилоидоза (в настоящее время известно более 30
таких белков), обозначение которого положено в основу современной классификации заболевания (ВОЗ, 2016 г.).
Названия типов амилоида включают в себя букву А, означающую “амилоид», и обозначение конкретного фибриллярного
белка амилоида – А (амилоидный А-протеин), L (легкие цепи иммуноглобулинов), TTR (транстиретин), β2М
(β2-микроглобулин), В (В-протеин), IAPP (островковый амилоидный полипептид). Используют также
производные наименования – иммуноглобулиновый амилоидоз (AL), транстиретиновый (ATTR) и др. (табл. 1) .
Следует отметить, что Международная классификация болезней (МКБ) 10-го пересмотра базируется на клиническом
принципе, не учитывает особенности патогенеза различных форм амилоидоза и не позволяет обосновать адекватное
лечение.
| Белок амилоида | Белок-Белок-предшественник | Клиническая форма амилоидоза |
|---|---|---|
| АА | SSA-белок | Вторичный амилоидоз при хронических воспалительных заболеваниях, в том числе периодической болезни и синдроме Макла-Уэллса |
| AL | λ, κ-легкие цепи иммуноглобулинов | Амилоидоз при плазмоклеточных дискразиях – идиопатический, при миеломной болезни и макроглобулинемии Вальденстрема |
| ATTR | Транстиретин | Семейные формы полиневропатического, кардиопатического и др. амилоидоза, системный старческий амилоидоз |
| Аβ2М | β2-микроглобулин | Диализный амилоидоз |
| AGel | Гелсолин | Финская семейная амилоидная полиневропатия |
| AApoAI | Аполипопротеин А-I | Амилоидная полиневропатия (III тип по van Allen, 1956 г.) |
| AFib | Фибриноген | Амилоидная нефропатия |
| Aβ2 | β-белок | Болезнь Альцгеймера, синдром Дауна, наследственные кровоизлияния в мозг с амилоидозом |
| APrPScr | Прионовый белок | Болезнь Крейтцфельда-Якоба, болезнь Герстманна-Штраусслера-Шейнкера |
| AANF | Предсердный натрийуретический фактор | Изолированный амилоидоз предсердий |
| AIAPP | Амилин | Изолированный амилоидоз в островках Лангерганса при сахарном диабете 2 типа, инсулиноме |
| ACal | Прокальцитонин | При медуллярном раке щитовидной железы |
| ACys | Цистатин С | Наследственные кровоизлияния в мозг с амилоидозом (Исландия) |
АА-амилоидоз чаще всего развивается при ревматоидном артрите, серонегативных спондилоартропатиях,
аутовоспалительных наследственных периодических лихорадках, в том числе периодической болезни (семейной
средиземноморской лихорадке), а также при хронических нагноениях, туберкулезе. АА-амилоид образуется из
сывороточного предшественника SAA (serum amyloid A) – острофазового белка, продуцируемого в значительных
количествах в ответ на воспаление. По этой причине АА-амилоидоз называют также реактивным или вторичным.
Клинические формы AL-амилоидоза обусловлены единым этиологическим фактором – В-лимфоцитарной дискразией,
характеризующейся формированием аномального клона плазматических или В-клеток в костном мозге, которые
продуцируют аномальные иммуноглобулины, обладающие амилоидогенностью (легкие цепи моноклонального
иммуноглобулина, чаще λ, реже κ-типа). При первичном AL-амилоидозе плазмоклеточная дискразия относительно более
доброкачественная, в то время как при В-гемобластозах (множественной миеломе, болезни Вальденстрема и др.) она
обладает признаками злокачественной опухоли. Аномальный амилоидогенный клон плазматических клеток может
формироваться также из плазмоцитов, локализующихся вне костного мозга, что может привести к развитию локального
амилоидоза. Наиболее распространенные локальные формы AL-амилоидоза – амилоидоз трахеи, бронхов и гортани,
мочевого пузыря. Выявление плазмоклеточной дискразии необходимо для диагностики AL-амилоидоза, а также для
оценки его риска и дифференциального диагноза.
Прогноз по заболеваниям
В настоящее время лечение демиелинизации не дает стопроцентного результата, но учеными активно ведутся разработки лекарственных средств, направленных на восстановление мякотной оболочки. Исследования проводятся по следующим направлениям:
- Стимуляция олигодендроцитов. Это клетки, производящие миелин. В организме, пораженном демиелинизацией, они не работают. Искусственная стимуляция этих клеток поможет запустить процесс восстановления разрушенных участков миелиновой оболочки.
- Стимуляция стволовых клеток. Стволовые клетки могут превращаться в полноценную ткань. Есть вероятность, что они могут заполнять и мякотную оболочку.
- Регенерация гематоэнцефалического барьера. При демиелинизации этот барьер разрушается и позволяет лимфоцитам негативно влиять на миелин. Его восстановление защищает миелиновый слой от атаки иммунной системы.
Возможно, в скором времени заболевания, связанные с разрушением миелина, перестанут быть неизлечимыми.
Методы диагностики
На сегодняшний день существует несколько основных методов, позволяющих выявить наличие повреждений ДНК в гене ТР53:
- Секвенирование. В результате анализа происходит расшифровка последовательности целого гена, что позволяет найти все существующие в нем мутации. Они могут возникать как в нормальных клетках, увеличивая вероятность злокачественной трансформации, так и в опухолевых, что предопределяет дальнейшее прогрессирование новообразования. Данный метод применяется при подозрении на наследственные синдромы, когда мутации в гене являются инициирующим событием. В остальных случаях существуют значительные сложности с интерпретацией выявленных повреждений ДНК.
- Иммуногистохимический анализ (ИГХ). Данный метод исследования является основным в клинической практике. Он позволяет оценить экспрессию в исследуемой ткани белка р53, увеличение концентрации которого говорит о нарушении в работе соответствующего гена и, как правило, сопряжено с высокой пролиферативной активностью клеток (что позволяет дифференцировать дисплазии и злокачественные опухоли) и чаще всего является признаком неблагоприятного прогноза.

Метод ПЦР (полимеразная цепная реакция) для поиска повреждений ДНК в гене ТР53 является несколько устаревшим. В настоящее время используется он очень редко, когда необходимо подтвердить наличие или отсутствие конкретной мутации. Однако в связи с большим их разнообразием, в диагностическом процессе при наличии такой необходимости, в настоящее время предпочтение отдается полногеномному секвенированию.
Иммуногистохимический метод позволяет косвенно оценить состояние гена ТР53 по концентрации белка р53, которая для разных тканей в норме может значительно отличаться. Поэтому заключение о наличии нарушения делает морфолог.
Для проведения ИГХ, на первом этапе выполняется биопсия. Затем полученная ткань фиксируется на стекле, к ней добавляются специфические антитела, меченные красителем. Результаты могут быть оценены при помощи обычного светового микроскопа.
Таким образом, по количеству связанного красителя в ткани можно визуально оценить содержание белка. Система оценки двумерная:
- Оценивается интенсивность окраски от 0 до 3 баллов. При этом 0 баллов — окраска отсутствует, а 3 — сильное окрашивание.
- Оценивается доля окрашенных клеток, которая в зависимости от числового значения переводится в баллы.
В заключение отметим, что поскольку организм — сложная система, то мутации в одном гене лишь повышают вероятность, но не гарантируют развитие опухоли в организме. Поэтому любое исследование, показавшее то или иное нарушение в работе гена ТР53 должно быть интерпретировано доктором в комплексе с учетом клинической картины и использованного метода.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Диагностика недостатка витаминов
Диагноз базируется на данных анамнеза, клинической картине, результатах обследования. Какие анализы сдавать пациенту определяет врач, но существует перечень лабораторных исследований, которые назначаются в первую очередь при подозрении на гиповитаминоз.
- Определение уровня витаминов и минералов (кальция, фосфора) в сыворотке крови в моче.
- Спектральный анализ волос, ногтей на микроэлементы.
- Общий и биохимический анализ крови.
- Коагулограмма.
- Анализ мочи, кала.
Если гиповитаминоз вызван заболеванием, то назначаются дополнительные исследования для установления природы патологии: рентген, УЗИ, ФГДС, магнитно-резонансная и компьютерная томография.
На современном уровне развития медицины, как узнать каких витаминов не хватает в организме, не представляет особых трудностей. Помимо лабораторных тестов применяются функциональные пробы, целью которых является установление уровня насыщения витаминами организма.
Насыщенность организма витамином А исследуют при помощи теста сумеречной адаптации зрения, а уровень витамина С определяют вакуумным тестом устойчивости капилляров.
Как это может использоваться в борьбе с раком?
Это открытие позволяет по-новому взглянуть на терапию рака. Если норадреналин действительно с помощью сосудисто-метаболического «переключателя» стимулирует образование новых кровеносных сосудов, то терапия бета-блокаторами может обладать свойствами, препятствующими росту опухолевых клеток. Это предположение может быть проверено в клинических исследованиях в самое ближайшее время, т.к. бета-блокаторы уже много лет используются в качестве препаратов для снижения артериального давления. По мнению Френетте, перспективным могло бы быть сочетание бета-блокаторов и блокаторов сосудистого роста.
Что может показать тест на CRP?
С-реактивный белок проявляется как защитная реакция организма. Его функция – в участии в иммунном ответе, заключающемся в инактивации воспалительного фактора и стимуляции функции иммунных клеток.
Количественное тестирование CRP имеет меньшую диагностическую ценность в случае хронических воспалительных заболеваний, например, ревматических заболеваний, поскольку значение CRP может варьироваться от 10 до 1000 мг / л. Однако диагностически важным является тот факт, что уровень СРБ связан со степенью и активностью воспалительного процесса. Мониторинг изменений концентрации С-реактивного белка – уменьшение или увеличение – информирует о стадии воспаления, его угасании или неудачи терапии.
Перед тем как пройти тест на СРБ, рекомендуется заранее проконсультироваться с врачом и обсудить любые медицинские условия, могущие повлиять на его результаты.
Важно, чтобы на консультации врача были учтены факторы риска, связанные с образом жизни, другие медицинские состояния и семейный анамнез. В случае риска сердечно-сосудистых заболеваний могут быть назначены: эхокардиограмма, компьютерная томография коронарных артерий, стресс-тест, катетеризация сердца или электрокардиограмма
Причины гиповитаминоза
В организме человека синтезируются только 4 витамина:
- Витамин Д, который вырабатывается в коже под воздействием ультрафиолетового облучения.
- Витамин А синтезируется из каротиноидов, входящих в состав некоторых продуктов.
- Витамины В3 и К производятся бактериальной микрофлорой кишечника.
Все остальные витамины должны поступать в организм вместе с продуктами питания.
Гиповитаминозы делят на две группы:
Пищевой (экзогенный) гиповитаминоз, развивающийся в результате длительного недостаточного поступления в организм витаминов.
Причинами развития экзогенного гиповитаминоза служат:
- Недостаточное содержание в пищевом рационе продуктов, которые являются основными поставщиками витаминов в организм.
- Разрушение структуры витаминов в результате термической обработки или неправильного хранения продуктов.
- Несбалансированное питание по основным пищевым ингредиентам: белкам, жирам, углеводам, витаминам, минералам.
- Антагонизм с некоторыми лекарственными препаратами.
- Диеты, голодание, вегетарианство, религиозные запреты.
Эндогенный гиповитаминоз, при котором на фоне нормального уровня витаминов в организме, существуют трудности с его усвоением при нарушении процессов всасывания, транспортировки, метаболизма.
Эндогенные гиповитаминозы – частые спутники хронических патологий пищеварительной системы (болезнь оперированного желудка, панкреатиты, энтериты, гельминтозы, дисбактериозы, патологии почек), онкологических заболеваний, затяжных инфекционных процессов, системных поражений соединительной ткани.
Дефицит жирорастворимых витаминов часто связан с различными диетами, ограничивающими потребление жиров с пищей.
Состояния, при которых повышается потребность организма в витаминах:
- Беременность и время грудного вскармливания ребенка.
- Периоды интенсивного роста у детей.
- При тяжелых физических нагрузках: у профессиональных спортсменов, у людей, занимающихся физическим трудом.
Длительно существующие стрессовые ситуации.
- Острые и хронические заболевания.
- Пожилой или старческий возраст.
- Хронический алкоголизм.
Симптомы
Симптомы полинейропатии зависят от ее причины и особенностей поражения волокон. К наиболее распространенным признакам патологии относят:
- снижение чувствительности стоп и ладоней, приводящая к субъективному ощущению надетых носков или перчаток;
- боли в пораженных конечностях (острые или тупые, кратковременные или тянущие, обычно усиливаются в покое и в ночное время);
- судороги и подергивания мышечных волокон;
- болезненность при прикосновении к коже или нажатии на пораженную конечность;
- снижение рефлексов;
- повышенную потливость конечностей;
- трофические нарушения: отеки, изменения цвета кожи и ее сухость, трофические язвы;
- слабость мышц рук и ног, мелкий тремор;
- парестезии: патологические ощущения ползанья мурашек, жжения, похолодания;
- атрофия мускулатуры;
- синдром беспокойных ног.
Алкогольная полинейропатия
Эта форма заболевания поражает чаще всего нижние конечности. Она развивается при длительном бесконтрольном употреблении спиртных напитках и проявляет себя, в первую очередь, жжением и ощущением покалывания в ногах. При дальнейшем развитии патологии пациент начинает ощущать онемение и судороги в мышцах, которые развиваются за счет сопутствующей нехватки витаминов группы В.
Диабетическая полинейропатия
Повышенный уровень сахара становится причиной поражения нервов стоп (дистальный вариант) и верхней части ног (проксимальный вариант). В первом случае человек ощущает характерный комплекс симптомов:
- онемение и снижение болевой чувствительности;
- периодические жгучие боли;
- мышечную слабость;
- снижение рефлексов;
- нарушение координации движений, проявляющееся шаткостью походки.
Сочетание полинейропатии с поражением мелких сосудов ведет к появлению трофических язв в нижней части голени. Проксимальный вариант поражения характеризуется резкими болями в ягодице и верхней части бедра, а также постепенной атрофией мышц в этой области.
Дисциркуляторная энцефалопатия, нарушение кровообращения
Нервная система человека расходует огромное количество энергии, и поэтому очень зависима от обеспечения питанием. Доставка кислорода, глюкозы и других необходимых веществ обеспечивается артериальной кровью. С венозной кровью эвакуируются подлежащие утилизации продукты обмена веществ. При дефиците кровоснабжения мозговое вещество или постепенно атрофируется (энцефалопатия) или гибнет в течение нескольких часов (инсульт).
Нарушение мозгового кровообращения может быть связано с сужением и закупоркой кровеносных сосудов по различным причинам:
- Васкулит (воспаление кровеносных сосудов из-за иммунной атаки или инфекции). Это довольно опасное заболевание приводит обычно к постепенной мелкоочаговой гибели вещества головного мозга. При МР-томографии васкулит часто путают с различного рода энцефалопатиями, рассеянным склерозом. Подробнее здесь
- Атеросклероз – это отложение жира (холестерина) между слоями внутренних стенок кровеносных сосудов. Отложение происходит в виде бляшек. Бляшки выбухают внутрь артерий и препятствуют току крови, вызывая хронический дефицит кровообращения, с постепенной атрофией мозгового вещества. Наибольшую опасность представляют разорвавшиеся бляшки, жировые массы из которых попадают в кровь и закупоривают меньшие по диаметру артерии (инсульт, острое нарушение мозгового кровообращения, инфаркт мозга).
- Повышение свертываемости и вязкости крови препятствует похождению крови по самым мелким кровеносным сосудам (капиллярам) и вызывает хронический дефицит кровоснабжения мозга. Кроме того, возможно внутрисосудистое свертывание крови с закупоркой сосуда (инсульт, острое нарушение мозгового кровообращения, инфаркт мозга).
- Сдавление или извитость кровеносного сосуда. Обычно страдают артерии, проходящие через шейные позвонки (позвоночные артерии), что является причиной головокружения, потери равновесия, зрительных и слуховых расстройств.
Лечение нарушения мозгового кровообращения в нашей клинике начинается с точного обнаружения его причины. Так мы подбираем метод лечения, реально эффективный именно в данном случае. Для диагностики мы используем:
- Анализ крови на жиры, маркеры васкулита и свертываемость;
- УЗДГ и/или МР-ангиографию для уточнения места сужения кровеносного сосуда;
- Рентгенографию, КТ или МР-томографию для поиска опасных для сосудов деформаций шейных позвонков.