Соли цинка
Практически все соли, которые не являются двойными и комплексными, то есть не содержат посторонних окрашенных ионов, — это бесцветные кристаллические вещества. Самыми популярными в плане использования человеком являются следующие из них.
- Хлорид цинка — ZnCL2. Другое название соединения — паяльная кислота. Внешне представляет собой белые кристаллики, хорошо впитывающие влагу воздуха. Используется для очищения поверхности металлов перед пайкой, получения фибры, в батарейках, для пропитки дерева перед обработкой в качестве дезинфектора.
- Сульфид цинка. Белый порошок, быстро желтеющий при нагревании. Имеет высокую температуру плавления, в отличие от чистого металла. Используется при производстве люминесцирующих составов, наносимых на экраны, панели и прочие предметы. Является полупроводником.
- Фосфид цинка — распространенная отрава, применяемая для избавления от грызущих животных (мышей, крыс).
- Смитсонит, или карбонат цинка — ZnCO3. Бесцветное кристаллическое соединение, нерастворимое в воде. Применяется в нефтехимическом производстве, а также в реакциях получения шелка. Является катализатором в органических синтезах, используется в качестве удобрения для почв.
- Ацетат цинка — (CH3COO)2Zn. Бесцветные кристаллы, хорошо растворимые во всех растворителях любой природы. Находит широкое применение как в химической, так и в медицинской и пищевой промышленности. Используется для лечения нозафарингита. Применяется в качестве пищевой добавки Е650 — освежает дыхание, предупреждает появление налета на зубах, когда входит в состав жвачки. Его же используют для протравливания красителей, консервации древесины, производства пластмасс и прочих органических синтезах. Практически везде играет роль ингибитора.
- Йодид цинка — белые кристаллы, используемые в рентгенографии, в качестве электролита в аккумуляторах, как краситель для электронных микроисследований.
- Черные или темно-зеленые кристаллы, которые невозможно получить прямым синтезом, так как цинк с азотом не реагирует. Образуются из аммиаката металла. При высоких температурах разлагается с высвобождением цинка, поэтому применяется для его получения.
- Нитрат цинка. Бесцветные гигроскопичные кристаллы. Применение цинка в таком виде осуществляется в текстильной и кожевенной промышленностях для протравки тканей.

Как эритроциты переносят гемоглобин в организме
Проходя через капилляры легких, где имеется наибольшее напряжение кислорода, гемоглобин крови целиком насыщается кислородом. Этот процесс совершается по законам диффузии газов.
Затем оксигемоглобин переносится в капилляры других тканей организма, где напряжение кислорода очень низкое благодаря чему он легко отделяется от гемоглобина. Освободившийся кислород используется клетками для поддержания их энергетического обмена.
Отечественный ученый П. А. Коржуев на примерах особей животного мира различного уровня развития показал, что расстановка разных видов животных в эволюционном ряду зависит от обеспеченности их гемоглобином (следовательно, и кислородом).
- Так, например, у рыб на килограмм веса тела гемоглобина сравнительно немного;
- У земноводных (следующая ступень развития) немного больше;
- Еще больше его у птиц и т. д.
- Самое большое его количество содержит кровь млекопитающих.
Что происходит с погибшими эритроцитами
Основная задача эритроцитов — переноска кислорода. Они обладают минимальным обменом веществ. В среднем они живут 100—120 дней. Старея, эритроциты подвергаются распаду: в конце своей жизни в селезенке, и печени приклеиваются к особым клеткам на стенках сосудов.
Такие клетки обладают способностью захватывать различные высокомолекулярные и чужие частицы, попадающие в кровь. Этот процесс поглощения (фагоцитоз) распространяется также и на состарившиеся эритроциты, которые для организма стали уже чужеродными.
Непосредственное отношение к процессу кроворазрушения имеет селезенка. Этот орган — «губчатый мешок» из очень рыхлой ткани, переполненной кровью, способен разрушать красные кровяные тельца, что дало повод уже давно называть ее «кладбищем» этих клеток. (По некоторым данным, свыше 70% всех эритроцитов, закончивших свой жизненный цикл, оказываются именно в ней).
Следует отметить, что у здорового человека селезенка разрушает лишь старые или случайно поврежденные красные тельца. Каков же механизм освобождения крови от тех из них, что уже отжили или повреждены? Это удалось открыть с помощью интересных опытов на животных с использованием современной электронной микроскопии.
Крысам вводили токсические для эритроцитов вещества и наблюдали прохождение их через стенку сосудов селезенки. Нормальные клетки легко фильтруются через сосудистые поры: при прохождении через них «гибкие» эритроциты меняют свою форму и проскальзывают в общем токе крови.
Но, старея или повреждаясь, становясь менее эластичными они больше неспособны проникать через капилляры, фильтруются в селезенке и поглощаются (фагоцитоз) ретикуло-эндотелиальными клетками. При распаде в печени эритроцитов образуется пигмент билирубин, который в кишечнике, под влиянием микробов подвергается дальнейшему химическому превращению.
Лейкоциты — строение и функции
Лейкоциты — вторая основная составляющая крови, имеют ядро, протоплазму, или цитоплазму (от «цито» — клетка). Отдельные из них способны активно двигаться, наподобие простейших организмов, например, амеб.
В крови человека содержится в 1000 раз меньше лейкоцитов, чем эритроцитов.
Виды лейкоцитов
Лейкоциты бывают зернистыми и незернистыми. Зернистые лейкоциты или гранулоциты имеют протоплазму нагруженную зернами. Незернистые лейкоциты или агранулоциты зерен не содержат или содержат очень мало.
Незернистые и зернистые лейкоциты отличаются друг от друга несколькими признаками:
- способностью восприятия клетками кислых и щелочных красок;
- отсутствием или наличием зерен в цитоплазме;
- отличием в строении ядра;
- формой.
Так, например, цитоплазма эозинофила в окрашенном мазке содержит крупную зернистость, напоминающую кетовую икру, а базофильные лейкоциты имеют зерна, окрашивающиеся в фиолетово-синий цвет.
Защитная функция лейкоцитов
Некоторые формы лейкоцитов (прежде всего нейтрофилы и моноциты) поразительно способны к фагоцитозу, т. е. к поглощению и перевариванию различных микробов; простейших организмов, отживших клеток и всяких чужеродных веществ, попадающих в организм.
Присущая лейкоцитам защитная функция проявляется лишь после выхода из кровеносных сосудов. При кровотоке лейкоциты обволакивают внутренние стены капилляров и во множестве уходят из сосудов, протискиваясь между эндотелиальными клетками. При своем следовании они обнаруживают и переваривают в себе микробы и различные инородные тела.
Процесс движения лейкоцитов из сосудов в ткани совершается при посредстве вытягивания протоплазмы и образования ее выростов — так называемых ложноножек (псевдоподий). Лейкоциты активно проходят через неповрежденные стенки сосудов, легко проникают через оболочки (мембраны), двигаются в соединительной ткани.
Роль эозинофилов и базофилов остается еще недостаточно изученной. Больше сведений мы имеем в отношении лимфоцитов. Они образуются в лимфатических узлах, разбросанных по всему организму и в селезенке. (Количество лимфоидной ткани составляет около 1% веса тела!) Изучение продолжительности жизни лимфоцитов с использованием радиоактивной метки доказало, что они циркулируют в крови 100—200 дней, и лишь небольшая их часть исчезает из кровяного русла через 3—4 дня.
Причины дефицита цинка
Факторами, негативно влияющими на усвоение цинка, являются:
- загрязнение окружающей среды,
- стресс,
- использование стимуляторов,
- плохо сбалансированное, однообразное меню,
- потребление продуктов с высокой степенью переработки.
Важной причиной дефицита цинка в организме являются заболевания желудочно-кишечного тракта, которые ухудшают и нарушают всасывание питательных веществ в кишечнике. Все заболевания, связанные с нарушением питания, могут привести к недостаточному поступлению цинка в организм
Его дефицит также может быть вызван увеличением спроса на него, как это происходит во время беременности, кормления грудью или во время интенсивного роста.
Недостаток цинка наблюдается и у людей, злоупотребляющих алкоголем.
Пожилые люди, госпитализированные пациенты, профессиональные спортсмены и вегетарианцы также подвержены повышенному риску.
Применение цинка
Около 20% получаемого цинка тратится на создание цинковых сплавов. В них самый значимый легирующий компонент — это алюминий или медь. Часто применяют цинк и для создания медного сплава — латуни.Широко применяется этот металл для процедуры цинкования стали, создания цинковых полуфабрикатов, а также образования цинковых соединений.Около трети цинкового проката занимают цинковые листы, которые необходимы для изготовления химических источников тока, оцинкованных предметов посуды. Больше половины изготовленных цинковых листов используется в строительной отрасли, в качестве кровельных материалов, для создания водосточных труб. На строительную отрасль приходит 65% этого материала.Но самым востребованной отраслью применения цинка является покрытие металлических конструкций в целях предотвращения коррозии. На это тратится почти 50 % добытого цинка.Цинковый слой отлично защищает металл от действия воздуха, морской воды, грунтовых вод, и даже от слабощелочных растворов.Широкое применение оцинкованная сталь нашла в автомобильной промышленности. На такое покрытие лучше ложится краска, долгое время не разрушается. Сотрудники автомобильных предприятий из оцинкованных полос и листов создают днища, топливные баки, крышки багажников, кожухи на колеса, и прочее.
Комплексный эффект
Крупные инвестиционные проекты всегда больше и шире конкретных производственных показателей и прибылей для инвесторов. Их реализация предполагает проведение научных исследований, использование передовых технологических разработок, развитие инфраструктуры (а значит, и новые возможности для других промышленных отраслей), финансовую и социальную отдачу для региона, где идет работа. Так происходит и с освоением Павловского месторождения.
В частности, «Первая горнорудная компания» не так давно представила инновационные технологические решения для этого инвестпроекта. Они учитывают и суровый арктический климат, и хрупкую экологию Арктики. Предполагается, например, что сборка обогатительной фабрики будет идти на материке, затем ее установят на плавучей платформе и отбуксируют на Новую Землю. Кроме прочего, это позволит отказаться от работы на вечномерзлых грунтах, что, с одной стороны, сохранит их целостность, а с другой – сократит производственные затраты. Такой подход в будущем может применяться не только на Павловском месторождении, но и на других арктических горнодобывающих проектах.

Что касается экономического и социального эффектов для Архангельской области, то в регионе благодаря освоению Павловского месторождения будет создано более 800 рабочих мест непосредственно в ГОКе и портовом комплексе. Кроме того, будет создан дополнительный «фронт работ» для десятков предприятий региона, которые станут партнерами проекта. А значит, и на этих предприятиях будут открыты вакансии.
После введения в эксплуатацию горно-обогатительного комбината вырастут налоговые поступления в бюджеты всех уровней. По предварительным оценкам, бюджет Архангельской области получит не меньше 1 млрд рублей в год.
Богатства на поверхности
Геологоразведка Безымянского рудно-полиметаллического узла (назван в честь реки Безымянной на острове Южном) велась с начала 1990-х годов. А в 2001-м экспедиция «Первой горнорудной компании» открыла серебросодержащее месторождение свинцово-цинковых руд, которое назвали Павловским.
Запасы Павловского несколько раз уточнялись. По последним данным, они составляют 2,48 млн тонн цинка, 465 тыс. тонн свинца, 670 тонн серебра. Прогнозные ресурсы свинца и цинка оцениваются в общей сложности в 19 млн тонн. Это делает Павловское месторождение одним из самых крупных на планете.
Еще одна особенность Павловского – неглубокое залегание руд при их хорошей обогатимости плюс относительно простое геологическое строение. Это дает возможность вести открытую добычу на месторождении. Логистическим преимуществом является его близость к крупнейшим европейским предприятиям, перерабатывающим рудные концентраты. То есть у инвестпроекта есть все перспективы стать высокорентабельным.

Токсичность
При длительном поступлении в организм в больших количествах все соли цинка, особенно сульфаты и хлориды, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжелое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление оксидом цинка происходит при вдыхании его паров. Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
AllMetals
Цинк
Сплав меди и цинка – латунь – был получен намного раньше, чем металлический цинк. Самые древние латунные предметы, сделанные примерно в 1500 г. до н.э., найдены при раскопках в Палестине. Приготовление латуни восстановлением особого камня – χαδμεια (кадмея) углем в присутствии меди описано у Гомера, Аристотеля, Плиния Старшего. В частности, Аристотель писал о добываемой в Индии меди, которая «отличается от золота только вкусом».
Можно предполагать, что металл из кадмеи и в древности добавляли в медь не только затем, чтобы осветлить ее. Меняя соотношение цинка и меди, можно получить многочисленные сплавы с различными свойствами. Не случайно латуни поделены на две большие группы – альфа и бета-латуни. В первых цинка не больше 33%.
Когда впервые был выплавлен металлический цинк, точно не установлено. Известно, что в Индии его получали еще в V в. до н.э. Получение металлического цинка (под названием тутии или фальшивого серебра) описано у римского историка Страбопа (60…20 годы до н.э.). Позже, однако, искусство выплавки цинка в Европе было утрачено. Правда, цинк ввозили из стран Востока, но в очень небольших количествах, и до середины XVIII в. он оставался редкостью.
Лишь в 1743 г. в Бристоле заработал первый в Европе цинковый завод. А ведь еще в конце XIII в. Марко Поло описывал, как получают этот металл в Персии. Крупнейшие ученые XVI в. Парацельс и Агрикола в своих трудах уделяли место выплавке цинка. В том же XVI в. были предприняты первые попытки выплавлять его в заводских условиях. Но производство «не пошло», технологические трудности оказались непреодолимыми. Цинк пытались получать точно так же, как и другие металлы. Руду обжигали, превращая цинк в окись, затем эту окись восстанавливали углем.
Цинк, естественно, восстанавливался, взаимодействуя с углем, но… не выплавлялся. Не выплавлялся потому, что этот металл уже в плавильной печи испарялся – температура его кипения всего 906°C. А в печи был воздух. Встречая его, пары активного цинка реагировали с кислородом, и вновь образовывался исходный продукт – окись цинка.
В средневековой Европе не было специального производства цинка, хотя его небольшие количества получались при производстве свинца, серебра и латуни. Начиная примерно с 1605, его импортировала из Китая Восточно-Индийская Компания. Английская цинковая промышленность появилась в районе Бристоля в начале 18 в., и ее продукция быстро проникла в Силезию и Бельгию.
Происхождение названия элемента неясно, однако кажется правдоподобным, что оно произведено от Zinke (по-немецки «острие», или «зуб»), благодаря внешнему виду металла.
Как был открыт Цинк
Такой химический элемент как цинк свою историю начинает очень давно. Первые известные сведения о применении цинка, пусть даже непреднамеренного, датируются около 14 века до Нашей Эры. Иудейская латунь найденная археологами содержала 23% цинка. Так же найдены украшения на месте раскопок в современной Греции, которые содержат от 80% до 90% цинка созданные ориентировочно в 5 веке до Нашей Эры. Еще одной поразительной находкой археологов являются таблетки, которые были найдены на борту затонувшего римского корабля «Relitto del Pozzino». Эти таблетки представляют собой гидрокарбонат цинка и датируются 140 годом до Нашей Эры. К сведению найденные таблетки являются самыми старыми таблетками в мире, которые предположительно использовались против воспаления глаз.

В период Нашей Эры первые сведения о применении цинка исходят от Римской империи. Они научились изготавливать каламинную латунь путем плавки карбоната цинка, древесного угля и меди. Исходя из исторических сведений из каламинной латуни изготавливалось преимущественно вооружение. Чуть позже(примерно 400 год) в древних текстах индийской медицины(«Чарака самхит») упоминается металл, который при окислении образует «Пушпанджан». Предполагается, что индийский «Пушпанджан» являлся оксидом цинка. Первое плавление цинка началось ориентировочно в XII веке, а в период с XII по XIV век было произведено уже около 60 000 тонн цинка.
Само название металла впервые упоминается в книге Парацельса «Liber Mineralium II» как «цинкен», которая датируется XVI веком. Это слово в переводе с немецкого означает заостренный или зазубренный. Само открытие металла осуществилось гораздо позже, но есть вероятность, что первооткрывателем цинка является немецкий металлург Андреас Либавиус. Он, в 1596 году, взял образец металла с захваченного португальского корабля и описал его физические и химические свойства. По его задокументированному описанию этот металл может быть цинком. Цинк, как отдельный элемент, научились извлекать в Индии еще в конце XIII века, но в Европе он появился только в XVI веке.
Читайте: Медь как химический элемент таблицы Менделеева
Открытие цинка
Возможным претендентом на право открытия цинка принадлежит французскому металлургу и алхимику ПМ де Респуру. В 1668 году он сообщил, что извлек чистый химический элемент из оксида цинка. В начале XVIII века французский исследователь Этьен Франсуа Жоффруа описал как оксид цинка в виде желтых кристаллов конденсируется на слитках железа, помещенных над цинковой рудой. Спустя половину века, в 1738 году Вильям Чампион запатентовал процесс выплавки цинка. Суть патента заключается в выплавке цинка из каламина в вертикальной плавильной печи. Его техника получения цинка напоминала ту, которую использовали в Раджастхане. На сегодняшний день Раджастхан выглядит как северная часть Индии. Научный мир передал право первооткрывателя цинка немецкому химику Андреасу Маргграфу. Хотя шведский химик Антон фон Сваб перегонял цинк из каламина раньше на четыре года. В своем эксперименте 1746 года Маргграф нагревал смесь каламина и древесного угля в закрытом сосуде без меди. В ходе эксперимента он получал чистый цинк.
Читайте: Никель как химический элемент таблицы Менделеева
Минералогия и изменения
Рудные минералы в месторождениях замещения карбонатов обычно представляют собой сульфид свинца, галенит и сфалерит сульфида цинка . Выветрившиеся эквиваленты образуют англезит , церуссит , смитсонит , гидроцинкит и вторичный галенит и сфалерит в зоне гипергенеза .
Месторождения MVT и ирландского типа обычно связаны с изменением «доломитового фронта», которое проявляется в виде желто-кремовой размывки доломита (карбонат кальция-магния) в ассоциациях кальцита и арагонита неизмененных карбонатных формаций.
Большинство рудных тела довольно сульфидные, и большинство из них очень низкое содержания железа, с пиритом — марказит содержанием , как правило , ниже 30% от массы сульфидов. Благодаря этому свинцово-цинковые отложения MVT особенно легко поддаются обработке с металлургической точки зрения. Однако некоторые месторождения МВТ могут быть очень богатыми железом, а некоторые зоны замещения сульфидов и гидротермальных изменений вообще не связаны со свинцово-цинковыми отложениями, что приводит к массивным скоплениям пирита-марказита, которые по существу бесполезны.
Существует иногда ассоциация с кварцевым прожилком и колломорфным кремнеземом, однако силикатные жильные минералы часто являются редкими.
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии был запатентован дистилляционный способ получения цинка. В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом. В 1746 А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C . Первый в России цинк был получен на заводе «Алагир» 1 января 1905 года. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США.
Тромбоциты — строение и функции
В крови есть еще третий форменный элемент—тромбоциты (кровяные пластинки).
Тромбоциты, как бы осколки протоплазмы производящих их гигантских клеток костного мозга — мегакариоцитов. Оказывается, что из одного мегакариоцита может образоваться до 400 пластинок. В 1 мм3 крови их насчитывается 250—400 тыс.
Размер кровяных пластинок очень мал — от 2 до 5 микрон. Они формой круглые или овальные, не имеют ядра. Сроки пребывания их в крови от 3 до 5 дней.
Клетки эти играют огромную роль в процессах свертывания крови и занимают ключевую позицию в процессе остановки кровотечения.
Основное, значимое свойство тромбоцитов — прилипать и покрывать чужеродную поверхность. Они при этом становятся больше размером и растягиваются принимая звездчатую форму. При повреждении мелких кровеносных сосудов тромбоциты устремляются к месту повреждения, прилипают кучкой и образуют собой тромб закрывающий место дефекта сосуда.
Вокруг него оседают нити фибрина и эритроциты, цвет тромба меняется на красный. Благодаря выпадению фибрина головка тромба плотно фиксируется к поврежденному сосуду и задерживает переход крови из сосуда наружу.
Что снижает уровень цинка в организме, а что увеличивает?
Человек получает цинк в основном с пищей. Его абсорбция увеличивается натощак и в присутствии витамина B6, витамина A, и некоторых аминокислот. С другой стороны, алкоголь, клетчатка, фитаты и оксалаты снижают его усвояемость. Цинк легче усваивается из рациона, богатого животными белками, чем из продуктов на основе растительных белков.
Продукты, богатые цинком (содержание цинка в мг на 100гр продукта):
- Пшеничные отруби 15 -16
- Печень телячья (жареная) 15
- Угри (вареные) 13
- Говядина, баранина, свинина 7-9
- Кунжутное, маковое семя 7,5-8
- Тыквенные семечки (нежаренные) 7,5
- Куриное сердца (отварные) 7
- Кедровые орехи 4-6,5
- Какао (натуральный) 6,5
- Печень баранья (жаренная) 6
- Семена подсолнечника, льна (нежаренные) 5,5
- Соевая мука (грубого помола) 4,8
- Язык говяжий (отварной) 4,7
- Соя, бобы 4,2
- Бразильский орех 4
- Чечевица 3,8
- Капуста кольраби 3,5
- Пшеничная мука (цельнозерновая) 3
- Гречневая, ячневая, овсяная каша 2,5-3
- Арахис, грецкий орех 2,7
- Утка, индейка 2,5
- Миндаль, кешью, лесной орех 2,1
- Фасоль, горох 1,6-2,5
- Курага (без обработки) 0,75
- Чернослив (без обработки) 0,45
- Зелёный лук 0,4
- Капуста цветная, авокадо, редис, морковь 0,3
Дефицит цинка можно восполнить с помощью соответствующих пищевых добавок. Однако, учтите, что такие препараты никогда не могут заменить здоровую и сбалансированную диету, а их чрезмерное употребление или неправильная конфигурация могут быть вредными.
Перед тем, как начать их использовать, обязательно проконсультируйтесь с врачом. Стоит знать, что при некоторых заболеваниях цинк является одним из элементов лечения.
Ионы цинка помогают при симптоматическом лечении неприятного запаха изо рта, связывая сульфидные радикалы и останавливая рост некоторых бактерий.
Цинк препятствует всасыванию меди из желудочно-кишечного тракта, что используется при лечении болезни Вильсона (генетически обусловленное заболевание, при котором накопление меди в организме приводит к повреждению органов).
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
-
- 2Zn + O2 → 2ZnO
Оксид цинка реагирует как с растворами кислот:
-
- ZnO + 2HCl → ZnCl2 + H2O
так и щелочами:
-
- ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Цинк обычной чистоты активно реагирует с растворами кислот:
-
- Zn + 2HCl → ZnCl2 + H2↑
и растворами щелочей:
-
- Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Цинк в природе
В природе в чистом виде этот металл не встречается. Это обусловлено тем, что взаимодействие цинка с кислородом во влажной атмосфере начинается уже при комнатной температуре.
Существует 66 цинксодержащих минералов. Наиболее часто встречается сфалерит. Его название по-гречески означает обманчивый. Оно было дано из-за сложности в идентификации породы. Металл представлен в нем в виде сульфида.

Важную роль играют следующие минералы:
- цинкит;
- виллемит;
- каламин;
- смитсонит;
- франклинит и т. д.
Содержание элемента в земной коре 0,0083%. Он тяготеет к изверженным породам, концентрация его в которых достигает 0,013%. Кислые участки им бедны. В России месторождения полиметаллических руд, несущих до 4% сульфида цинка, находятся в Нижнем Приангарье и в западной части Таймырского полуострова.
Большое количество сульфида цинка растворено в воде. Его осаждение востребовано промышленностью.
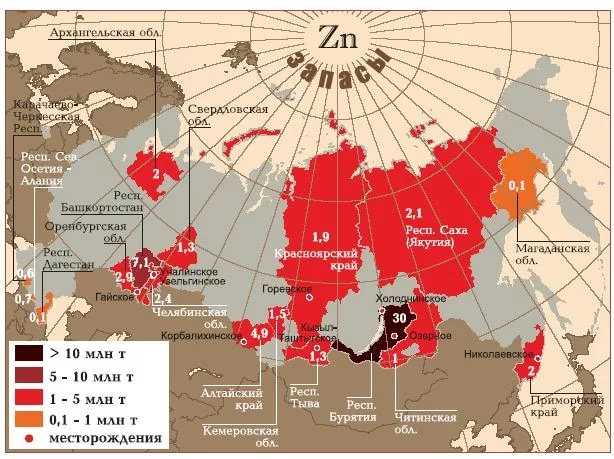
Месторождения цинка
Залежи цинковой руды встречаются почти во всех государствах. Активная добыча цинка ведется в 50 из них. Лидирующие позиции по разработке месторождений занимают: Китай, Австралия, Перу, Европа и Канада. В руде цинк содержится вместе другими металлами. Встречаются медные, золотые и серебряные примеси.Самые крупные месторождения сфалерита (ZnS). Он имеется в 98% руд, которые сегодня разрабатывают. Цинковые руды, залегают довольно близко к поверхности земли, чаще всего это оксиды и карбонаты.Геологически доказанные запасы цинка на нашей планете достигают примерно 1900 млн. тонн, запасы (найденные и доступные для разработки) – почти 250 млн. тонн. Самые масштабные залежи цинковой руды расположены на территории Австралии. Там они занимают более 22% от общего количества. В Китае находится примерно 17%.
В нашей стране месторождения цинка достигают 62 млн.т., или чуть больше 3% мирового запаса. Примерно 80% цинковых месторождений расположены под землей, 8% находятся на поверхности, и еще 12% являются комбинированными. Но, по объемам производства:
- в карьерах добывают 15%
- в подземных шахтах 64%
- комбинированные запасы дают 21%.








![Участие микроорганизмов в образовании и разрушении горючих пород [1969 германов н.и. - микробиология]](http://mediaex.ru/wp-content/uploads/a/f/6/af6053e327420520a1fc32cf14b4145a.jpeg)